Los inhibidores de los puntos de control inmunitarios están encontrando un uso cada vez más generalizado en oncología, con algunos éxitos revolucionarios. Sin embargo, la activación del sistema inmunitario también desencadena una amplia gama de efectos secundarios. También se observan efectos secundarios neurológicos, poco frecuentes, pero entonces potencialmente graves. Entonces se necesita una buena gestión.
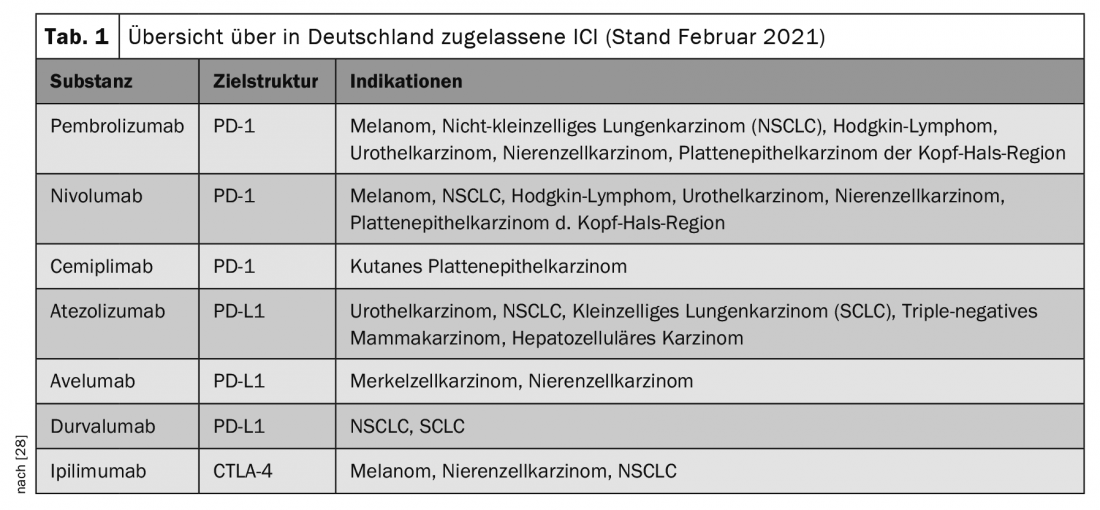
En la terapia oncológica, los llamados inhibidores del punto de control inmunitario (ICI) se han utilizado cada vez más en los últimos años y han supuesto un gran avance en la terapia de diversas neoplasias malignas, a veces con remisiones duraderas o permanentes. Las indicaciones se amplían constantemente y se aprueban nuevas sustancias, de modo que los ICI se utilizan en la terapia de un número cada vez mayor de tipos tumorales (Tabla 1).
Los ICI son anticuerpos específicos dirigidos contra los puntos de control inmunitarios. Ejemplos de estas moléculas de punto de control son el receptor 1 de muerte celular programada (PD-1), el ligando PD-1 (PD-L1) o el antígeno 4 de linfocitos T citotóxicos (CTLA-4) [1].
En condiciones fisiológicas, los puntos de control inmunitario en la maduración de las células T y B ocupan una posición clave para la autotolerancia y la modulación del sistema inmunitario. Así, CTLA-4 tiene principalmente una función inhibidora en el cebado de las células T, mientras que PD-1 y PD-L1, como par receptor/ligando, desempeñan un papel inhibidor en la fase efectora, es decir, en el ataque de la célula T con un receptor de células T ya específico en la célula tumoral [2]. Las células tumorales utilizan estas moléculas de punto de control para la invasión inmunitaria, activándolas para inhibir el sistema inmunitario del propio organismo dirigido contra ellas. Por ejemplo, muchas células tumorales expresan PD-L1 y pueden utilizar este mecanismo para inhibir células T específicas dirigidas contra las células tumorales uniéndose a su receptor PD-1 y escapar a la destrucción por el propio sistema inmunitario del organismo. Esta evasión inmunitaria debería evitarse bloqueando los receptores mencionados con ICI, promoviendo así la respuesta inmunitaria antitumoral.
Actualmente se está investigando sobre combinaciones de quimioterapia convencional, inhibidores de la tirosina quinasa, radioterapia e ICI, así como sobre otros puntos de control como dianas o sobre la combinación de diferentes ICI. Los estudios mostraron pruebas de un efecto sinérgico de la radioterapia local seguida de la administración sistémica de ICI. Se supone que el tejido tumoral desintegrado por la radioterapia, con antígenos liberados y neoantígenos específicos del tumor, favorece el cebado de las células T y puede provocar así una respuesta antitumoral sistémica más potente [2].
Sin embargo, debido a la activación del sistema inmunitario mediada por la ICI, no es sorprendente que pueda desencadenarse una amplia gama de fenómenos autoinmunes (acontecimiento adverso relacionado con el sistema inmunitario; irAE) o que se desencadenen enfermedades autoinmunes y paraneoplásicas ya existentes como efectos secundarios. Dependiendo del punto de control inhibido, se observaron irAEs en el 70-90%, la mayoría de los cuales fueron de gravedad leve (grado 1 o 2 según los CTCAE (Criterios Terminológicos Comunes para Efectos Adversos) [1]. Los órganos más comúnmente afectados por la irAE son el intestino, la piel, los pulmones, el hígado y los órganos endocrinos. En cambio, las irAE neurológicas (nirAE), que pueden afectar al sistema nervioso central y periférico, a la placa terminal neuromuscular y a la musculatura, son poco frecuentes [3]. Debido al creciente uso de los ICI, los conocimientos sobre los nirAE aumentan continuamente, aunque la mayor parte de las pruebas obtenidas hasta el momento se han generado principalmente a través de informes de casos, series de casos retrospectivas y metaanálisis; hasta el momento faltan grandes estudios prospectivos sobre efectos secundarios. Por lo tanto, las frecuencias notificadas de nirAE difieren enormemente. Se observaron nirAEs de grado 1-2 en el 6-12%, nirAEs graves de grado 3-4 en el 0,1-1% de los pacientes tratados [4]. Las enfermedades autoinmunes preexistentes no parecen conllevar un riesgo significativamente mayor de desarrollar nuevos irAEs con el tratamiento con ICI [5]. Sin embargo, se trata de un tema controvertido debido a los aún muy limitados datos disponibles. Los irAEs bajo terapia con ICI se producen de media en las primeras 12 semanas tras el inicio de la terapia con ICI [6]. En casos individuales, sin embargo, la duración puede variar enormemente, desde unos pocos días después de la primera administración de ICI hasta más de un año después del inicio de la terapia o incluso después de que haya finalizado la administración de ICI.
Por supuesto, deben descartarse otros diagnósticos diferenciales neurológicos por los medios diagnósticos adecuados. Los posibles nirAE deben detectarse y tratarse precozmente, ya que son poco frecuentes pero a veces se asocian a una elevada morbilidad y mortalidad [7,8].
Aquí se ofrecerá una visión general de los nirAEs conocidos en la actualidad. Las enfermedades asociadas a la ICI imitan en parte cuadros clínicos neurológicos bien conocidos, pero se dan en combinaciones inusuales o representan un nuevo tipo de fenómeno. Sin embargo, la gravedad, el manejo terapéutico y la evolución difieren considerablemente de los cuadros clínicos neurológicos clásicos.
Sistema nervioso periférico
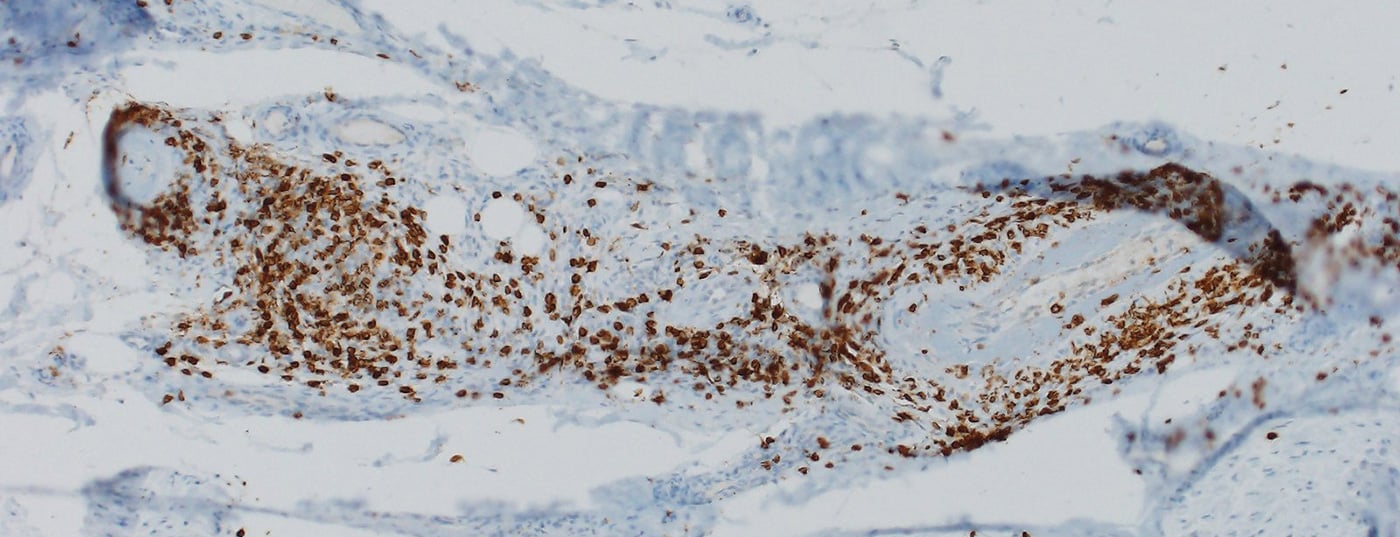
La mayoría de las nirAEs afectan al sistema nervioso periférico [9]. Se observaron polineuropatías en aproximadamente el 3% de los pacientes tratados con ICI. Las neuropatías asociadas a la ICI pueden ser tanto axonales como desmielinizantes y presentan diferentes patrones de distribución, entre los que se incluyen la mononeuropatía, la mononeuritis múltiple, la polineuropatía simétrica, la neuropatía de fibras pequeñas, la neuropatía autonómica, la amiotrofia neurálgica, la meningorradiculitis y la afectación de los nervios craneales [10,11]. También se han descrito polineuropatías periféricas vasculíticas y mononeuritis múltiple positiva para p-ANCA (Fig. 1) [12,13]. Dependiendo de la gravedad, debe considerarse la pausa de la ICI, la administración de esteroides y/o la separación del plasma (para eliminar los anticuerpos que aún sean terapéuticamente eficaces). Sin embargo, a menudo sólo hay síntomas leves, por lo que la terapia con ICI puede continuarse en función del contexto general [9,10]. La respuesta de las neuropatías asociadas a ICI a los esteroides es buena.
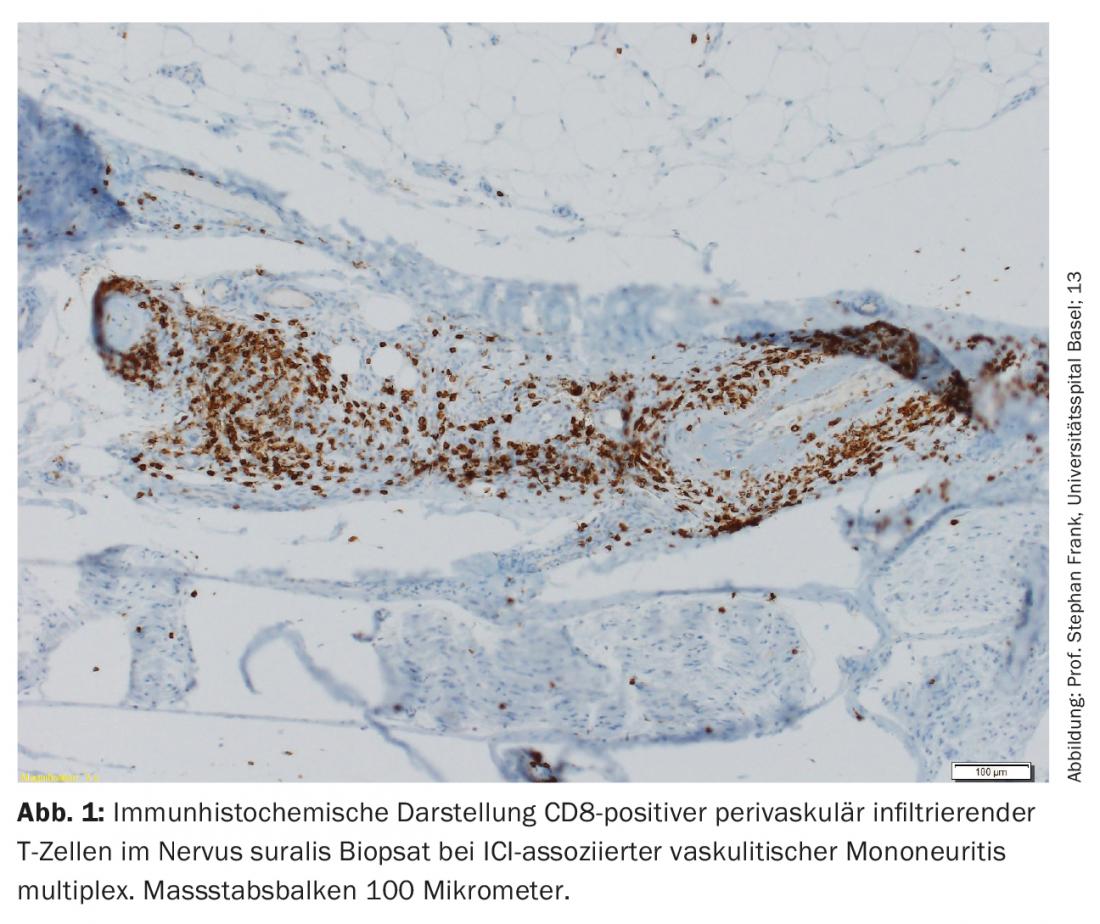
El paradigma es una polineuropatía desmielinizante inflamatoria aguda (AIDP), en la que el cuadro clásico de una disociación citoalbuminosa con proteínas elevadas y bajo recuento celular es menos evidente en el LCR, sino que es característica una leve pleocitosis (hasta 15 células/μl) además del aumento de proteínas [9]. Un curso crónico (CIDP) es raro. En caso de AIDP (síndrome similar al de Guillain-Barré), la administración de ICI debe interrumpirse de forma permanente y debe iniciarse la administración de dosis altas de esteroides en combinación con inmunoglobulinas intravenosas (IVIG) o plasmaféresis en vista de la amenaza potencial para la vida [14].
También se ha descrito una miositis dolorosa con paresia troncular como síntoma principal, especialmente bajo terapias anti-PD-1 [15]. A veces se producen de forma aislada, pero a menudo en combinación con el síndrome miasténico o una afección similar a la AIDP. La miocarditis concomitante es frecuente y debe tenerse siempre en cuenta, ya que tiene una elevada mortalidad (alrededor de 1/3 de los casos) [16]. Se conocen tanto la dermatomiositis como la polimiositis y la miositis necrotizante aguda con un fenotipo histopatológico característico [9]. Hasta el momento no se han detectado anticuerpos paraneoplásicos o autoinmunes específicos. En la mayoría de los casos, la mejoría de los síntomas se produjo tras interrumpir la administración de ICI y la inmunosupresión.
La miastenia gravis, en un 60% con anticuerpos anti-AChR positivos, se diagnosticó en alrededor del 0,1-0,2% de los pacientes en tratamiento con ICI [17]. Se vieron afectadas sobre todo las regiones ocular y bulbar, seguidas de las extremidades proximales. En una gran proporción, la creatina quinasa (CK) estaba elevada como signo de (cardio)miositis concomitante [15]. El curso era a menudo grave con una elevada mortalidad. En consecuencia, se recomienda la interrupción permanente de la ICI y de la terapia inmunosupresora. A diferencia de la miastenia gravis clásica, aquí también se recomienda el uso precoz (bien supervisado) de dosis altas de esteroides debido a la buena respuesta [14]. Dado que los esteroides pueden provocar un empeoramiento temporal de la debilidad muscular con riesgo de insuficiencia respiratoria, debe considerarse la administración de IGIV o la realización de plasmaféresis antes de los esteroides [3]. La respuesta a la terapia sintomática con, por ejemplo, piridostigmina, es variable.
Sistema nervioso central
Se observó encefalitis asociada en el 0,1-0,2% de los pacientes tratados con ICI. Los anticuerpos paraneoplásicos como los anticuerpos anti-Ma-2, anti-Hu, anti-CASPR2 o anti-receptor NMDA se encontraron con frecuencia [18,19]. Los hallazgos patológicos en LCR con pleocitosis linfocítica son típicos, los hallazgos en RMN varían de poco destacables a hiperintensidades en T2 a casos aislados con captación regional de contraste en el neurocráneo [20]. La evolución suele ser favorable cuando se interrumpe la administración de ICI y se utilizan esteroides, aunque se han descrito evoluciones mortales [21,22].
Los trastornos endocrinológicos se diagnostican en un 4,9-17% en el contexto de la hipofisitis, especialmente durante la terapia con el anticuerpo anti-CTLA-4 ipililumab a una dosis superior a 3 mg/kg. A dosis más bajas, la incidencia es significativamente menor [23]. Como la reacción inmunitaria daña rápidamente la hipófisis de forma irreversible, suele ser necesaria una sustitución hormonal a largo plazo. En consecuencia, la recomendación terapéutica actual es sustituir las hormonas correspondientes, pasar el ICI y administrar corticoides sólo en casos individuales, ya que esto rara vez conduce a una mejoría relevante [24].
Especialmente bajo la inhibición de CTLA-4, se observó meningitis aséptica en el 0,1-0,2% de los pacientes. Además del aumento del recuento de células, a menudo se encontró un aumento de proteínas en el líquido cefalorraquídeo en ausencia de detección de patógenos. Con el tratamiento con esteroides y la interrupción de la administración de ICI, los síntomas suelen remitir [3].
En casos individuales se han descrito exacerbaciones asociadas a la ICI de enfermedades inflamatorias preexistentes del SNC, como la esclerosis múltiple, así como el desarrollo de novo de esclerosis múltiple. Sin embargo, la terapia puede realizarse bajo una estrecha vigilancia neurológica en la esclerosis múltiple [25,26]. También se ha informado de neuromielitis óptica mediada por anticuerpos de aquaporina-4 y de mielitis transversa seronegativa. También se han descrito casos individuales de síndrome de tolosa-hunt asociado a ICI, neurosarcoidosis, síndromes similares al PRES o vasculitis del SNC [27,28].
Resumen Recomendación de terapia
Debido a la falta de datos prospectivos, las recomendaciones terapéuticas se basan en la experiencia de expertos y en informes de casos. Como norma general, el tratamiento con ICI debe interrumpirse inmediatamente en caso de irAE grave. Para los irAE más leves (grado 1-2), a menudo puede reanudarse la administración de ICI. Se trata sobre todo de decisiones caso por caso, sopesando la gravedad del nirAE y el riesgo de progresión tumoral si se suspende la ICI. En los irAE no neurológicos, de los que se dispone de más datos debido a su mayor frecuencia, la respuesta a los esteroides suele ser buena. Esto también se aplica a nirAE. El grado de utilidad de una combinación con inmunoglobulinas y/o separación plasmática depende de la gravedad del nirAE y del tipo de ICI (por ejemplo, monoterapia frente a terapia combinada). Sorprendentemente, los AIDP asociados a ICI suelen responder bien a los esteroides, en contraste con el síndrome de Guillain-Barré clásico. Debido a la larga semivida del ICI, de 2-4 semanas según el preparado, se recomienda administrar prednisolona a 0,5-2 mg/kgKG, según la gravedad del nirAE, durante 2-4 semanas y luego disminuir lentamente la dosis de esteroides. Las recidivas de irAE al reducir los esteroides son frecuentes, por lo que éstos sólo deben reducirse lentamente a lo largo de unas semanas [24]. Si los síntomas no son sensibles a los esteroides, pueden utilizarse inmunoglobulinas intravenosas (IGIV) o plasmaféresis [3]. Se necesitan estudios prospectivos para optimizar los regímenes de tratamiento y seleccionar a los pacientes para las distintas opciones de tratamiento (monoterapia frente a terapia combinada). Una contribución esencial a la seguridad terapéutica de estos pacientes, a menudo muy complejos y multimórbidos, es la cooperación interdisciplinar de neurólogos y oncólogos. Aquí deben definirse personas de contacto concretas.
Mensajes para llevarse a casa
- nirAEs como complicaciones raras pero potencialmente graves de la terapia con ICI.
- Cualquier tipo de enfermedad autoinmune posible como nirAE, que afecta más a menudo al sistema nervioso periférico.
- Dependiendo de la gravedad, interrupción terapéutica de ICI y/o esteroides como terapia primaria.
Literatura:
- Heinzerling L, De Toni E, Schett G, et al. (2019): Inhibidores de los puntos de control. Dtsch. Arztebl. Int. 116: 119-126
- Riggenbach E, Ermiş E, Elicin O, et al. (2021): Combinación de radio e inmunoterapia. Swiss Med Forum 21(5-6): 78-82.
- Astaras C, de Micheli R, Moura B, et al. (2018): Efectos adversos neurológicos asociados a los inhibidores de los puntos de control inmunitario: diagnóstico y tratamiento. Curr. Neurol. Neurosci. Rep. 18
- Martins F, Sofiya L, Sykiotis GP, et al. (2019): Efectos adversos de los inhibidores de los puntos de control inmunitarios: epidemiología, gestión y vigilancia. Nat. Rev. Clin. Oncol. 16: 563-580
- Menzies AM, Johnson DB, Ramanujam S, et al. (2017): Terapia anti-PD-1 en pacientes con melanoma avanzado y trastornos autoinmunes preexistentes o toxicidad importante con ipilimumab. Ann Oncol 28(2): 368-376.
- Weber JS, Hodi FS, Wolchok JD, et al. (2017): Perfil de seguridad de la monoterapia con nivolumab: Un análisis conjunto de pacientes con melanoma avanzado. J Clin Oncol 35(7): 785-792.
- Hottinger AF (2016): Complicaciones neurológicas de los inhibidores de los puntos de control inmunitarios. Curr. Opinen. Neurol. 29: 806-812
- Kao JC, Liao B, Markovic SN, et al. (2017): Complicaciones neurológicas asociadas a los anticuerpos anti-muerte programada 1 (PD-1). JAMA Neurol 74(10): 1216-1222.
- Harrison RA, Tummala S, de Groot J (2020) Toxicidades neurológicas de las inmunoterapias contra el cáncer: una revisión. Curr. Neurol. Neurosci. Rep. 20
- Gu Y, Menzies AM, Long GV, et al (2017): Neuropatía inmunomediada tras la inmunoterapia de puntos de control. J. Clin. Neurosci. 45: 14-17
- McNeill CJ, Fehmi J, Gladwin J, Price C (2019): Un caso poco frecuente de variante Miller Fisher del síndrome de Guillain-Barr é (SGB) inducido por un inhibidor del punto de control. BMJ Case Rep 12(8).
- Daxini A, Cronin K, Sreih AG: Vasculitis asociada a los inhibidores de los puntos de control inmunitarios: una revisión sistemática. Reumatología clínica 2018; 37: 2579-2584.
- Baldauf MC, Kapauer M, Joerger et al. (en prensa, aceptado para su publicación en febrero de 2021): Mononeuritis múltiple vasculítica CD8+ asociada a pembrolizumab en un paciente con mesotelioma. Neurología: Neuroinmunología y Neuroinflamación.
- Thompson JA, Schneider BJ, Brahmer J, et al. (2020): Manejo de las toxicidades relacionadas con la inmunoterapia, versión 1.2020 con actualizaciones de las directrices de la NCCN. JNCCN J Natl Compr Cancer Netw 18(3): 231-241.
- Touat M, Maisonobe T, Knauss S, et al. (2018): Miositis y miocarditis relacionadas con inhibidores de puntos de control inmunitarios en pacientes con cáncer. Neurología 91(10): e985-e994.
- Moreira A, Loquai C, Pföhler C, et al. (2019): Miositis y efectos secundarios neuromusculares inducidos por los inhibidores de los puntos de control inmunitarios. Eur J Cancer 106:12-23.
- Makarious D, Horwood K, Coward JIG (2017): Miastenia gravis: una toxicidad emergente de los inhibidores de los puntos de control inmunitarios. Eur J Cancer 82: 128-136
- Mongay-Ochoa N, Vogrig A, Muñiz-Castrillo S, Honnorat J (2020): Síndromes paraneoplásicos asociados a Anti-Hu desencadenados por el tratamiento con inhibidores de los puntos de control inmunitarios. J Neurol 267: 2154-2156
- Nowosielski M, Di Pauli F, Iglseder S, et al. (2020): Encefalomieloneuritis y artritis tras el tratamiento con inhibidores de puntos de control inmunitarios. Neurol Neuroinflamación Neuroinmunol 7(4).
- Nishijima H, Suzuki C, Kon T, et al. (2021): Lesiones talámicas bilaterales asociadas a la encefalitis autoinmune inducida por el atezolizumab. Neurología 96(3): 126-127.
- Touat M, Talmasov D, Ricard D, Psimaras D (2017): Toxicidades neurológicas asociadas a los inhibidores de los puntos de control inmunitarios. Curr. Opinen. Neurol. 30: 659-668
- Johnson DB, McDonnell WJ, Gonzalez-Ericsson PI, et al. (2019): Informe de un caso de activación clonal de células T CD4+ con memoria similar al VEB en una encefalitis fatal inducida por inhibidores de puntos de control. Nat Med 25(8): 1243-1250.
- Maker AV, Yang JC, Sherry RM, et al. (2006): Escalada de dosis intrapaciente del anticuerpo anti-CTLA-4 en pacientes con melanoma metastásico. J Immunother 29(4):455-463.
- Haanen JBAG, Carbonnel F, Robert C, et al. (2017): Manejo de las toxicidades de la inmunoterapia: Guías de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol 28(suppl_4): iv119-iv142.
- Donia M, Pedersen M, Svane IM (2017): Inmunoterapia contra el cáncer en pacientes con trastornos autoinmunes preexistentes. Semin. Inmunopatología. 39: 333-337.
- Hasan Ali O, Berner F, Ackermann CJ, et al. (2020): Fingolimod y linfocitos infiltrantes tumorales en pacientes con cáncer tratados con inhibidores del punto de control. Cancer Immunol Immunother 70(2).
- Narumi Y, Yoshida R, Minami Y, et al. (2018): Trastorno del espectro de la neuromielitis óptica secundario al tratamiento con el anticuerpo anti-PD-1 nivolumab: Primer informe. BMC Cáncer 18(1).
- Fan S, Ren H, Zhao L, et al. (2020): Efectos adversos neurológicos relacionados con la inmunidad asociados a los inhibidores de los puntos de control inmunitarios: una revisión de la bibliografía. Asia Pac J Clin Oncol. 16: 291-298.
- Rote Liste® Service GmbH Lista Roja. www.rote-liste.de. Consultado el 27 de febrero de 2021
InFo NEUROLOGíA Y PSIQUIATRÍA 2021; 19(2): 6-9.