El cáncer de ovario se ha convertido en una enfermedad crónica. Las secuencias terapéuticas con cirugía, terapias sistémicas aditivas y paliativas, además de terapias de mantenimiento en diferentes líneas son complejas. La discusión de los datos actuales ayuda a aplicarlos en la práctica clínica.
El cáncer de ovario se ha convertido en una enfermedad crónica, las secuencias terapéuticas con cirugía, terapias sistémicas aditivas y paliativas, más las terapias de mantenimiento en varias líneas son complejas. ¿Cómo debemos aplicar los numerosos datos nuevos en la vida cotidiana? Las directrices ESMO/ESGO publicadas recientemente [1] constituyen una orientación útil. Este artículo de revisión informa sobre lo nuevo e importante en 2019.
El cáncer de ovario, cuyo 90% es de origen epitelial, es el tumor ginecológico con mayor mortalidad con diferencia en los países industrializados. En Europa, unas 65.000 mujeres contraen la enfermedad cada año y unas 42.000 mueren a causa de ella. Por desgracia, en unos dos tercios de los casos, el diagnóstico sigue realizándose sólo en estadios avanzados (FIGO III, IV), cuando la enfermedad ya ha podido extenderse fuera de la pelvis. En ese caso, la supervivencia a 5 años es sólo de un 20-30% [2]. Por desgracia, no disponemos de exámenes de cribado para la detección precoz que mejorarían el pronóstico (por ejemplo, ecografía transvaginal, determinaciones de marcadores tumorales [CA-125]) [3]. Con enfoques terapéuticos optimizados, se están realizando intensos esfuerzos para mejorar el pronóstico de las mujeres que padecen cáncer de ovario. Todavía hay una gran necesidad de acción en este sentido.
Tratamiento primario
Cirugía o quimioterapia: ¿qué es lo primero? La cirugía citorreductora máxima con el objetivo de la ausencia de tumor macroscópico al final de la cirugía es crucial para el pronóstico [4].
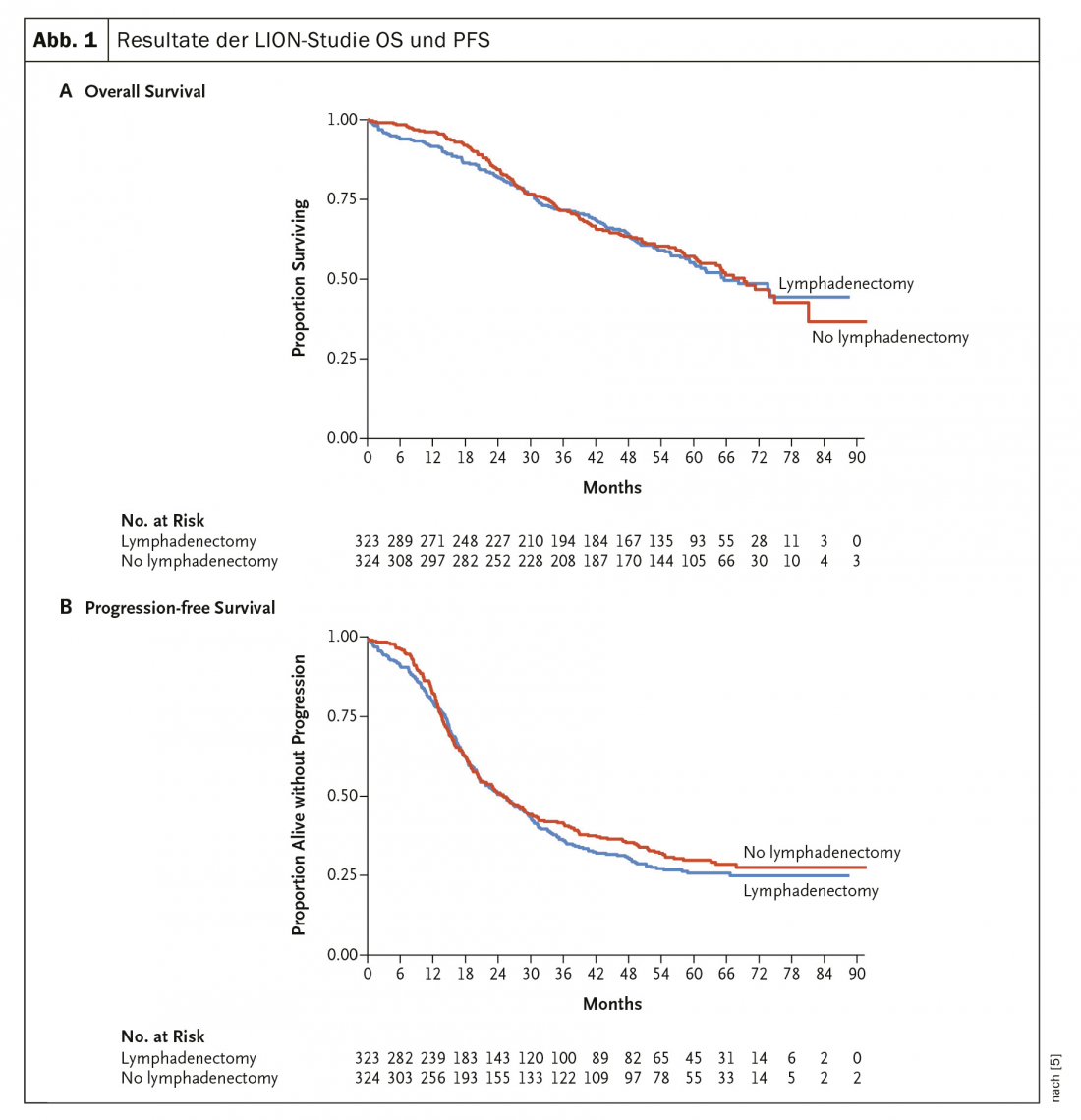
En 2019 se publicaron los resultados (largamente esperados) del ensayo LION [5], que investigó el valor de la linfadenectomía rutinaria en el cáncer de ovario avanzado (Fig. 1) . Ni la SLP ni la SG mostraron diferencias en este estudio aleatorizado. Por lo tanto, ya no se recomienda la linfadenectomía sistemática paraaórtica y pélvica en el caso de los ganglios linfáticos poco visibles en el preoperatorio ni la intraoperatoria en el caso de la resección completa. En estadios avanzados, la quimioterapia aditiva con carboplatino y taxol es estándar.
¿Debe realizarse primero la cirugía, seguida de quimioterapia, o existen pruebas de que los pacientes se benefician de una terapia sistémica primaria seguida de cirugía? Un estudio de la EORTC y el estudio CHORUS [6,7] mostraron resultados comparables para ambas opciones en términos de SLP y SG en pacientes con enfermedad en estadio IIIC o IV.
En consecuencia, la recomendación de la ESMO/ESGO es ahora que debe elegirse un abordaje quirúrgico primario (UDS, upfront debulking surgery) si puede conseguirse la eliminación macroscópica del tumor (basándose en la estadificación preoperatoria) y se asume una morbilidad aceptable [1]. Si no es así, debe administrarse una terapia sistémica primaria.
Sin embargo, a menudo se critica la falta de experiencia de los cirujanos en estos estudios, por lo que actualmente se está llevando a cabo un estudio multicéntrico internacional (Trial on Radical Upfront Surgical Therapy TRUST) en el que los cirujanos participantes deben cualificarse según unos criterios seleccionados. Los resultados se esperan en torno a 2024.
¿Qué opciones tenemos para mejorar el pronóstico con las terapias sistémicas disponibles? El estudio japonés JGOG3016 demostró que un tratamiento denominado de dosis densa con paclitaxel semanal 80 mg/m2 en combinación con carboplatino lograba una clara mejora de la mediana de la supervivencia libre de progresión y de la supervivencia global en comparación con el tratamiento estándar [8]. Sin embargo, este régimen terapéutico apenas es aplicable en Europa debido a su considerable toxicidad, por lo que las directrices ESMO/ESGO recientemente revisadas no lo recomiendan para los pacientes de los países occidentales [1].
Bevacizumab en el tratamiento de primera línea
El bevacizumab, un anticuerpo monoclonal anti-VEGF, está aprobado en combinación con quimioterapia en la denominada situación de alto riesgo, en el tipo más común de cáncer de ovario, el seroso de alto grado (CSGH). Las formaciones tumorales residuales postoperatorias ≥1 cm o el estadio IV de FIGO se consideran de alto riesgo. Se ha demostrado que el bevacizumab mejora la SLP en varios ensayos aleatorizados. Sólo se describió un beneficio para la supervivencia en el estudio ICON7 [9,10]. Se desconoce un biomarcador predictivo para la terapia con bevacizumab.
Terapia de mantenimiento en primera línea
El bevacizumab se utiliza en situaciones de alto riesgo primero en combinación con la quimioterapia aditiva y después como mantenimiento a una dosis de 15 mg/kg o 7,5 mg/kg cada 3 semanas durante un máximo. 15 meses recomendado [1,9,10].
Inhibidores de la poli(ADP-ribosa) polimerasa (PARP): Aproximadamente el 50% de los carcinomas ováricos epiteliales (COE) presentan mecanismos deficientes de reparación del ADN a través de recombinación homóloga. Esta circunstancia explica también la gran eficacia del consejo en el COE. Los inhibidores de PARP provocan la llamada letalidad sintética en las células deficientes en RH. Sin embargo, también muestran eficacia en pacientes sin defectos demostrados en los genes RH. Se han probado varios inhibidores de PARP (olaparib, niraparib, rucaparib y otros).
Los resultados del ensayo SOLO1, que mostraron una mejora del 70% en la SLP en comparación con el placebo en pacientes con mutación BRCA que recibían terapia de mantenimiento de primera línea con olaparib, atrajeron una atención considerable [11,12]. En la actualidad se recomienda encarecidamente el asesoramiento y las pruebas genéticas (inmediatas) con respecto al mantenimiento del olaparib en esta situación [1].
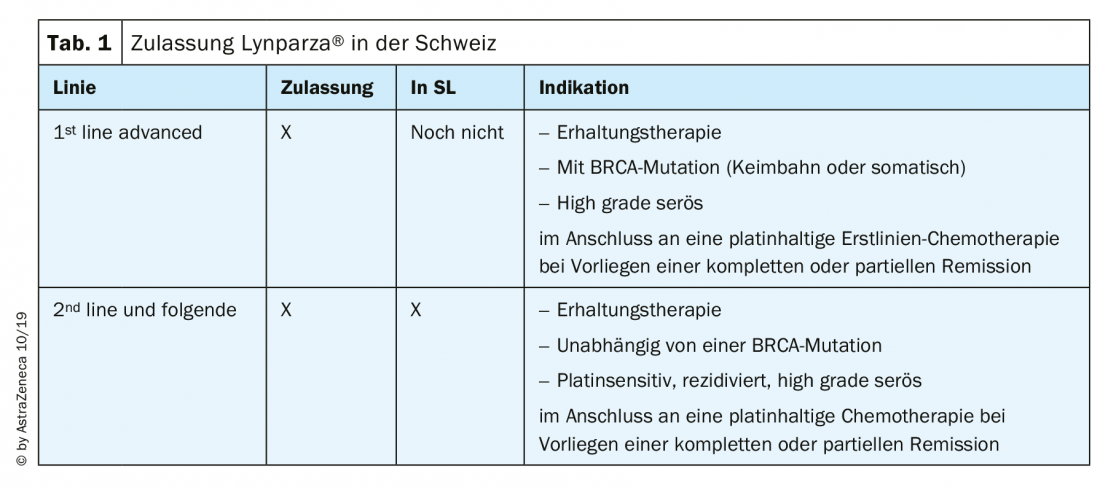
Las dos sustancias más utilizadas en Suiza, olaparib (Lynparza®) y niraparib (Zejula®), están aprobadas y disponibles en Suiza para el cáncer de ovario de la siguiente manera (Tab. 1): El niraparib ha sido aprobado para la terapia de mantenimiento en el cáncer de ovario sensible al platino en recaída desde agosto de 2019, independientemente del estado de la mutación BRCA [13]. En ESMO 2019 se presentaron numerosos datos sobre los inhibidores de PARP, que ahora se debaten intensamente.
Procedimiento práctico para el tratamiento de primera línea
En nuestra clínica, ahora ofrecemos a todas las pacientes con cáncer de ovario no mucinoso que reciban asesoramiento genético y se sometan a pruebas de detección de mutaciones BRCA1/2 (en su mayoría de línea germinal, rara vez somáticas). Esto suele ocurrir durante la quimioterapia aditiva. En el caso de una mutación BRCA1,2, se utiliza olaparib como mantenimiento; en el caso de BRCA de tipo salvaje, se utiliza terapia de mantenimiento con bevacizumab si ya se utilizó bevacizumab durante la quimioterapia.
En caso de recaída sensible al platino, puede añadirse una terapia de mantenimiento con niraparib, independientemente del estado de la mutación BRCA1,2. En una posible recidiva posterior, utilizamos entonces el bevacizumab, en combinación con platinos si sigue siendo sensible.
Las pruebas genéticas se recomiendan claramente en las directrices de la ESMO/ESGO, por un lado porque son predictivas de una respuesta y, por otro, porque permiten asesorar y realizar pruebas a los familiares sanos en una fase temprana [1].
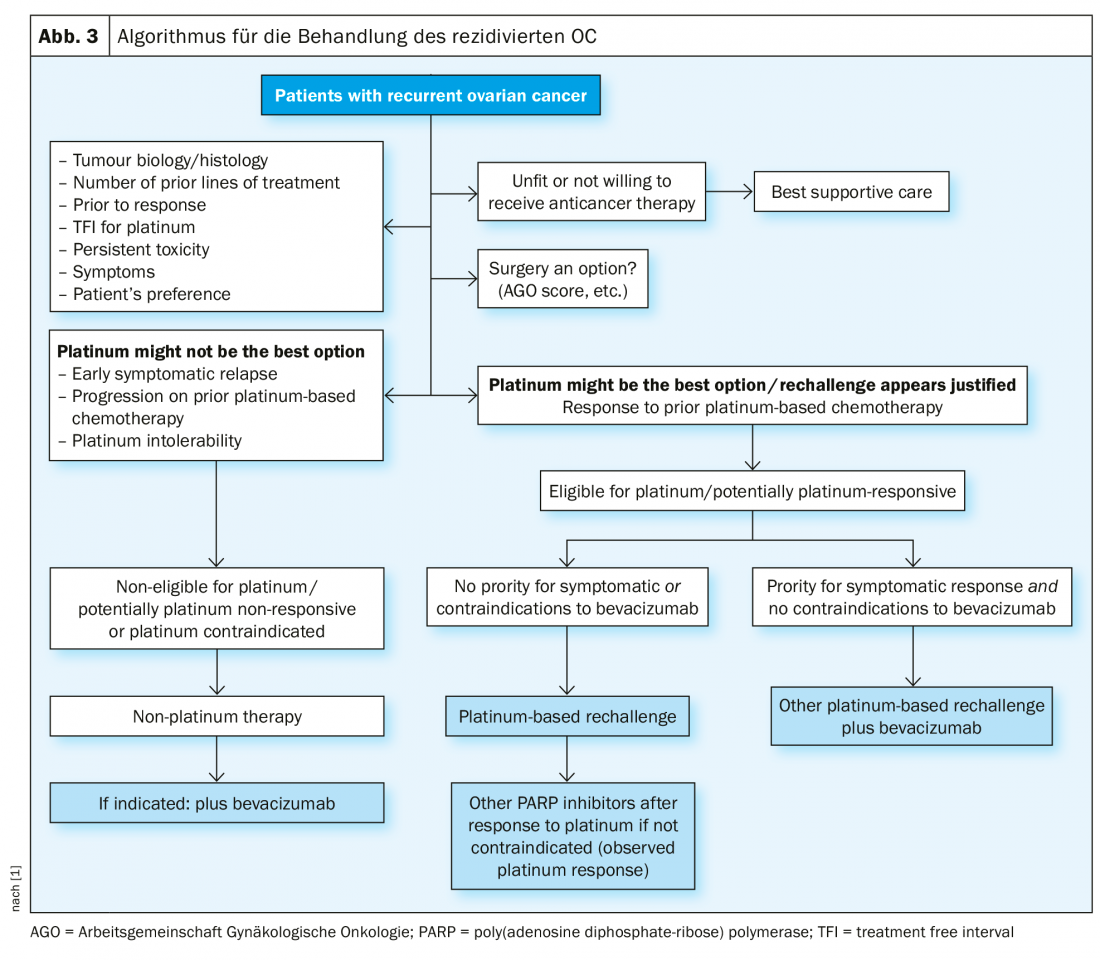
Tratamiento recurrente
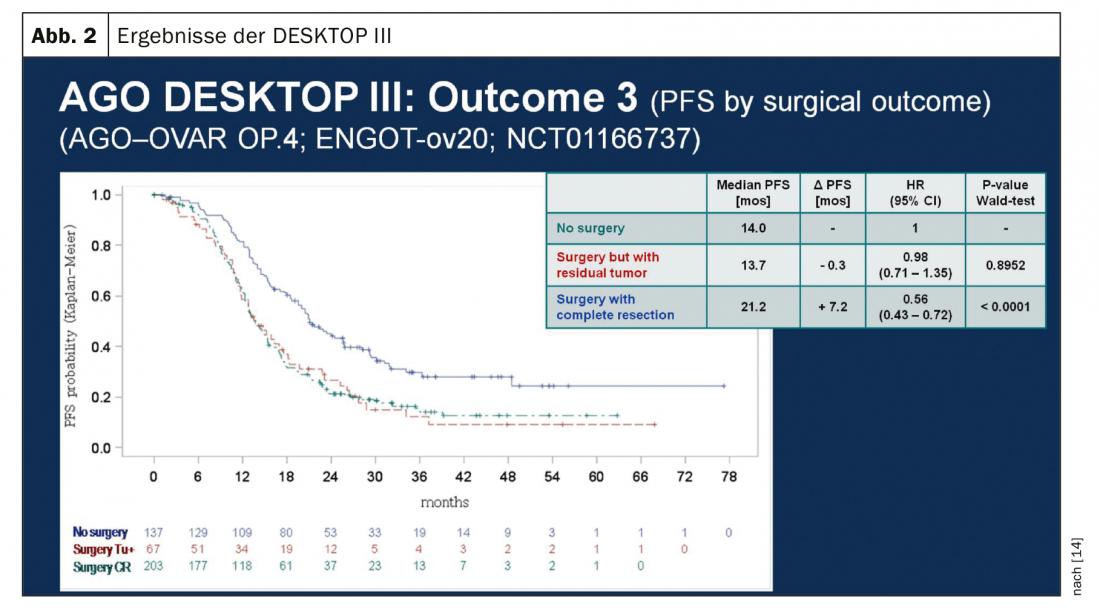
En caso de recidiva sensible al platino, otra operación de citorreducción es una opción terapéutica si de este modo puede conseguirse la liberación macroscópica del tumor. Los resultados del estudio DESKTOP III del Grupo de Trabajo de Oncología Ginecológica (AGO) demostraron una mejora de la SLP con cirugía exclusivamente cuando podía lograrse la extirpación quirúrgica completa [14]. Los datos de SG aún no se han publicado (Fig. 2). En el caso de la sensibilidad al platino, se han probado numerosas terapias combinadas (Tab. 2).
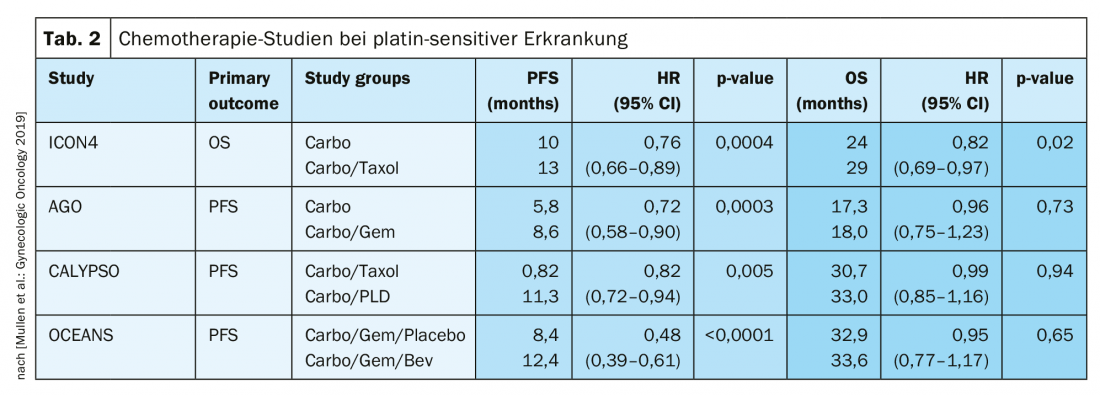
La sensibilidad del platino se redefine
En el pasado, un intervalo de 6 meses tras la última terapia con platino se consideraba un fuerte indicio de una nueva sensibilidad al platino. Sin embargo, esto no refleja que este tiempo deba considerarse más bien como un continuo. Para ello se eligió el término elegibilidad platino. La definición de resistencia al platino es nueva:
-
Resistencia al platino confirmada: progresión bajo quimioterapia con platino
- Sospecha de resistencia al platino: Recurrencia sintomática precoz con baja probabilidad de respuesta ulterior al platino [1].
En esta situación terapéuticamente difícil, son adecuados los regímenes terapéuticos sin platino, si es necesario en combinación con bevacizumab [15]. Por cierto, en ASCO 2018 se presentó que la readministración de bevacizumab mejora la SLP, incluso si se ha utilizado previamente [16].
Inhibidores PARP
En el contexto de la recaída, la respuesta al platino es el mejor marcador predictivo de la eficacia de los inhibidores de PARP como terapia de mantenimiento. La terapia de mantenimiento con olaparib tras la quimioterapia con platino mostró una mejora de la SLP en pacientes con mutaciones BRCA1/2 en el denominado Estudio 19 [17] y en el estudio SOLO2 [18]. Siguieron otros inhibidores de PARP, por ejemplo, niraparib (ensayo NOVA [19], rucaparib (ARIEL3 [20]).
El ensayo NOVA demostró claramente que la SLP mejoró con niraparib en comparación con placebo tanto en pacientes con mutaciones BRCA como en las de tipo salvaje, aunque el beneficio fue mayor en las pacientes con mutaciones BRCA. Los estudios para terapias de mantenimiento con olaparib y niraparib también mostraron que el tiempo hasta la siguiente quimioterapia puede prolongarse significativamente. Se trata de un criterio de valoración absolutamente significativo desde el punto de vista clínico. La tolerabilidad de los inhibidores de PARP suele ser buena, en ocasiones es necesario reducir la dosis (Fig. 3).
Resumen
La terapia estándar de primera línea para el cáncer de ovario epitelial (principalmente seroso de alto grado) es la cirugía y la quimioterapia basada en platino. Debe ofrecerse a las pacientes asesoramiento genético precoz y pruebas (somáticas o de la línea germinal), sobre todo teniendo en cuenta que la terapia de mantenimiento con olaparib mejora significativamente la supervivencia libre de progresión en pacientes con mutaciones BRCA1,2. El bevacizumab se continúa como mantenimiento si ya se ha utilizado en combinación con la quimioterapia aditiva.
En la recaída sensible al platino (nueva definición, denominada platino-elegible), puede considerarse en determinadas condiciones una nueva intervención quirúrgica, seguida de quimioterapia que contenga platino, posiblemente además bevacizumab (que luego puede continuarse como mantenimiento). Tras la respuesta al platino en la situación de recaída, el inhibidor de PARP niraparib está aprobado en Suiza para pacientes con mutación BRCA y de tipo salvaje. Cuando el platino ya no está indicado, también existen regímenes terapéuticos sin platino. La inmunoterapia para el cáncer de ovario se encuentra actualmente en rápido desarrollo; todavía no se ha aprobado ninguna sustancia como terapia estándar [21].
Mensajes para llevarse a casa
- El cáncer de ovario es el tumor ginecológico con mayor mortalidad en el mundo occidental.
- Las secuencias complejas con cirugía y terapias sistémicas mejoran el pronóstico y la calidad de vida.
- Existen terapias de mantenimiento con bevacizumab e inhibidores de PARP.
- Las directrices ESMO/ESGO recientemente publicadas proporcionan información sobre las recomendaciones terapéuticas actuales.
- Se esperan más indicaciones para los inhibidores de PARP en el futuro(1ª línea, BRCA-no mutado).
- La inmunoterapia se está investigando en numerosos ensayos de fase III en todo el mundo, pero aún no es un tratamiento estándar para el cáncer de ovario.
Literatura:
- Recomendaciones de la conferencia de consenso ESMO-ESGO sobre el cáncer de ovario: patología y biología molecular, estadios tempranos y avanzados, tumores limítrofes y enfermedad recurrente N. Colombo, C. Sessa, et al. Anales de Oncología 30: 672-705, 2019.
- THE-WORLD-OVARIAN-CANCER-COALITION-ATLAS-2018.pdf, en www.worldovariancancercoalition.org
- Screening for Ovarian Cancer, US Preventive Services Task Force JAMA. 2018
- du Bois A, et al: Papel del resultado quirúrgico como factor pronóstico en el cáncer de ovario epitelial avanzado Cáncer 2009.
- Harter P, et al: Un ensayo aleatorizado de linfadenectomía en pacientes con neoplasias ováricas avanzadas LEÓN NEJM 380; 9 28 de febrero de 2019.
- Vergote I, Tropé CG, Amant F, et al: Quimioterapia neoadyuvante o cirugía primaria en el cáncer de ovario en estadio IIIC o IV. N Engl J Med 2010.
- Kehoe S, Hook J, Nankivell M, et al: Quimioterapia primaria frente a cirugía primaria para el cáncer de ovario avanzado de diagnóstico reciente (CHORUS): un ensayo abierto, aleatorizado, controlado y de no inferioridad. Lancet 2015.
- Katsumata N, et al: Resultados a largo plazo del paclitaxel y carboplatino en dosis densas frente al paclitaxel y carboplatino convencionales para el tratamiento del cáncer epitelial avanzado de ovario, de trompa de Falopio o primario de peritoneo (JGOG 3016): ensayo aleatorizado, controlado y abierto. Lancet Oncol 2013.
- Burger RA, et al: Incorporación de bevacizumab en el tratamiento primario del cáncer de ovario. N Engl J Med 2011
- Perren TJ, et al: Un ensayo de fase 3 de bevacizumab en el cáncer de ovario. N Engl J Med 2011.
- Murai SY, Huang B, Das A, et al: Trapping of PARP1 and PARP2 by clinical PARP inhibitors, Cancer Res. 2012.
- Moore K, et al: Olaparib de mantenimiento en pacientes con cáncer de ovario avanzado recién diagnosticado. NEJM Oct 2018.
- www.spezialitaetenliste.ch
- Du Bois A, et al: Estudio de fase III controlado y aleatorizado que evalúa el impacto de la cirugía citorreductora secundaria en el cáncer de ovario recidivante: AGO DESKTOP III/ENGOT ov20. J Clin Oncol 2017; 35(15_Suppl): 5501
- Pujade E, et al: Bevacizumab combinado con quimioterapia para el cáncer de ovario recurrente resistente al platino: el ensayo de fase III aleatorizado y abierto AURELIA, JCO mayo 2014.
- Pignata S, et al: Quimioterapia más o menos bevacizumab para pacientes con cáncer de ovario sensibles al platino que recidivan tras un tratamiento de primera línea con bevacizumab: el ensayo aleatorizado de fase 3 MITO16B-MaNGO OV2B-ENGOT OV17. J Clin Oncol 2018;36(15_Suppl).
- Ledermann JA, et al: Terapia de mantenimiento con olaparib en pacientes con cáncer de ovario seroso recidivante sensible al platino: un análisis retrospectivo preplanificado de los resultados según el estado BRCA en un ensayo aleatorizado de fase 2. Lancet Oncol 2014.
- Pujade-Lauraine E, et al: Olaparib comprimidos como terapia de mantenimiento en pacientes con cáncer de ovario sensible al platino, en recaída y con una mutación BRCA1/2 (SOLO2/ENGOT-Ov21): un ensayo doble ciego, aleatorizado, controlado con placebo, de fase 3. Lancet Oncol 2017
- Mirza MR, et al: Terapia de mantenimiento con niraparib en el cáncer de ovario recurrente sensible al platino. N Engl J Med 2016.
- Coleman RL, et al: Rucaparib maintenance treatment for recurrent ovarian carcinoma after response to platinum therapy (ARIEL3): a randomised, double-blind, placebo-controlled,phase 3 trial, Lancet 2017.
- Marth C, et al: Inmunoterapia en el cáncer de ovario: ¿noticia falsa o verdad? Int J Gynecol Cancer 2019.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2019; 7(6): 6-10.