Las enfermedades mentales tienen un impacto en la madre y el feto, así como en el desarrollo posterior del niño. A la inversa, el embarazo también puede influir en la enfermedad. Estas interacciones plantean a los médicos tratantes un reto especial que debe abordarse de forma interdisciplinar.
La depresión durante el embarazo no es infrecuente. Las causas son múltiples y están determinadas de antemano por el cambio hormonal, los cambios inminentes en las circunstancias vitales y la constelación psicológica, así como por la disposición genética. Se calcula que la prevalencia es de hasta el 10% de todos los embarazos. Hace unos años, una gran estadística de muertes maternas en Inglaterra mostraba un aumento de las muertes maternas relacionadas con el suicidio en el embarazo; de 2000 a 2002, el suicidio fue incluso la causa más frecuente de mortalidad materna, y por tanto más frecuente que los acontecimientos cardiacos, el tromboembolismo o la hemorragia periparto [1].
Matriz de interacciones
Existen múltiples interacciones entre la enfermedad mental, el organismo materno y el feto o su entorno intrauterino, que se deben en parte a un efecto directo, en parte mediado indirectamente por la terapia farmacológica o por una sustancia activa en el contexto del abuso de sustancias. Estas interacciones estructuradas en forma de matriz no suelen ser claramente separables en la práctica clínica diaria. No obstante, es esencial tener en cuenta los factores individuales que influyen tanto en la mujer embarazada como en el niño en la atención prenatal para lograr el mejor resultado posible para la madre y el niño (Fig. 1 ). Las enfermedades mentales (por ejemplo, depresión, esquizofrenia, adicción) pueden afectar al embarazo de diferentes maneras.
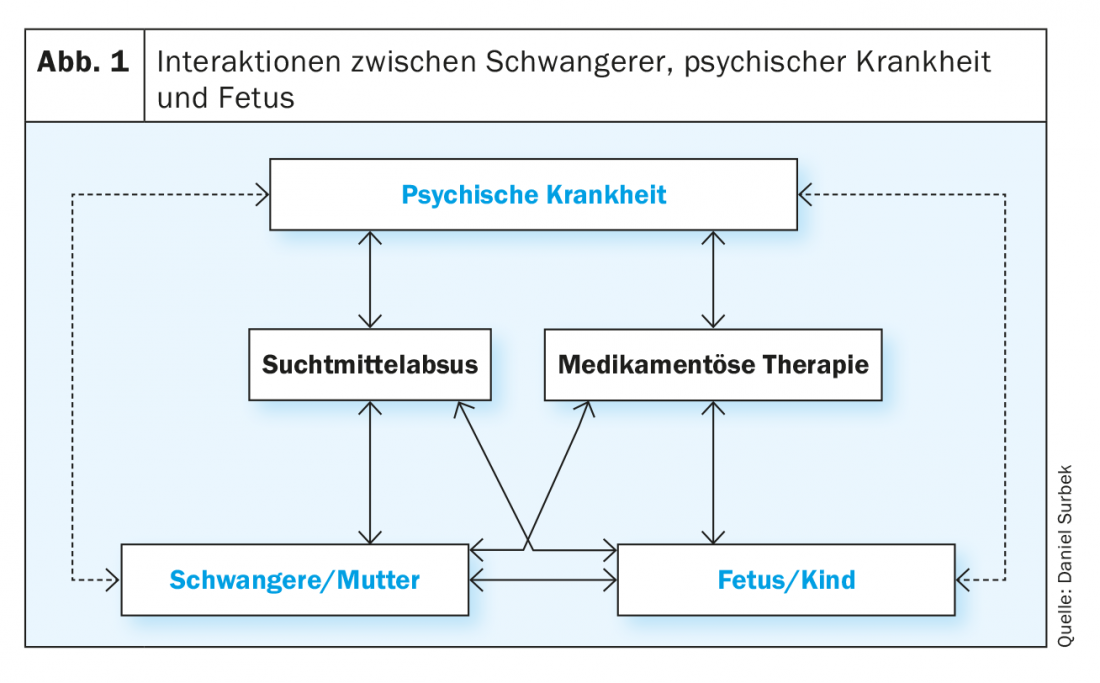
Deterioro directo debido a la enfermedad: Puede deberse a alteraciones del sueño, factores de estrés psicológico y/o social, trastornos alimentarios, anorexia o falta de aumento de peso, o incumplimiento de los cuidados prenatales. Las posibles consecuencias son:
- restricción del crecimiento intrauterino
- Prematuridad
- pérdida fetal intrauterina
- Complicaciones del parto
La relación entre el estrés psicológico y las complicaciones del embarazo está ya muy estudiada. El principal mediador es la hormona liberadora de corticotropina (CRH), que en este contexto también se denomina “coordinadora de la respuesta al estrés” [2]. La CRH desempeña un papel importante no sólo como mediadora del parto prematuro y posiblemente del nacimiento prematuro, sino también en la reducción de la perfusión placentaria, lo que puede conducir a una insuficiencia placentaria con retraso del crecimiento intrauterino. El retraso del crecimiento no suele producirse hasta el tercer trimestre y a veces es difícil de reconocer. Hay que tener en cuenta que las enfermedades mentales pueden conducir al suicidio en casos de depresión grave.
Deterioro indirecto a través de la medicación: Las enfermedades mentales también afectan al embarazo a través de un mecanismo indirecto, mediado por la terapia farmacológica (véase más adelante). Por lo tanto, es importante darse cuenta de que las enfermedades mentales durante el embarazo tienen una prevalencia considerable. Estudios recientes muestran que la depresión aparece hasta en un 10% durante el embarazo y la prevalencia tiende a aumentar [3,4]. Los episodios depresivos, que no cumplen los criterios de una depresión propiamente dicha, pero que sin embargo tienen un efecto incapacitante, llegan a producirse en hasta el 70% de las mujeres embarazadas.
Influencia de la enfermedad de una sustancia adictiva: Aquí hay que distinguir entre las diferentes clases de sustancias, cada una con sus efectos muy específicos sobre la mujer embarazada o el feto. A continuación se analizan las clases de sustancias y sus posibles efectos.
Recomendaciones para el abuso de sustancias
Abuso de nicotina: Aún muy extendido, el abuso de nicotina suele provocar dos importantes patologías en el embarazo: Prematuridad y retraso del crecimiento intrauterino. Curiosamente, las mujeres que abusan de la nicotina tienen una incidencia ligeramente inferior de preeclampsia. Los mecanismos fisiopatológicos que conducen al parto prematuro y al retraso del crecimiento intrauterino están relacionados principalmente con las sustancias vasoactivas del humo del cigarrillo y con los efectos del monóxido de carbono en el suministro transplacentario del feto. No en vano, debido a la elevada prevalencia del consumo de nicotina, los programas de deshabituación tabáquica dirigidos a las mujeres que planean un embarazo o que se encuentran en las primeras etapas del mismo se encuentran entre los métodos más eficaces para reducir la elevada tasa de nacimientos prematuros de la población, que sigue aumentando. La intervención médica adecuada para los fumadores es, por tanto, una de las medidas preconceptuales más importantes. En principio, la “tolerancia cero” debería aplicarse al embarazo con respecto al abuso de nicotina [5].
Abuso etílico: El abuso de alcohol en cantidades significativas tiene efectos graves sobre el feto. A diferencia del abuso de nicotina, que tiene consecuencias para el embarazo principalmente a través de la hipofunción placentaria, el alcohol tiene un efecto tóxico directo sobre el feto. Las consecuencias se circunscriben al síndrome alcohólico embriofetal. Además de los estigmas típicos en el recién nacido (dismorfia facial con surco nasolabial alto y plano, etc.), incluye microcefalia, malformaciones cardiacas y un grave trastorno del desarrollo psicomotor y psicosocial, que a menudo se prolonga hasta la adolescencia. Dado que el alcohol etílico atraviesa fácilmente la barrera placentaria en cualquier momento del embarazo y, como sustancia lipofílica, tiene un efecto tóxico directo sobre el cerebro fetal en desarrollo, existe una dependencia directa de la dosis de alcohol en los tres trimestres con respecto a los trastornos del desarrollo a largo plazo. Por lo tanto, en cualquier caso, hay que intentar reducir la cantidad de alcohol que consumen las alcohólicas durante el embarazo, siempre que sea posible, si es necesario con psicofármacos. Es controvertido si existe un valor umbral inferior para la cantidad de alcohol que puede provocar toxicidad fetal. Está relativamente bien demostrado que el consumo de pequeñas cantidades de alcohol (un vaso de vino a la semana) no tiene efectos desfavorables sobre el feto. No obstante, debe desaconsejarse totalmente el consumo de alcohol durante el embarazo [5].
Consumo de opiáceos: El consumo de opiáceos por parte de los adictos puede producirse en forma de abuso parenteral (morfina, heroína) o como sustitución enteral (metadona, buprenorfina). Todas las formas de abuso de opiáceos durante el embarazo tienen en común que el feto se acostumbra a la sustancia de forma transplacentaria, lo que se manifiesta después del parto como síndrome neonatal de abstinencia de opiáceos. Esto incluye temblores, llantos estridentes, fases de sueño sólo breves e incluso calambres del recién nacido. La terapia del recién nacido suele incluir una administración parenteral inicial de opiáceos, que posteriormente debe reducirse a lo largo de varias semanas en forma de una lenta abstinencia. El uso de opiáceos por vía parenteral debe evitarse en el embarazo siempre que sea posible. La sustitución oral con metadona tiene muchas ventajas, aunque también (no linealmente dependiente de la dosis) conduce a un síndrome de abstinencia neonatal. Actualmente se está investigando si la sustitución con buprenorfina en lugar de metadona aporta alguna ventaja con respecto al síndrome de abstinencia neonatal. En cualquier caso, el principio terapéutico no debe ser reducir la sustitución oral a cero en el transcurso del embarazo, ya que la experiencia ha demostrado que aumenta mucho el riesgo de abuso incontrolado de opiáceos por vía parenteral (u otras sustancias, algunas de las cuales son incluso más peligrosas para el embarazo).
Cocaína, anfetaminas: En esta clase de sustancias, que tienen un efecto vasoactivo dependiente de la dosis, las principales complicaciones del embarazo son el retraso del crecimiento intrauterino, la preeclampsia y el parto prematuro. Existe una elevada incidencia de malformaciones fetales (por ejemplo, gastrosquisis). El desprendimiento prematuro de la placenta es una complicación aguda típica y grave, que a menudo conduce a la muerte amniótica intrauterina o a complicaciones maternas graves (shock hemorrágico, trastorno grave de la coagulación). Por esta razón, estas sustancias se encuentran a veces entre las más peligrosas durante el embarazo, por lo que su uso durante la gestación debe evitarse a toda costa.
Tetrahidrocannabinol: El consumo de cannabis durante el embarazo está muy extendido. Sus posibles consecuencias son el retraso del crecimiento intrauterino y la prematuridad. El tetrahidrocannabinol también atraviesa la barrera placentaria completamente sin obstáculos, de forma similar al alcohol etílico. Los receptores cannabinoides cerebrales ya están presentes en las etapas embrionarias más tempranas. Este sistema endocannabinoide desempeña un papel esencial en la proliferación, diferenciación y migración celular. Por lo tanto, la exposición intrauterina a los cannabinoides externos puede tener un impacto negativo en el desarrollo neuropsicológico. Además, el metabolismo de los opioides endógenos se ve influido por el abuso de cannabinoides durante el embarazo, lo que se ha demostrado en modelos animales. Si se produce un trastorno del desarrollo mental del niño a largo plazo y a partir de qué dosis, se discute de forma diferente. Algunos estudios muestran un efecto en términos de aumento de la impulsividad en la infancia. También se han descrito síntomas de abstinencia neonatal.
Infecciones en consumidores de drogas: Los estudios clínicos confirman que los consumidores de drogas sufren a menudo infecciones que pueden tener consecuencias para el embarazo y el feto. Estas infecciones suelen incluir la hepatitis B y C, el VIH, la sífilis, la infección genital por clamidia, el herpes genital, la vaginosis bacteriana y la infección genital por VPH. Las posibles consecuencias de estas infecciones varían en función del patógeno. Por un lado, pueden provocar un mayor riesgo de parto prematuro (por ejemplo, clamidia, vaginosis bacteriana); por otro, puede producirse una transmisión vertical intrauterina o subparto al feto con las correspondientes consecuencias para el niño (por ejemplo, infección por VIH, hepatitis C). Por ello, cuando se atiende a mujeres embarazadas con adicción, deben buscarse activamente las distintas infecciones y, si es necesario, adoptar medidas terapéuticas o profilácticas contra la transmisión vertical.
Efectos de las enfermedades mentales y la medicación en el feto
Debido a la frecuente aparición de depresión en el embarazo, el uso de psicofármacos está en primer plano. Las estadísticas de EE.UU. muestran que el uso de antidepresivos en el embarazo (especialmente los ISRS) ha aumentado del 2% a cerca del 8% en los últimos diez años [4]. Es posible que este uso generalizado de psicofármacos no refleje un aumento general de la depresión en el embarazo, sino más bien la constatación de que los beneficios de los psicofármacos en el embarazo son en muchos casos mayores que sus riesgos. Actualmente está bien establecido que la interrupción de los antidepresivos durante el embarazo o incluso antes de la concepción conduce a una alta tasa de recurrencia de hasta el 75% [6,7]. Además, los estudios han demostrado que la depresión per se conduce a un peor resultado del embarazo, ya que provoca un frecuente retraso del crecimiento intrauterino y un aumento de la prematuridad. A esto se añade el mayor riesgo de suicidio. Por lo tanto, en el período previo a un embarazo o al comienzo del mismo, no debe forzarse principalmente la interrupción de la medicación antidepresiva, sino que debe estudiarse la posibilidad de cambiar a un antidepresivo que sea lo más compatible posible con el embarazo. En este contexto, hay una serie de aspectos que deben tenerse en cuenta en relación con los efectos farmacoterapéuticos sobre el feto, que se analizarán a continuación.
La teratogenicidad se caracteriza por la inducción exógena de malformaciones en los órganos, y la exposición se produce principalmente durante la etapa embrionaria (fase delicada del desarrollo de los órganos). La etapa embrionaria se define hasta el final de la octava SSW postconcepción (es decir, hasta la décima SSW después del último periodo). En las dos primeras semanas tras la concepción, el embrión se encuentra en la fase de blastocisto. Aquí se suele asumir el “principio de todo o nada”: Las posibles influencias tóxicas no provocan malformaciones orgánicas, sino una alteración de la implantación del blastocisto en el endometrio y, posteriormente, un aborto espontáneo.
Así pues, la fase importante de teratogenicidad se extiende de la segunda a la octava semana tras la concepción. En la siguiente etapa fetal, la mayoría de los órganos han completado los pasos más importantes de la diferenciación. Se trata principalmente de un crecimiento y, como mucho, de una maduración funcional. Sin embargo, hay órganos que siguen diferenciándose durante la etapa fetal. Entre ellos se encuentran el cerebro fetal y el tracto urogenital fetal.

Los recuadros de la página 8 explican dos ejemplos relativos a la interacción entre el consumo de drogas y el desarrollo embrionario. Muestran la complejidad de esta relación y que son necesarias la evaluación individual del riesgo y el ajuste de la psicofarmacoterapia. En última instancia, es importante sopesar los posibles efectos secundarios indeseables frente a los efectos beneficiosos (que a menudo superan a los efectos adversos de la psicofarmacoterapia durante el embarazo).

Efectos a largo plazo de la enfermedad mental en el niño
Basándose en la hipótesis de Barker, ahora se ha demostrado que las influencias prenatales sobre el feto (entorno intrauterino) dan lugar a la programación de sistemas orgánicos individuales o procesos metabólicos, que tienen efectos de por vida en el niño (“programación fetal”). El ejemplo más importante es la asociación entre el bajo peso al nacer en el retraso del crecimiento intrauterino y el riesgo posterior de enfermedades cardiovasculares. Hoy en día, también existen pruebas de que la exposición prenatal puede tener consecuencias para la salud mental. Por ejemplo, un estudio mostró un mayor riesgo de suicidio en la adolescencia y la edad adulta en personas con bajo peso al nacer [8]. Otros estudios muestran un riesgo significativamente mayor de depresión en la edad adulta en los recién nacidos prematuros y con bajo peso al nacer [9,10]. Se cree que la clave del vínculo fisiopatológico entre la exposición intrauterina a ciertas condiciones y las enfermedades psiquiátricas posteriores está mediada a través del eje del estrés del cortisol. Esto ya es evidente con la exposición al estrés intrauterino a corto plazo, como hemos demostrado en nuestro estudio recientemente publicado sobre la relación entre diferentes factores estresantes relacionados con el modo de parto, los niveles de cortisol y la percepción del dolor posparto [11]. Los hijos de madres con una enfermedad psiquiátrica tienen un mayor riesgo de enfermar también más adelante. A diferencia de una predisposición genética, la exposición intrauterina es, en principio, accesible desde el punto de vista terapéutico.
Así pues, nuestros esfuerzos en la atención a las mujeres embarazadas con enfermedades mentales deben ir en la dirección no sólo de mejorar el resultado a corto plazo del embarazo, sino también de tener en cuenta las posibles consecuencias a largo plazo para el niño y sus posibilidades de prevención.
¿Cómo cuidar?
Al atender a la mujer embarazada con una enfermedad mental, deben tenerse en cuenta los posibles efectos recíprocos. Por tanto, incluye 1) La enfermedad mental de la mujer, 2) la unidad útero-placentaria y 3) el feto como segundo paciente. En particular, la atención a las mujeres embarazadas con adicción requiere un concepto de atención global que incluya cada vez más el entorno social de la paciente y los recursos existentes. La atención obstétrica o prenatal específica se centra en la prevención, la detección precoz y la terapia de los posibles efectos. Esto incluye los siguientes aspectos clave:
Pilar I: El asesoramiento preconcepcional debe ser llevado a cabo por el ginecólogo/obstetra conjuntamente o en consulta con el psiquiatra responsable. Lo ideal sería hacer un plan adecuado para el embarazo antes de interrumpir la anticoncepción. También debe intentarse planificar el embarazo en el momento más favorable con respecto a la enfermedad mental. Además, también deben tenerse en cuenta los aspectos terapéuticos (elección de la medicación) y preventivos (profilaxis multivitamínica/ácido fólico, reducción o interrupción del abuso de sustancias). Si ya se ha producido el embarazo, el asesoramiento debe iniciarse lo antes posible al comienzo del mismo.
Pilar II: El elemento más importante en el diagnóstico de los desarrollos intrauterinos patológicos es la ecografía prenatal especializada. Esto significa que, en ocasiones, las malformaciones fetales pueden detectarse precozmente (semana 12 de embarazo). La ecografía especializada reviste especial importancia porque muchas malformaciones (por ejemplo, las cardíacas) son difíciles de diagnosticar y un diagnóstico precoz puede mejorar significativamente el resultado posterior del niño. Debe existir un asesoramiento previo detallado y no directivo sobre las posibilidades del diagnóstico prenatal, incluido el “derecho a no saber”. Además, ciertas malformaciones graves pueden tratarse intrauterinamente, mientras que la terapia postnatal ya no es posible. En una constelación correspondiente con un grave deterioro psicológico de la paciente, puede que también haya que plantearse un aborto. Otros puntos centrales del diagnóstico son los exámenes ecográficos longitudinales de cerca de la longitud cervical, el crecimiento intrauterino y la hemodinámica fetal y uteroplacentaria (exámenes Doppler). Hoy en día, es posible predecir el retraso del crecimiento intrauterino o la preeclampsia en las primeras fases del embarazo mediante mediciones del flujo sanguíneo y pruebas bioquímicas adicionales. Los embarazos con enfermedades mentales deben considerarse embarazos de alto riesgo, por lo que urge una atención médica prenatal especializada.
Pilar III: Las intervenciones terapéuticas en caso de malformaciones fetales consisten en la prevención de la prematuridad con medidas medicinales (por ejemplo, terapia con progesterona) o quirúrgicas (por ejemplo, cerclaje) adecuadas. Especialmente en el caso de un mayor riesgo de prematuridad, la terapia fetal mediante la aplicación transplacentaria de glucocorticoides correctamente dosificados (“inducción de la maduración pulmonar”) suele ser fundamental, ya que puede reducir la morbilidad y la mortalidad fetales en un 50% en caso de parto prematuro. En el caso de una constelación de alto riesgo de retraso del crecimiento intrauterino y de preeclampsia, la medicación profiláctica (ácido acetilsalicílico 100 mg diarios, suplemento de calcio 1-2 mg diarios) es eficaz, siempre que se administre a tiempo. Si ya se ha producido un retraso grave del crecimiento intrauterino con los correspondientes cambios hemodinámicos, o en caso de preeclampsia grave, la medida terapéutica más importante es un tratamiento hospitalario adecuado con una vigilancia intensiva del feto y un parto a tiempo en caso de exacerbación. En cualquier caso, si la embarazada padece una enfermedad mental y se producen complicaciones durante el embarazo, es imprescindible que reciba atención interdisciplinar en un centro terciario para lograr el mejor resultado para la madre y el niño.
Mensajes para llevarse a casa
- Las enfermedades mentales tienen diversos efectos en el curso del embarazo, así como en el desarrollo del feto y del niño.
- A la inversa, el embarazo puede tener un efecto sobre una enfermedad mental a través de diferentes influencias, en parte hormonales, o favorecer su manifestación clínica inicial.
- La matriz de múltiples interacciones plantea un reto particular para la atención interdisciplinar de los pacientes, con los psiquiatras y los ginecólogos/obstetras a la cabeza.
- Los cuidados prenatales suelen ser complejos y exigentes, por lo que requieren la colaboración de un centro especializado para lograr el mejor resultado para la madre y el niño.
Literatura:
- Hobel CJ, Goldstein A, Barrett ES: Estrés psicosocial y resultado del embarazo. Clin Obstet Gynecol 2008; 51(2): 333-348.
- Drife J: Por qué mueren las madres. J R Coll Physicians Edinb 2005; 35: 332-336.
- Bennett HA, et al: Prevalencia de la depresión durante el embarazo: revisión sistemática. Obstet Gynecol 2004; 103(4): 698-709.
- Andrade SE, et al: Uso de medicamentos antidepresivos durante el embarazo: un estudio multisitio. Am J Obstet Gynecol 2008; 198(2): 194, e1-5.
- Bürki RE, et al.: Recomendaciones actuales sobre el asesoramiento previo a la concepción. Carta de experto nº 33, Sociedad Suiza de Ginecología y Obstetricia, 2010. www.sggg.ch/fileadmin/user_upload/33_Praekonzeptionsberatung_2010.pdf, último acceso 05.03.19.
- Cohen LS, et al: Recaída de la depresión durante el embarazo tras la interrupción del antidepresivo: un estudio prospectivo preliminar. Arch Womens Ment Health 2004; 7(4): 217-221.
- Cohen LS, et al: Recaída de la depresión mayor durante el embarazo en mujeres que mantienen o interrumpen el tratamiento antidepresivo. JAMA 2006; 295(5): 499-507. fe de erratas en: JAMA 2006; 296(2): 170.
- Barker DJ, et al: Bajo aumento de peso en la infancia y suicidio en la vida adulta. BMJ 1995; 311(7014): 1203.
- Patton GC, et al: Prematuridad al nacer y trastorno depresivo adolescente. Br J Psychiatry 2004; 184(5): 446-447.
- Thompson C, et al: El peso al nacer y el riesgo de trastorno depresivo en la edad adulta. Br J Psychiatry 2001; 179: 450-455.
- Schuller C, et al: Estrés y respuesta al dolor de los neonatos tras el parto espontáneo, asistido por vacío y por cesárea. Am J Obstet Gynecol 2012; 207(5): 416.e1-6.
- Koren G, Nordeng H: Uso de antidepresivos durante el embarazo: la relación beneficio-riesgo. Am J Obstet Gynecol 2012; 207(3): 157-163.
- Hviid A, Melbye M, Pasternak B: Uso de inhibidores selectivos de la recaptación de serotonina durante el embarazo y riesgo de autismo. N Engl J Med 2013; 369: 2406-2415.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(2): 6-12.