La terapia del linfoma primario del SNC se ha desarrollado mucho en los últimos años. La esperanza de vida de los pacientes ha aumentado. El metotrexato sigue siendo la base de todas las terapias de inducción. En la consolidación, la situación es algo menos clara.
Los linfomas primarios del sistema nervioso central (LPSNC) son variantes extranodales de los linfomas no hodgkinianos que surgen de forma limitada en el cerebro, la médula espinal, las leptomeninges o los ojos y en los que no existe afectación sistémica. Los PZNSL son muy agresivos. Generalmente responden a la quimioterapia y la radioterapia, con una buena probabilidad de remisión. Sin embargo, el riesgo de recidiva es alto y el pronóstico es malo en este caso. La PZNSL puede producirse en un contexto de inmunosupresión (VIH/SIDA, congénita, tras un trasplante de órganos) o en pacientes inmunocompetentes. Este resumen se ocupa de estos últimos pacientes.
Epidemiología y pronóstico
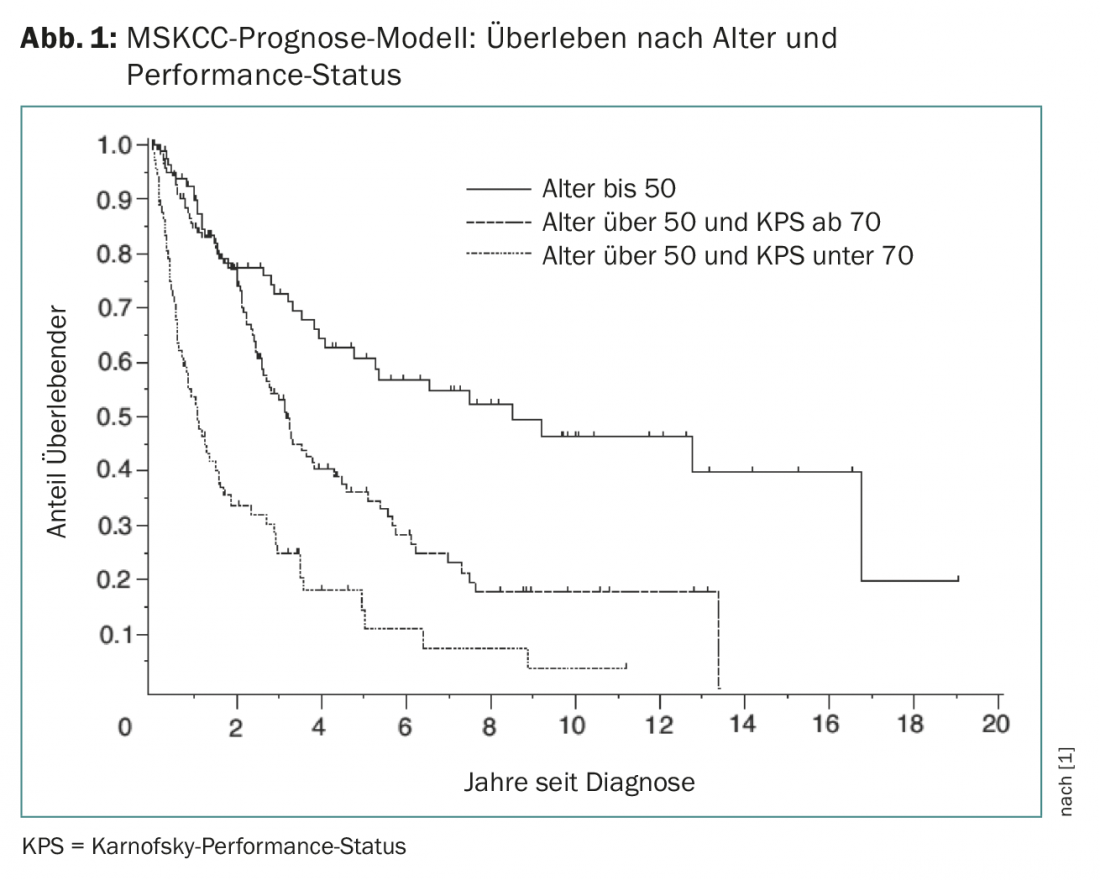
La PZNSL es una enfermedad rara con una incidencia de 0,4-0,5:100.000 al año. Representa aproximadamente el 4% de todos los tumores cerebrales diagnosticados y el 4-6% de todos los linfomas extraganglionares y puede darse en todos los grupos de edad. La edad media en el momento del diagnóstico es de 65 años. El modelo MSKCC (Memorial Sloan Kettering Cancer Center) puede predecir el pronóstico en función del estado funcional de Karnofsky y la edad (Fig. 1) [1].
Clínica
La clínica puede variar mucho en función del paciente y de la localización de la infestación en el cerebro. Se observan déficits neurológicos focales en hasta el 70% de los pacientes. Hasta un 43% de todos los pacientes presentan trastornos psiquiátricos o conductuales. También son frecuentes los signos de aumento de la presión intracraneal. Cuando se ven afectados los ojos (infiltración vítrea), los pacientes se quejan de visión borrosa o poco clara en un 20-25% de los casos.
Diagnóstico y estadificación
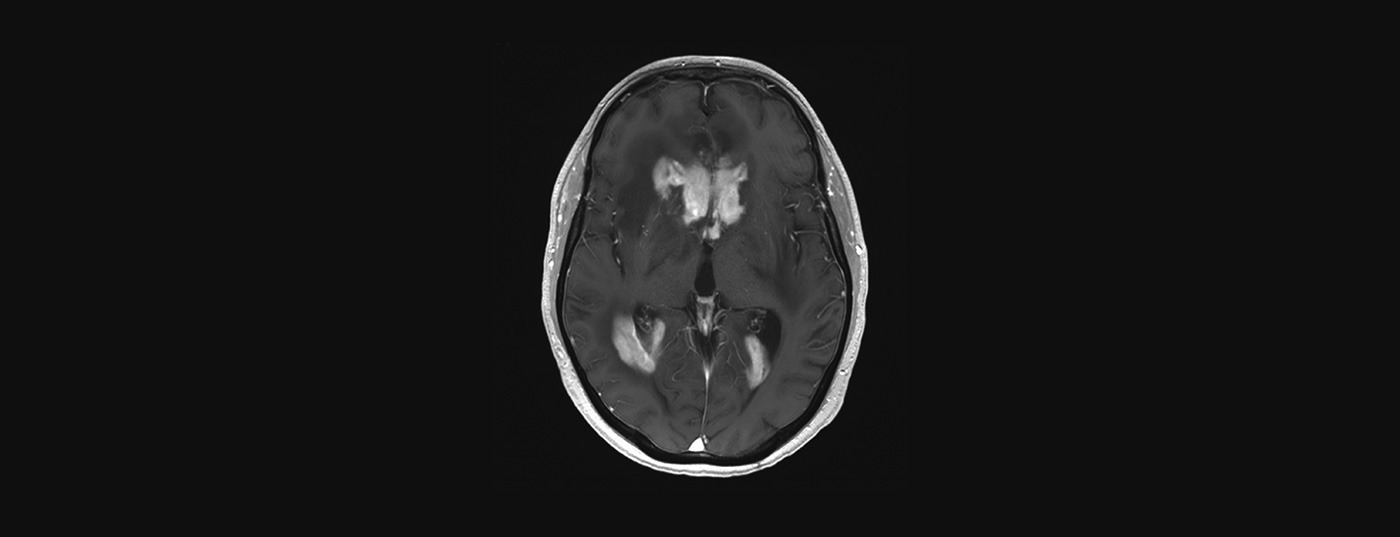
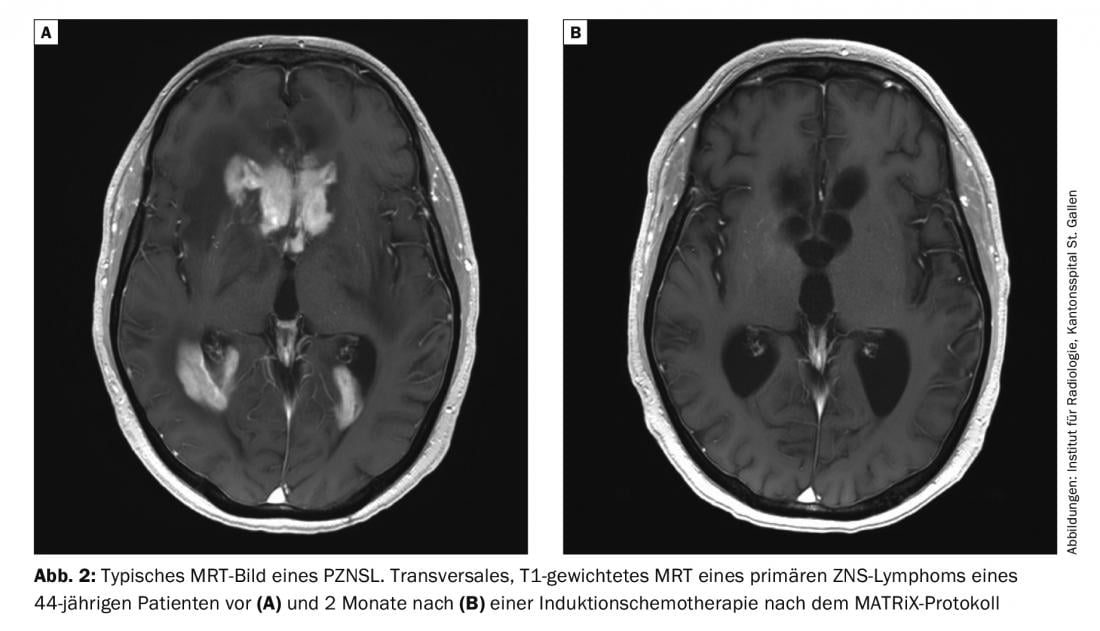
La RM con y sin medio de contraste es el examen de elección para la sospecha de PZNSL. Típicamente, se observan lesiones periventriculares solitarias o multifocales de localización central, que son hiperintensas en las imágenes ponderadas en T2 con captación homogénea de contraste y restricción de la difusión (Fig. 2). A pesar del cuadro clínico típico y de la resonancia magnética, el diagnóstico final debe confirmarse con una biopsia cerebral. Los esteroides son linfotóxicos y su administración antes de la biopsia puede conducir a un diagnóstico falso negativo. La afectación leptomeníngea puede producirse hasta en un 20% de los casos y debe realizarse una punción lumbar, a menos que esté contraindicada (presión intracraneal), para determinar el recuento celular, el contenido proteínico, la glucosa, la citología, la citometría de flujo y el “reordenamiento inmunoglobulínico” clonal. Un examen ocular con lámpara de hendidura también forma parte de la evaluación (también para pacientes sin alteraciones visuales). Si se confirma histológicamente el PZNSL, debe realizarse una estadificación con PET de cuerpo entero. Como mínimo, sin embargo, debe exigirse una tomografía computarizada de los pulmones, el cuello y el abdomen, así como una ecografía testicular, si no puede realizarse una PET. Además, debe realizarse una biopsia de médula ósea. Un hemograma que incluya recuento sanguíneo diferencial, LDH sérica y detección del VIH también forman parte de la estadificación.
PZNSL recién diagnosticado
El tratamiento moderno de un PZNSL depende de la edad, las enfermedades previas y el estado general. Generalmente, la terapia de inducción se inicia para lograr la remisión completa. A continuación se aplica una terapia de consolidación, destinada a eliminar la enfermedad microscópica residual y garantizar una remisión duradera. Debido a la falta de ensayos de fase III que comparen los distintos regímenes de tratamiento, se utilizan diferentes terapias de inducción y mantenimiento en todo el mundo. Sin embargo, lo que todas tienen en común es la proporción obligatoria de metotrexato (MTX). Otros agentes quimioterapéuticos, así como el papel y el momento de la radioterapia, son a veces objeto de discusiones muy controvertidas. El MTX en dosis >1,5 g/m2 y en un tiempo de infusión corto también atraviesa la barrera hematoencefálica intacta (dosis alta de MTX; HD-MTX). Como estas dosis son muy tóxicas para los demás órganos, debe administrarse también leucovorina. La leukovorina inactiva el MTX a nivel sistémico, pero no puede atravesar la barrera hematoencefálica y garantiza así una concentración elevada de MTX en el SNC. El MTX como monoterapia (8 g/m2) muestra tasas de respuesta global (ORR) del 74% [2]. El beneficio de la poliquimioterapia fue demostrado por Ferreri et al. en un ensayo aleatorizado, en el que la adición de citarabina al MTX dio lugar a una mayor supervivencia libre de progresión (SLP) de 18 frente a tres meses y una ORR del 69% frente al 40% en comparación con el brazo estándar [3].
Es habitual integrar el anticuerpo anti-CD20 rituximab en la poliquimioterapia con MTX, aunque es probable que esta molécula de anticuerpo de gran tamaño sólo pueda atravesar la barrera hematoencefálica alterada en las lesiones receptoras de contraste y ejercer allí su efecto depletor de células B. Un ensayo aleatorizado de 227 pacientes (IELSG32) demostró que la mejor ORR puede observarse cuando los pacientes son tratados con rituximab/tiotepa/HD-MTX/citarabina (régimen MATRiX; ORR 86%). A modo de comparación, las combinaciones de rituximab/HD-MTX/citarabina o HD-MTX/citarabina alcanzaron una ORR del 73% y del 53%, respectivamente [4].
La elección de la terapia de inducción varía según la región y el médico. Las terapias típicas consisten en rituximab/HD-MTX/procarbazina/vincristina (R-MVP), rituximab/HD-MTX, temozolomida/HD-MTX, MATRiX (véase más arriba) y rituximab/HD-MTX/tenipósido/carmustina/metilprednisolona (R-MVBP).
Estos regímenes de tratamiento son generalmente bien tolerados e incluso los pacientes ancianos pueden ser tratados con ellos siempre que la función renal se mantenga bien. La hepatitis, la insuficiencia renal y de la médula ósea son posibles efectos secundarios. Se describe la toxicidad neurológica del MTX, en particular en forma de encefalopatías agudas o subagudas y leucoencefalopatías multifocales que se desarrollan meses o años después de la administración de MTX.
El papel de la radioterapia de todo el cerebro (WBRT) sigue siendo controvertido: un ensayo de fase III demostró que la WBRT consolidada prolongaba la SLP de 12 a 18 meses, pero sin mejorar la supervivencia (32,4 frente a 37 meses). Sin embargo, también se observó un aumento de la neurotoxicidad debido a la irradiación [5]. No obstante, varios grupos de investigación siguen trabajando con regímenes terapéuticos que incluyen WBRT modificada y, sobre todo, de dosis reducida. La WBRT se está sustituyendo cada vez más por regímenes de consolidación con quimioterapia debido a su neurotoxicidad conocida e irreversible, en la medida en que las funciones orgánicas y el estado general del paciente lo permitan. Un estudio multicéntrico de 202 pacientes mostró tasas de éxito similares para los pacientes tratados con dosis altas de etopósido/citarabina después de la terapia de inducción con R-MTX en comparación con la WBRT [6]. La quimioterapia mieloablativa más agresiva con trasplante autólogo de células madre (HCD-ASCT) puede realizarse en pacientes más jóvenes con un buen estado de salud general. Dos ensayos que utilizaron R-MVP o HD-MTX/tiotepa/citarabina como regímenes de inducción mostraron tasas de respuesta elevadas (>90%) y una SLP de >74 meses con HCD-ASCT [7,8].
Varios estudios retrospectivos no mostraron ningún beneficio de la adición de quimioterapia intratecal [9]. Se supone que las dosis de MTX >3 g/m2 ya alcanzan concentraciones citotóxicas en el LCR que hacen superflua la administración intratecal y ya no justifican el mayor gasto de la terapia mediante punciones lumbares repetidas y el consiguiente riesgo de infección.
Seguimiento tras la terapia
Dado que el riesgo de recurrencia tras la terapia de primera línea es elevado, los pacientes deben ser controlados regularmente durante el curso. Además de un examen clínico y neurológico, deben realizarse imágenes cerebrales por resonancia magnética cada tres meses durante los dos primeros años y cada seis meses a partir de entonces. Después de cinco años, las inspecciones pueden tener lugar anualmente.
Pacientes mayores
El tratamiento óptimo de los pacientes ancianos con PZNSL sigue siendo controvertido. Estos pacientes presentan problemas específicos, sobre todo debido a sus comorbilidades, su peor estado de salud general, el aumento de las tasas de complicaciones y el hecho de que suelen responder peor a las terapias. Un estudio francés comparó dos métodos terapéuticos en pacientes mayores de 70 años. Este estudio demostró que la HD-MTX/procarbazina/vincristina/citarabina era tan bien tolerada como la terapia menos agresiva con HD-MTX y temozolomida. Sin embargo, la ORR (82% frente a 71%) y la supervivencia global (31 frente a 14 meses) fueron mejores en el primer grupo [10].
Terapia del PZNSL recidivante o refractario
Aunque las tasas de respuesta tras la terapia de inducción son bastante notables, entre el 10 y el 15% de los pacientes siguen siendo refractarios a la terapia de inducción. Además, el 50% de los pacientes que han respondido al tratamiento inicial desarrollan una recaída en el curso del tratamiento. La mediana de tiempo hasta la recidiva es de 10-18 meses [11]. En caso de recidiva, el pronóstico posterior es muy malo. En el momento de la recidiva, debe realizarse una nueva estadificación clínica con imágenes de todo el eje del SNC, un examen oftalmológico y una PET de cuerpo entero. Cabe señalar aquí que hasta un 10% de los pacientes con PZNSL presentan una recaída sistémica.
Hasta la fecha, no existe una terapia estándar para esta situación. La elección de la terapia se basa en la edad del paciente, su estado funcional, la consideración de terapias previas y su respuesta, y la inclusión de comorbilidades. La reexposición al MTX puede ser una opción razonable, especialmente en pacientes que mostraron una respuesta inicial a largo plazo a un régimen de inducción que contenía MTX. Este tratamiento produjo ORR del 85-91% y una mediana de supervivencia de 41-62 meses [12,13]. Los estudios prospectivos con otros agentes quimioterapéuticos, incluidos temozolomida, pemetrexed, topotecán o rituximab, mostraron tasas de respuesta del 31-55% con tasas medias de SLP de 1,6-5,7 meses. En pacientes más jóvenes en buen estado general, el HCD-ASCT puede ser una opción [14]. La WBRT sigue siendo una alternativa en pacientes que no pueden recibir quimioterapia a altas dosis o que tienen un estado de salud general muy deficiente. Los estudios retrospectivos con WBRT muestran tasas de respuesta del 74-79% y tiempos medios de supervivencia de 10-16 meses [15]. Sin embargo, el síntoma principal de los déficits cognitivos suele agravarse, por lo que el beneficio y el riesgo de la WBRT deben sopesarse con mucho cuidado. En pacientes con daños cerebrales graves, también es aconsejable considerar la posibilidad de renunciar a la terapia.
También están surgiendo nuevas estrategias terapéuticas. El ligando PD-1 (“muerte celular programada”; PDL-1) está desregulado y sobreexpresado en >50% de los PZNSL. Por lo tanto, las terapias con anticuerpos monoclonales contra PD-1 o PDL-1, como nivolumab o pembrolizumab, son prometedoras. Una pequeña serie de cuatro pacientes con PZNSL recidivante o refractario mostró una SLP de 14-17 meses [16]. Los estudios prospectivos se encuentran actualmente en fase de reclutamiento. La lenalidomida, un derivado de la talidomida, combinada con rituximab mostró un efecto positivo en una presentación en la Reunión ASCO 2016 de Rubenstein et al. también obtuvo una ORR prometedora del 67%.
El ibrutinib es un inhibidor de la tirosina quinasa Bruton, una parte clave de la vía de señalización del receptor de células B que suele presentar mutaciones en el PZNSL. El ibrutinib atraviesa la barrera hematoencefálica y puede medirse en el líquido cefalorraquídeo a dosis terapéuticas. En una pequeña serie de PZNSL recidivante, el ibrutinib mostró una ORR del 77% con una tasa de SLP de 7,4 meses [17]. Un ensayo de fase I combinó la terapia inicial con ibrutinib con una consolidación consistente en temozolomida, etopósido, doxorrubicina liposomal, dexametasona y rituximab. Los pacientes de este estudio mostraron una ORR del 94% tras el ibrutinib, y el 86% de los pacientes alcanzaron posteriormente la remisión completa [18]. Sin embargo, el ibrutinib conlleva un alto riesgo de aspergilosis pulmonar y cerebral.
Literatura:
- Abrey LE, et al: Linfoma primario del sistema nervioso central: el modelo de pronóstico del Memorial Sloan-Kettering Cancer Center. J Clin Oncol 2006; 24(36): 5711-5715.
- Batchelor T, et al: Tratamiento del linfoma primario del SNC con metotrexato y radioterapia diferida: un informe del NABTT 96-07. J Clin Oncol 2003; 21(6): 1044-1049.
- Ferreri AJ, et al: Citarabina en dosis altas más metotrexato en dosis altas frente a metotrexato en dosis altas solo en pacientes con linfoma primario del SNC: un ensayo aleatorizado de fase 2. Lancet 2009; 374(9700): 1512-1520.
- Ferreri AJ, et al: Quimioinmunoterapia con metotrexato, citarabina, tiotepa y rituximab (régimen MATRix) en pacientes con linfoma primario del SNC: resultados de la primera aleatorización del ensayo de fase 2 del International Extranodal Lymphoma Study Group-32 (IELSG32). Lancet Haematol 2016; 3(5): e217-227.
- Korfel A, et al: Estudio aleatorizado de fase III de radioterapia de todo el cerebro para el linfoma primario del SNC. Neurología 2015; 84(12): 1242-1248.
- Rubenstein JL, et al: Quimioterapia intensiva e inmunoterapia en pacientes con linfoma primario del SNC recién diagnosticado: CALGB 50202 (Alianza 50202). J Clin Oncol 2013; 31(25): 3061-3068
- Omuro A, et al: R-MPV seguida de quimioterapia de dosis alta con TBC y trasplante autólogo de células madre para el linfoma primario del SNC de diagnóstico reciente. Sangre 2015; 125(9): 1403-1410.
- Illerhaus G, et al: Quimioterapia de dosis alta con trasplante autólogo de células madre hemopoyéticas para el linfoma primario del SNC de diagnóstico reciente: un ensayo prospectivo de un solo brazo en fase 2. Lancet Haematol 2016; 3(8): e388-397.
- Sierra Del Rio M, et al: Quimioterapia profiláctica intratecal en el linfoma primario del SNC. J Neurooncol 2012; 106(1): 143-146.
- Omuro A, et al: Metotrexato y temozolomida frente a metotrexato, procarbazina, vincristina y citarabina para el linfoma primario del SNC en una población anciana: ensayo aleatorizado de fase 2 intergrupo ANOCEF-GOELAMS. Lancet Haematol 2015; 2(6): e251-259.
- Jahnke K, et al: Recaída del linfoma primario del sistema nervioso central: características clínicas, resultado y factores pronósticos. J Neurooncol 2006; 80(2): 159-165.
- Pentsova E, Deangelis LM, Omuro A: Reexposición al metotrexato para el linfoma primario recurrente del sistema nervioso central. J Neurooncol 2014; 117(1): 161-165.
- Plotkin SR, et al: Tratamiento del linfoma del sistema nervioso central recidivante con dosis altas de metotrexato. Clin Cancer Res 2004; 10(17): 5643-5646.
- Soussain C, et al: Quimioterapia intensiva seguida de rescate con células madre hematopoyéticas para el linfoma primario del SNC e intraocular refractario y recurrente: J Clin Oncol 2008; 26(15): 2512-2518.
- Hottinger AF, et al: Radioterapia cerebral completa de rescate para el linfoma primario del SNC recurrente o refractario. Neurología 2007; 69(11): 1178-1182.
- Nayak L, et al: Bloqueo de PD-1 con nivolumab en linfoma primario del sistema nervioso central y testicular en recaída/refractario. Sangre 2017; 129(23): 3071-3073.
- Grommes C, et al: El ibrutinib desenmascara el papel crítico de la tirosina quinasa Bruton en el linfoma primario del SNC. Cancer Discov 2017; 7(9): 1018-1029.
- Lionakis MS, et al: Inhibición de la señalización del receptor de células B por el ibrutinib en el linfoma primario del SNC. Cancer Cell 2017; 31(6): 833-843.e5.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2018; 6(3): 34-38