Los nuevos tratamientos para la hepatitis C crónica están ahora disponibles para todos los pacientes infectados, independientemente del estadio de fibrosis. Las combinaciones DAA hacen que la enfermedad sea curable en más del 95% de los casos.
Según las estimaciones de la OMS, alrededor de 71 millones de personas en todo el mundo están infectadas por el virus de la hepatitis C (VHC) y unas 400.000 personas mueren cada año como consecuencia de la infección por el virus de la hepatitis C. Por ello, la eliminación de las infecciones por los virus de la hepatitis B y C como afecciones potencialmente mortales para 2030 (mediante la reducción de la tasa de nuevas infecciones en un 90% y de la mortalidad en un 65%) se ha formulado como uno de los principales objetivos médicos para los próximos años [1,2].
Según las estimaciones, en Suiza hay unas 40.000 personas afectadas por el virus de la hepatitis C, lo que corresponde aproximadamente al 0,5% de la población, por lo que aún hay que contar con un número considerable de casos no declarados (personas infectadas no diagnosticadas) [3].
Transmisión y acumulación de virus
El virus se transmite por vía parenteral, hoy en día principalmente a través del uso compartido de agujas durante el consumo de drogas intravenosas y debido a las deficientes normas de higiene en las actividades médicas. En el pasado, muchas transmisiones se produjeron a través de productos sanguíneos infectados antes de 1990, así como por la falta de normas de higiene, por ejemplo, al hacerse tatuajes. La infección también es posible a través del sexo anal y verticalmente de madre a hijo (alrededor de un 5% de riesgo de transmisión) [4].
El virus de la hepatitis C es un virus ARN monocatenario y tiene tres proteínas estructurales (núcleo, E1, E2) y siete proteínas no estructurales (p7, NS2, NS3, NS4A, NS4B, NS5A y NS5B) [5]. Tiene una gran variabilidad genética, que se manifiesta en seis genotipos diferentes con otros subtipos. En todo el mundo, la infección por el genotipo 1 es la más común (aproximadamente el 46%), y el genotipo 1 también es responsable de algo menos de la mitad de las infecciones en Suiza [6,7].
Curso de la enfermedad, diagnóstico, terapia
En la infección por el VHC, se distingue una forma aguda de una forma crónica. La hepatitis C aguda suele ser asintomática, con síntomas inespecíficos como fatiga, dolor abdominal, mialgia y rara vez ictericia. Toma un curso crónico en alrededor del 50-80% de los casos.
En un pequeño estudio multicéntrico alemán, se demostró que seis semanas de terapia antiviral con sofosbuvir/ledipasvir en un total de 20 pacientes con infección aguda por el virus de la hepatitis C de genotipo 1 conducían a una respuesta virológica sostenida en todos los casos, evitando así la cronificación de la infección vírica [8]. Sin embargo, dado que la infección aguda por el virus de la hepatitis C rara vez se reconoce debido a los síntomas inespecíficos y a menudo también puede ser asintomática, la terapia de la hepatitis C aguda sólo desempeña un papel menor en comparación con la terapia de la hepatitis C crónica.
Una infección crónica por el VHC puede ser asintomática durante mucho tiempo y sólo provocar síntomas inespecíficos como fatiga, pérdida de rendimiento, molestias en la parte superior del abdomen, picores o molestias articulares en una fase tardía. También pueden producirse manifestaciones extrahepáticas como crioglobulinemia, nefropatía mediada por complejos inmunes del VHC o linfoma no Hodgkin de células B. Alrededor del 20-30% de los pacientes con VHC crónico desarrollan cirrosis en los 30 años siguientes. Los factores de riesgo para la progresión de la fibrosis del tejido hepático son principalmente la edad >40 años en el momento de la infección, el consumo de alcohol de más de 50 g al día y el sexo masculino [9].
La incidencia del carcinoma hepatocelular en la cirrosis asociada a la hepatitis C es de alrededor del 3-6% [10].
El Estudio Suizo de Cohortes de la Hepatitis C descubrió que alrededor del 61% de los pacientes con VHC crónica habían nacido entre los años 1955 y 1974 [11]. Especialmente en pacientes nacidos en estos años con los correspondientes antecedentes de riesgo (abuso de drogas i.v., transfusiones de sangre antes de 1990, tatuajes), debe considerarse la posibilidad de realizar un cribado anti-VHC (Fig. 1 ) en caso de fatiga persistente u otras molestias inespecíficas y debe buscarse tratamiento en caso de resultado positivo. Por lo demás, deben someterse a las pruebas los grupos de riesgo habituales, como las personas con transaminasas elevadas, con infección por el VIH o el VHB, con consumo de drogas intravenosas/intranasales o con piercing/tatuajes, los pacientes en diálisis y los hijos de madres infectadas por el VHC.
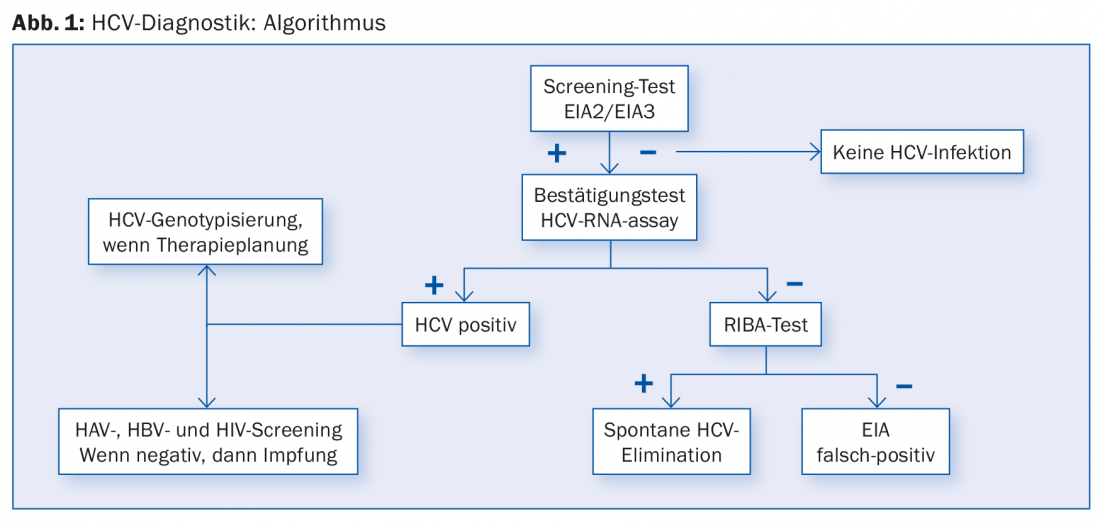
Sin embargo, en algunos casos, una prueba de cribado anti-VHC puede dar un falso positivo (Fig. 1). Por lo tanto, siempre debe realizarse una PCR del ARN del VHC en caso de una prueba de detección positiva. Si la PCR del VHC es negativa, se debe a que el paciente ya se ha infectado por el VHC o a un falso positivo en la prueba de detección. En este caso, ayuda otro inmunoensayo, el llamado ensayo RIBA (“recombinant immunoblot assay”). Esta prueba de confirmación es más precisa que la prueba de cribado anti-VHC. Si la prueba RIBA es positiva, el paciente ha contraído la hepatitis C. Si el resultado es negativo y la PCR del VHC es negativa al mismo tiempo, se puede suponer claramente que se trata de una prueba de cribado anti-VHC falsamente positiva; entonces ya no son necesarios más exámenes.
Durante mucho tiempo, la terapia para la hepatitis C consistió en una combinación de interferón pegilado alfa y ribavirina, que en el peor de los casos podía durar hasta 18 meses. La terapia sólo respondió en el 50-70% de los pacientes con la aparición simultánea de efectos secundarios a veces graves como efectos hematotóxicos, síntomas gripales, fatiga o síntomas psiquiátricos. El desarrollo de nuevos antivirales de acción directa (AAD) ha revolucionado la terapia contra el VHC. En lugar de una larga terapia con interferón con muchos efectos secundarios y tasas de éxito moderadas, la terapia con una combinación de AAD tiene hoy en día tasas de éxito superiores al 95% con muy buena tolerabilidad y sin efectos secundarios significativos [12].
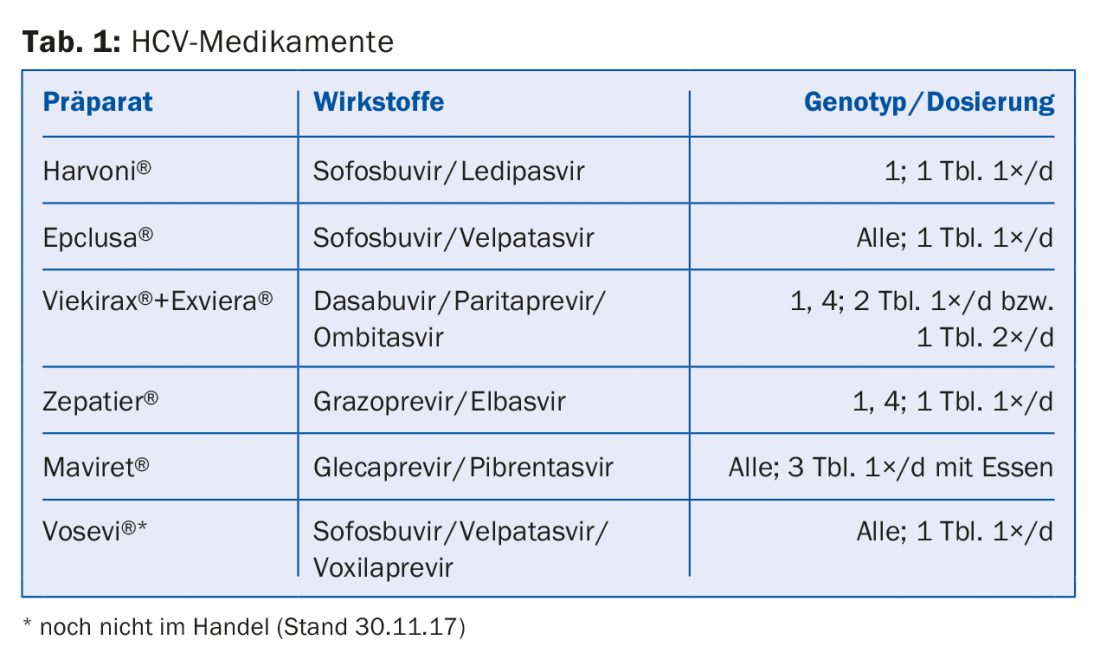
Los inhibidores de la NS5A del VHC, como el ledipasvir o el velpatasvir, inhiben la proteína viral NS5A, que desempeña un papel en la replicación del VHC y en la modulación de la función celular, y terminan con el sufijo -asvir. Entre los inhibidores de la polimerasa NS5B dependientes del ARN, los inhibidores nucleósidos (NI), como el sofosbuvir, se distinguen de los inhibidores no nucleósidos (INN), como el dasabuvir, ya que terminan con el sufijo -buvir. Los inhibidores de la proteasa como el grazoprevir o el glecaprevir inhiben la serina proteasa NS3/A4 propia del virus y terminan con el sufijo -previr. La tabla 1 presenta una selección de los medicamentos aprobados actualmente en Suiza y sujetos al seguro de enfermedad obligatorio.
Indicadores de éxito de la terapia
El éxito de la terapia antiviral se evalúa doce semanas después del final de la terapia. Si el ARN viral ya no puede detectarse mediante biología molecular por PCR, se habla de respuesta virológica sostenida (RVS), por lo que los pacientes pueden considerarse libres de virus y curados.
Los metaestudios demuestran que la probabilidad de un retorno posterior del virus en los cinco años siguientes al final de la terapia es inferior al 1% en la población normal y de alrededor del 10% en la población de alto riesgo (consumo continuado de drogas por vía intravenosa, reclusos). Sin embargo, los afectados tienen muchas más probabilidades de reinfectarse con el virus, a menudo con un genotipo diferente, que de recaer en una fase posterior [13].
Otros estudios demuestran que la consecución de la RVS reduce tanto la mortalidad asociada al hígado como la extrahepática derivada de la infección por el virus de la hepatitis C [14]. Además, lograr la RVS también se asocia a un aumento de la calidad de vida, por lo que es un criterio de valoración establecido y relevante para el paciente en la terapia de la hepatitis C [14].
Si se consigue la RVS en pacientes sin cirrosis hepática, deberá realizarse un control de laboratorio del ARN del VHC al cabo de unos doce meses. Si la prueba sigue siendo negativa, se considera que los pacientes están definitivamente curados y no requieren seguimiento, siempre que no existan otros factores de riesgo hepatológico. Los pacientes con cirrosis hepática deben seguir siendo visitados cada seis meses para un seguimiento clínico y de laboratorio y un cribado ecográfico del carcinoma hepatocelular (CHC), incluso después de haber alcanzado la RVS.
Recurrencia de CHC
Dos estudios de cohortes diferentes en Bolonia [15] y Barcelona [16] descubrieron que los pacientes con CHC tratado previamente presentaban inexplicablemente una recurrencia del CHC seis meses después de finalizar la terapia antiviral en el 29% y el 27,6% de los casos, respectivamente. En los pacientes sin antecedentes de CHC, se detectó CHC en aproximadamente el 3,2% de los casos en ambos estudios. Esta asociación no pudo confirmarse en otros estudios. Sin embargo, el número de estudios al respecto sigue siendo reducido. Hasta que haya más datos sobre este tema, recomendamos en la práctica un examen ecográfico del hígado antes y después de la terapia antiviral.
Planificación de la terapia
Hasta hace poco, la terapia con AAD sólo estaba disponible en Suiza para los pacientes con fibrosis hepática de grado 2 o superior debido a los elevados precios. Sin embargo, desde el 1.10.2017 a más tardar, con la importante reducción de precios, la limitatio ya no es aplicable; desde entonces, la terapia con AAD es obligatoria para todos los pacientes infectados por el VHC, independientemente del estadio de fibrosis.
Deben tenerse en cuenta los siguientes factores en la selección y duración de la terapia: Genotipo del VHC, cirrosis/sin cirrosis, sin tratamiento/con tratamiento (y si es así, cuál), así como comorbilidades.
Las combinaciones de AAD recomendadas en las directrices de la SASL (Asociación Suiza para el Estudio del Hígado) de agosto de 2017 pueden encontrarse modificadas en las tablas 2 a 5 para las constelaciones respectivas [17]. Además, las recomendaciones terapéuticas para el fármaco recientemente aprobado Maviret® (glecaprevir/pibrentasvir) se enumeran de acuerdo con la información sobre el producto [18]. Puede utilizarse y prescribirse desde el 1.12.2017.
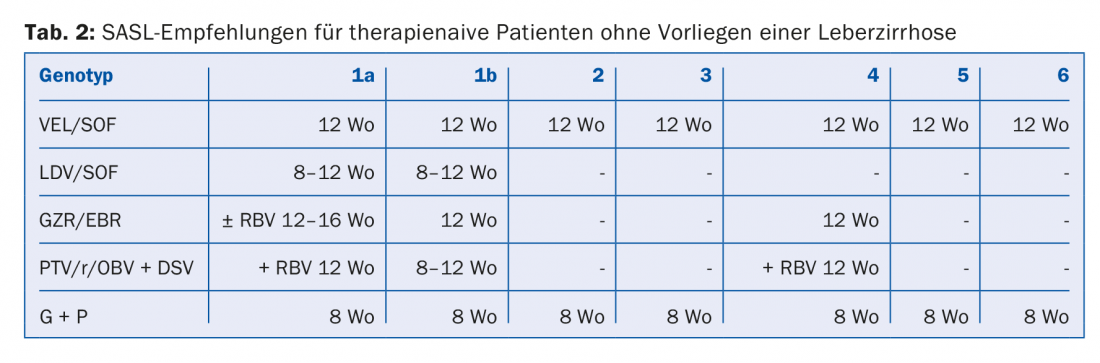
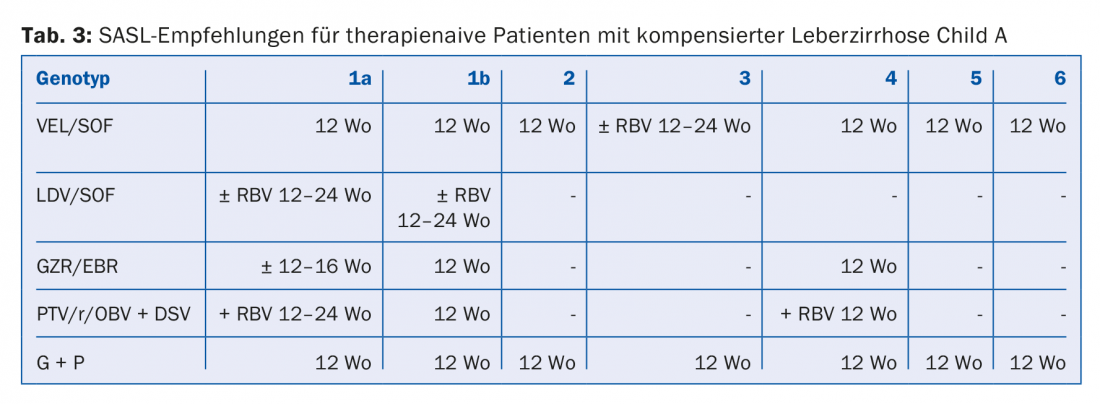
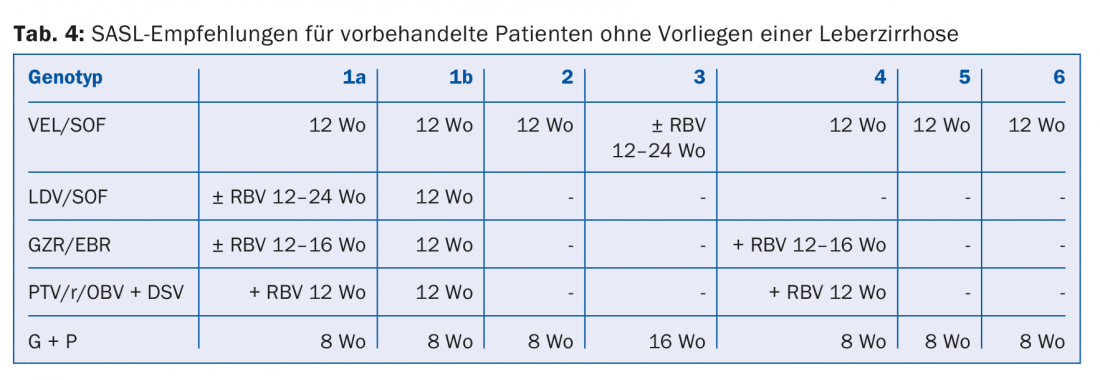
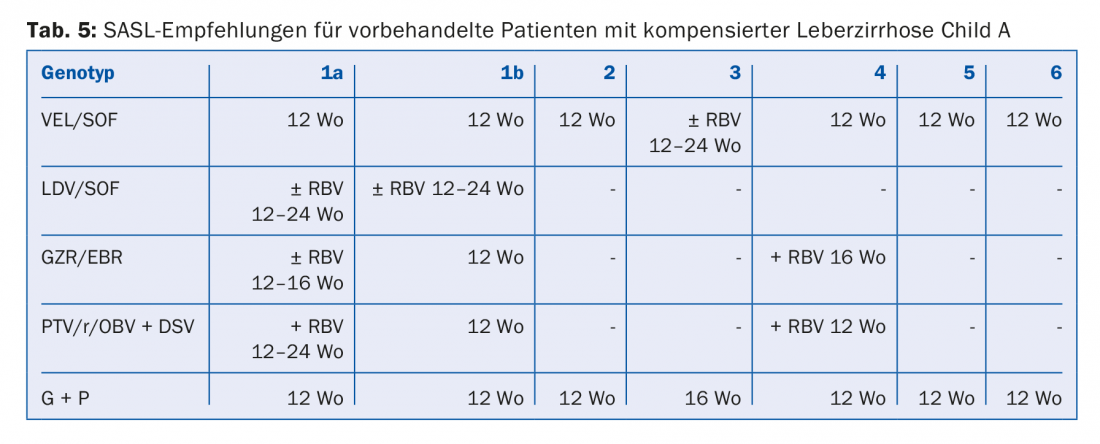
Debido a la actualización constante de las recomendaciones terapéuticas, es aconsejable informarse sobre la terapia individual, por ejemplo, en la página web www.sasl.ch o en la aplicación para smartphone SASL HCV Advisor.
Cabe destacar las combinaciones de AAD sofosbuvir/velpatasvir y glecaprevir/pibrentasvir, cuya ventaja radica en su alta eficacia pangenotípica. Además, la combinación glecaprevir/pibrentasvir sólo requiere una duración total de la terapia de ocho semanas y fue muy bien tolerada en los ensayos; los efectos secundarios más comunes fueron dolor de cabeza (18-19%) y fatiga (9-12%) [19]. En consecuencia, esta combinación se considera especialmente beneficiosa en pacientes con un cumplimiento difícil.
Fracaso de la terapia
El fracaso del tratamiento con una combinación de AAD suele deberse a una situación virológica compleja con la selección de variantes asociadas a la resistencia (VAR), por lo que la nueva terapia con una combinación de AAD + ribavirina debe iniciarse en un centro especializado tras la realización de pruebas de resistencia [20].
Como alternativa, puede considerarse la terapia con los nuevos fármacos antivirales glecaprevir/pibrentasvir o sofosbuvir/velpatasvir/voxilaprevir. En el caso de la combinación sofosbuvir/velpatasvir/voxilaprevir durante 12 semanas, dos grandes ensayos de fase 3 (POLARIS 1 y 4) alcanzaron sendas tasas de RVS del 96% y el 98%, respectivamente, en todos los genotipos con fracaso terapéutico previo de una combinación de AAD [21]. Se espera que este último sea aprobado en Suiza a principios de 2018.
Interacciones y contraindicaciones
Si se toman otros fármacos durante la terapia antiviral, es esencial informarse sobre su potencial para interactuar con los AAD (por ejemplo, en la página www.hep-druginteractions.org o en www.compendium.ch).
Especialmente los antiarrítmicos, antibióticos, antidepresivos o anticonvulsivos que inhiben la glicoproteína P o interactúan con el sistema CYP suelen resultar problemáticos. Por ejemplo, el uso simultáneo de sofosbuvir y amiodarona puede provocar bradiarritmias potencialmente mortales [22].
En presencia de insuficiencia renal crónica con una TFGe <30 ml/min, deben utilizarse combinaciones sin sofosbuvir [23]. Además, está contraindicada una terapia durante el embarazo, ya que los estudios realizados hasta el momento no han podido excluir un posible efecto teratogénico de los AAD.
En pacientes con cirrosis Child B/C y con descompensaciones previas, debe evitarse el uso de inhibidores de la proteasa, ya que alcanzan una concentración mucho mayor [23].
Sólo si los proveedores de atención primaria y los especialistas trabajan juntos será posible alcanzar el objetivo común de la Estrategia Suiza contra la Hepatitis y la OMS, a saber, eliminar el VHC para 2030.
Mensajes para llevarse a casa
- Al haber descendido el límite para la mayoría de las combinaciones de AAD (“antivirales de acción directa”), la terapia para la hepatitis C crónica está disponible para todos los pacientes infectados, independientemente del estadio de fibrosis, y está cubierta por el seguro médico.
- Con las nuevas combinaciones de AAD, la hepatitis C crónica es curable en más del 95% de los casos sin que se produzcan efectos secundarios significativos.
- Si se consigue una situación de RVS (“respuesta virológica sostenida”), la probabilidad de una recaída tardía de la infección por hepatitis C es inferior al 1%.
- Se espera que las combinaciones de AAD pangenotípicamente eficaces sofosbuvir/velpatasvir o sofosbuvir/velpatasvir/voxilaprevir, así como glecaprevir/pibrentasvir, simplifiquen aún más la terapia de la infección crónica por el virus de la hepatitis C en el futuro.
Literatura:
- OMS: Hoja informativa sobre la hepatitis C. www.who.int/mediacentre/factsheets/fs164/en/
- OMS: Informe mundial sobre la hepatitis 2017. http://apps.who.int/iris/bitstream/10665/255016/1/9789241565455-eng.pdf?ua=1
- Zahnd C, et al.: Análisis de la situación de las hepatitis B y C en Suiza. FOPH Marzo 2017.
- Yeung CY, et al.: Transmisión vertical del virus de la hepatitis C: conocimientos actuales y perspectivas. World J Hepatol 2014; 6: 643-651.
- Webster DP, et al: Hepatitis C. Lancet 2015; 385: 1124-1135.
- Messina JP, et al: Distribución mundial y prevalencia de los genotipos del virus de la hepatitis C. Hepatología 2015; 61(1): 77-87.
- Bruggmann P: Epidemiología de la hepatitis C en Suiza y papel de la atención primaria. Práctica 2016; 105(15): 885-889.
- Deterding K, et al: Combinación de dosis fija de ledipasvir más sofosbuvir durante 6 semanas en pacientes con monoinfección aguda por el genotipo 1 del virus de la hepatitis C (HepNet Acute HCV IV): un estudio de fase 2 abierto y de un solo brazo. Lancet Infect Dis 2017; 17: 215-222.
- Poynard T, et al.: Historia natural de la progresión de la fibrosis hepática en pacientes con hepatitis C crónica. Los grupos OBSVIRC, METAVIR, CLINIVIR y DOSVIRC. Lancet 1997; 349: 825-832.
- Fattovich G, et al: Carcinoma hepatocelular en la cirrosis: incidencia y factores de riesgo. Gastroenterología 2004; 127: 35-50.
- Bruggmann P, et al: Distribución del año de nacimiento en los casos de hepatitis C en Suiza. Eur J Public Health 2015 Feb; 25(1): 141-143.
- Zeuzem S: Opciones de tratamiento en la hepatitis C. Dtsch Arztebl Int 2017 Jan; 114(1-2): 11-21.
- Simmons B, et al.: Riesgo de recaída tardía o reinfección por el virus de la hepatitis C tras lograr una respuesta virológica sostenida: revisión sistemática y metaanálisis. Clin Infect Dis 2016; 62: 683-694.
- Lee MH, et al: La infección crónica por el virus de la hepatitis C aumenta la mortalidad por enfermedades hepáticas y extrahepáticas: un estudio prospectivo comunitario a largo plazo. J Infect Dis 2012; 206; 469-477.
- Conti F, et al: Aparición precoz y recurrencia del carcinoma hepatocelular en la cirrosis relacionada con el VHC tratada con antivirales de acción directa. J de Hepatol 2016; 65(4): 727-733.
- Reig M, et al: Alta tasa inesperada de recidiva tumoral precoz en pacientes con CHC relacionado con el VHC sometidos a tratamiento sin interferón. J de Hepatol 2016 Oct; 65(4): 719-726.
- SASL: Directrices. https://sasl.unibas.ch/guidelines/SASL-SSI_HepC_EOS_Aug2017.pdf (última consulta: 16 de octubre de 2017).
- Información técnica Maviret®. www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Product_Information/human/004430/WC500233677.pdf (última consulta: 16 de octubre de 2017).
- Zeuzem S: ENDURANCE-1: A Phase 3 Evaluation of the Efficacy and Safety of 8- versus 12- week Treatment with Glecaprevir/Pibrentasvir (formerly ABT-493/ABT-530) in HCV Genotype 1 Infected Patients with or without HIV-1 Co-infection and without Cirrhosis. The AASLD Liver Meeting, Boston 2016; Presentación oral.
- Vermehren J, et al: Retratamiento de pacientes en los que fracasaron las terapias combinadas con AAD – Experiencia real de una gran base de datos de resistencia a la hepatitis C. J Hepatol 2016; 64; S188.
- Bourlière M, et al: Sofosbuvir, velpatasvir, voxilaprevir para la infección por VHC previamente tratada. N Engl J Med 2017; 376: 2134-2146.
- Fontaine H, et al: Bradiarritmias asociadas al tratamiento con sofosbuvir. N Engl J Med 2015; 373: 1886-1888.
- EASL: Recomendaciones sobre el tratamiento de la hepatitis C 2016. J Hepatol 2017 Jan; 66(1): 153-194.
PRÁCTICA GP 2018; 13(1): 24-28











