La terapia sistémica del carcinoma de células renales está cambiando. Varios inhibidores de la tirosina quinasa pueden prolongar significativamente la supervivencia en estadios metastásicos. Las inmunoterapias también son eficaces.
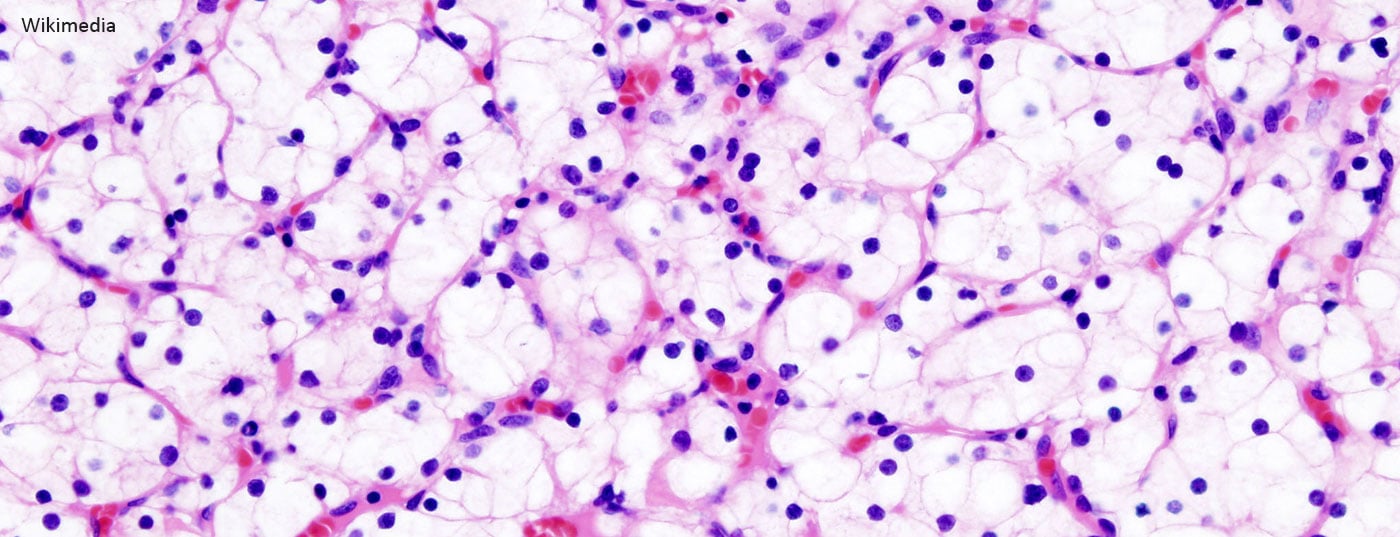
El carcinoma de células renales representa alrededor del 2-3% de todos los tumores malignos. La incidencia mundial en 2012 se estima en 338.000 casos con 144.000 muertes asociadas al tumor. Así, el carcinoma de células renales ocupa el 13º lugar mundial en cuanto a incidencia [1–3] . Tras el carcinoma de próstata y el carcinoma urotelial de vejiga urinaria, es el tercer tumor urológico más frecuente. El término “tumor renal” abarca un amplio espectro de tumores heterogéneos, así como diferentes entidades histopatológicas. Los tres subtipos más comunes son el carcinoma de células renales de células claras, el papilar y el cromófobo, que juntos representan alrededor del 85-90% de todos los tumores renales malignos y de los cuales el subtipo de células claras es el que tiene peor pronóstico [4]. En aproximadamente el 10-15% de los casos, los tumores renales son benignos [5]. Los tumores renales benignos más frecuentes son el oncocitoma y el angiomiolipoma.
Epidemiología
La edad principal de aparición del carcinoma de células renales se sitúa entre los 60 y los 70 años [5,6]. Los hombres se ven afectados con más frecuencia que las mujeres, aproximadamente 1,5:1. Los factores de riesgo son el tabaquismo, la obesidad, la hipertensión arterial y la insuficiencia renal crónica [5,6]. Una pequeña proporción de los carcinomas de células renales son hereditarios, destacando en este contexto el síndrome de Von Hippel-Lindau (VHL), la esclerosis tuberosa y el síndrome de Birt-Hogg-Dubé.
Diagnóstico
En la actualidad, la mayoría de los carcinomas de células renales se diagnostican de forma incidental, es decir, como un hallazgo casual en un examen de imagen con una cuestión médica diferente y son asintomáticos en el momento del diagnóstico inicial. Como resultado, los tumores renales se diagnostican con más frecuencia en una fase temprana que en el pasado, lo que ha dado lugar al denominado “cambio de estadio” en las últimas décadas [5,6]. La tríada sintomática clásica de dolor en el costado, macrohematuria y tumor abdominal palpable es actualmente muy rara. Sin embargo, si estos síntomas locales están presentes, suele tratarse de una enfermedad tumoral ya localmente avanzada y metastatizada con un mal pronóstico consecutivo. La exploración física general desempeña un papel bastante secundario en el diagnóstico del carcinoma de células renales. Sin embargo, los varicoceles de nueva aparición o el edema de las extremidades inferiores pueden ser indicios de espacio retroperitoneal, que en consecuencia debe excluirse mediante pruebas de imagen [6]. Los tumores renales pueden provocar diversos síntomas paraneoplásicos [6].
Los hallazgos renales anormales en la ecografía deben aclararse más con una tomografía computarizada (TC) multifásica con contraste del abdomen o con una resonancia magnética. En casos especiales, la ecografía con contraste puede ser útil [5]. Las lesiones ocupantes de espacio del riñón se dividen generalmente en lesiones sólidas y quísticas. Las lesiones quísticas se dividen en cinco categorías (I, II, IIF, III, IV) para evaluar la dignidad de la TC mediante la clasificación de BOSNIAK [7,8]. Los hallazgos de las categorías III y IV se consideran malignos hasta que se demuestre lo contrario; por lo tanto, está indicada la aclaración histológica. En las masas sólidas del riñón, la captación local del medio de contraste (MC) aplicado es un importante criterio de malignidad [5].
La localización exacta del tumor (central, periférica, proximidad al hilio o al pielón, etc.), la extensión local del tumor, cualquier afectación vascular (por ejemplo, trombos tumorales en la vena renal y en la vena cava) y los agrandamientos sospechosos de los ganglios linfáticos se evalúan mediante TC o RM para poder realizar una estadificación precisa según la clasificación TNM actual (Tab. 1) [5,6]. La diferenciación de los angiomiolipomas y oncocitomas libres de grasa de los procesos malignos puede causar dificultades en el diagnóstico por imagen [9]. Si se sospecha la presencia de un carcinoma de células renales, debe realizarse un TAC suplementario del tórax para excluir metástasis pulmonares [5].

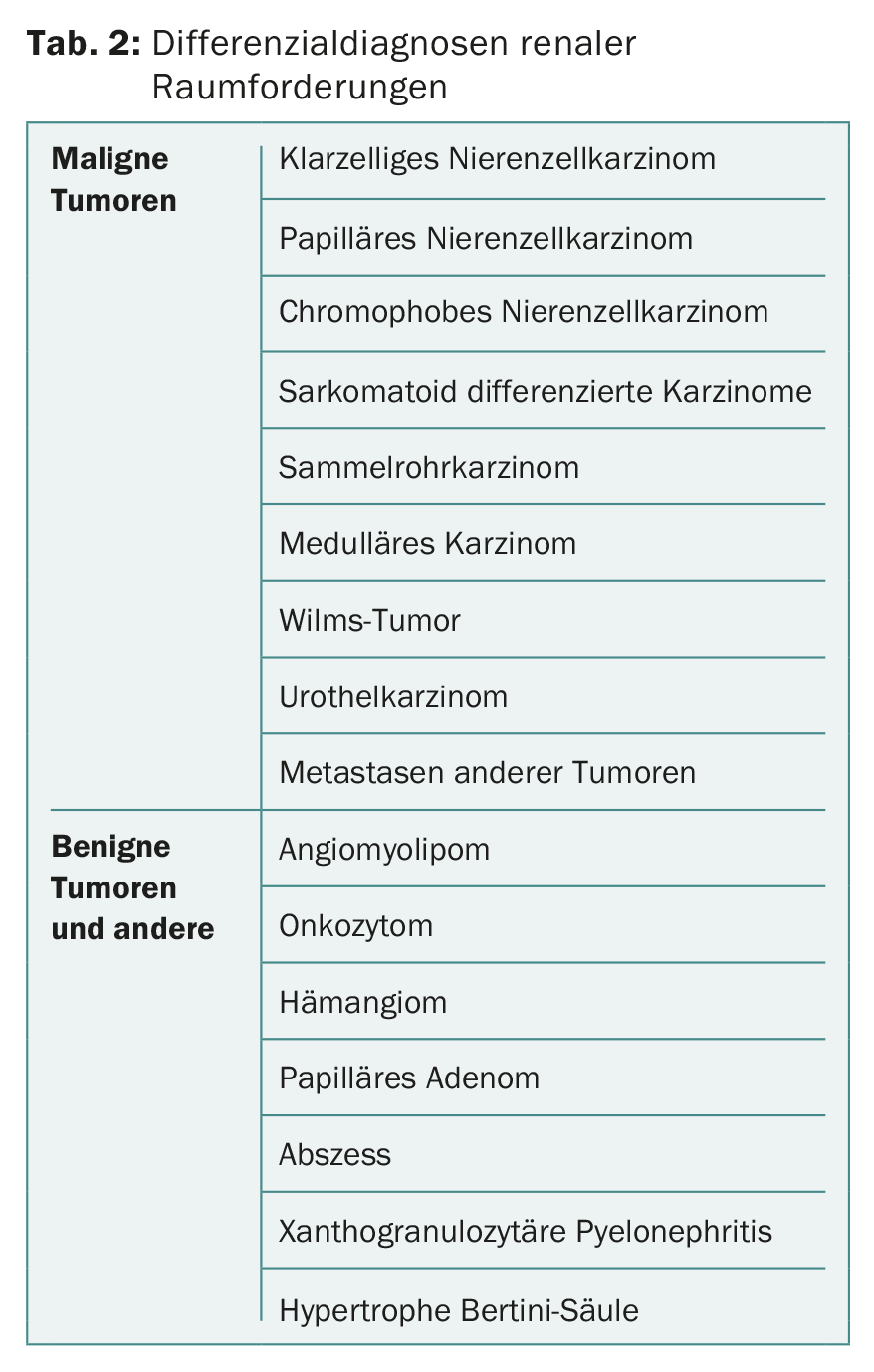
Mientras que la biopsia percutánea de tumores renales solía estar prácticamente contraindicada debido a la preocupación por las metástasis en la endoprótesis, en la actualidad se realiza cada vez con más frecuencia. La biopsia es especialmente importante en las lesiones radiológicamente poco claras, en los tumores renales pequeños antes de incluirlos en una estrategia de vigilancia activa, antes de una terapia ablativa local o en la enfermedad tumoral metastásica para la adquisición de la histología [5,6,9]. En el caso de los tumores renales metastásicos, esto permite elegir una terapia sistémica adecuada. La biopsia de un tumor renal también permite diferenciar las metástasis de otros tumores primarios. La biopsia puede realizarse por ecografía o guiada por TC. Los posibles diagnósticos diferenciales de las masas renales se muestran en la tabla 2.
Puesta en escena
La estadificación clínica del carcinoma de células renales se realiza según la clasificación TNM actual (Tab. 1) [5,10]. El sistema de clasificación de la OMS/ISUP (Organización Mundial de la Salud/Sociedad Internacional de Patología Urológica) sustituye al sistema de clasificación histológica desarrollado en la década de 1980 y más utilizado internacionalmente, análogo al de Fuhrmann [5,11,12].
Terapia quirúrgica
La terapia estándar para el carcinoma de células renales suele ser la extirpación quirúrgica completa del tumor [9]. En el carcinoma de células renales localizado, se realiza con intención curativa. Históricamente, la nefrectomía radical fue el patrón oro durante mucho tiempo [6]. Hoy en día, en función de la localización y el tamaño del tumor renal, debe optarse por una técnica quirúrgica que preserve el nefrón, en el sentido de una resección renal parcial. La supervivencia específica del tumor en el carcinoma de células renales localizado parece ser comparable tras la resección renal parcial y la nefrectomía [5]. Los datos retrospectivos sugieren que la supervivencia global es mejor tras la resección renal parcial para el carcinoma de células renales localizado que tras la nefrectomía [5, 13-15].
Las directrices actuales de la EAU recomiendan realizar una resección renal parcial para el carcinoma de células renales en estadio T1 [5]. En principio, puede hacerse de forma abierta, laparoscópica o asistida por robot. En el estadio T2, se recomienda la nefrectomía laparoscópica si no se puede realizar una resección renal parcial [5].
La suprarrenalectomía ipsilateral rutinaria no parece conferir ningún beneficio para la supervivencia y, por lo tanto, sólo se realiza si se sospecha una infiltración tumoral [5]. Las metástasis en los ganglios linfáticos (pN+) se asocian a un mal pronóstico. Sin embargo, los datos sobre la importancia de la linfadenectomía son controvertidos. Actualmente, según las directrices actuales de la EAU, la linfadenectomía sólo se recomienda en caso de sospecha clínica de metástasis en los ganglios linfáticos (cN+) [5]. Si los ganglios linfáticos son clínicamente poco visibles, puede considerarse para tumores diferenciados grandes o sarcomatoides. En el caso del carcinoma de células renales ya metastatizado, se puede ofrecer a los pacientes una nefrectomía citorreductora antes de iniciar una terapia sistémica, especialmente en el caso de tumores renales de gran tamaño [5].
Alternativas a la cirugía
En pacientes de edad avanzada con comorbilidades relevantes y/o una esperanza de vida limitada, pueden discutirse alternativas a la cirugía para el carcinoma de células renales localizado. En particular, los tumores renales pequeños diagnosticados de forma incidental pueden controlarse regularmente con pruebas de imagen en estos pacientes (vigilancia activa) [5,9]. La tasa de crecimiento de estas lesiones que ocupan espacio y el riesgo de progresión a la fase metastásica son bajos [5,6]. Inicialmente, la confirmación histológica del diagnóstico mediante una biopsia del tumor renal puede ser útil en este concepto [6]. No se han definido unos desencadenantes claros para pasar al tratamiento activo. Las opciones de tratamiento mínimamente invasivo como la crioablación o la ablación por radiofrecuencia (ARF) también pueden analizarse en una población de pacientes seleccionada [5,6]. Estos procedimientos se realizan por vía percutánea o asistidos por laparoscopia. La situación actual de los datos no permite aún una evaluación concluyente de estas terapias en lo que respecta al control tumoral y la morbilidad. La embolización arterial selectiva puede considerarse en el caso de tumores renales inoperables que sean sintomáticos con, por ejemplo, dolor en el flanco o macrohematuria [5].
Terapia sistémica del carcinoma de células renales
Afortunadamente, el tratamiento sistémico del carcinoma avanzado de células renales de células claras ha mejorado mucho en los últimos años. Aunque responde mal a la quimioterapia, se sabe desde hace tiempo que las reacciones inmunológicas desempeñan un papel. Así, pueden observarse estabilizaciones más prolongadas e incluso regresiones de las metástasis pulmonares o ganglionares tras la extirpación del tumor primario. En el 9% de los pacientes con carcinoma de células renales metastásico, el tratamiento con interferón-alfa puede producir remisiones, aunque con una toxicidad considerable. Esta última sigue siendo significativamente superior con los tratamientos con interleucina 2, pero pueden observarse remisiones impresionantes que duran años en aproximadamente el 10% de los pacientes.
En más del 80% de los carcinomas de células renales de células claras, el tumor presenta una alteración bialélica del gen VHL, lo que provoca un aumento de la formación de VEGF (“factor de crecimiento endotelial vascular”), que es un importante factor de crecimiento. Varios inhibidores de la tirosina quinasa pueden inhibir los receptores del VEGF (así como otros receptores) y han demostrado ser fármacos eficaces en el carcinoma metastásico de células renales. Han sustituido a la mayoría de los medicamentos mencionados.
En la terapia de primera línea, el sunitinib oral y el pazopanib, igualmente eficaz pero ligeramente menos tóxico, son actualmente las principales opciones. En ensayos aleatorizados, el sunitinib mostró una respuesta en el 31% frente al 6% con el entonces estándar interferón-alfa, y una prolongación hasta la progresión tumoral de cinco a once meses. La supervivencia también se amplió en 4,6 meses, hasta los 26,4 meses. Los efectos secundarios pueden incluir diarrea, hipertensión, fatiga, reacciones cutáneas, pelo blanco y disfunción tiroidea, así como trastornos cardíacos. El cabozantinib puede ser más eficaz que el sunitinib en la terapia de primera línea, según un nuevo ensayo de fase II, pero esto aún debe confirmarse en un ensayo de fase III antes de que pueda convertirse en el nuevo estándar.
El mecanismo de acción mencionado también explica la eficacia del anticuerpo monoclonal bevacizumab, que se une al VEGF. La combinación con interferón-alfa está aprobada en la terapia de primera línea.
Según los datos del estudio, el inhibidor de mTOR everolimus es otra opción para el carcinoma de células renales con peor pronóstico. Los posibles efectos secundarios son la estomatitis y los efectos secundarios hematológicos. Una indicación para el everolimus es el fracaso de la terapia basada en anti-VEGF.
También puede utilizarse un inhibidor de la tirosina quinasa en la terapia de segunda línea (como el axitinib o el sorafenib). El inhibidor de la tirosina quinasa cabozantinib prolongó significativamente la supervivencia (21,4 frente a 16,5 meses) en la terapia de segunda línea en comparación con everolimus [16]. La combinación de lenvatinib con everolimus fue incluso capaz de prolongar la supervivencia en diez meses en un ensayo de fase II.
Datos recientes interesantes muestran en parte muy buenos resultados con la inmunoterapia (inhibidores de los puntos de control). Un ensayo de fase III de nivolumab en terapia de segunda línea mostró una prolongación de la mediana de supervivencia en comparación con everolimus de 5,4 meses a 25 meses y una tasa de respuesta superior del 25% frente al 5% [17]. Otra ventaja de esta terapia es también la toxicidad generalmente mucho menor, incluidas varias enfermedades autoinmunes. Sin embargo, nosotros mismos también hemos visto pacientes con efectos secundarios graves (por ejemplo, una enfermedad reumática invalidante que dura meses en el sentido de la polimialgia reumática). Recientemente, se ha demostrado (CHECKMATE-214 en ESMO 2017) que la inmunoterapia combinada con nivolumab e ipilimumab es superior al tratamiento con sunitinib en primera línea, especialmente cuando se expresa PD-L1, con una respuesta superior del 58% frente al 25% y un tiempo prolongado hasta la progresión tumoral de 22,8 frente a 5,9 meses. Así pues, las inmunoterapias están pasando a la terapia de primera línea como resultado de estos datos actuales. Sin embargo, esta superioridad sobre el sunitinib no se aplica a los pacientes del grupo de buen pronóstico.
La elección de la terapia de tercera línea se basa en los tratamientos anteriores y su éxito.
Tratamiento adyuvante
Los estudios sobre el tratamiento adyuvante tras la cirugía del carcinoma de células renales y en casos de alto riesgo de recidiva con diferentes sustancias fueron negativos y controvertidos durante años. Datos recientes [18] muestran que el sunitinib durante un año como terapia adyuvante en entornos de alto riesgo puede aumentar el tiempo hasta la recaída de 5,6 a 6,8 años. Sin embargo, actualmente sigue siendo un tratamiento fuera de indicación.
Mensajes para llevarse a casa
- La edad principal de aparición del carcinoma de células renales se sitúa entre los 60 y los 70 años.
- En función de la localización y el tamaño del tumor renal, debe optarse, si es posible, por una técnica quirúrgica que preserve el nefrón.
- La biopsia percutánea de tumores renales se realiza cada vez con más frecuencia en la actualidad.
- La terapia sistémica del carcinoma de células renales está cambiando gracias a nuevos fármacos y combinaciones. Varios inhibidores de la tirosina quinasa pueden prolongar significativamente la supervivencia en estadios metastásicos. Las inmunoterapias (inhibidores de los puntos de control) también son eficaces en las fases metastásicas.
- El tratamiento adyuvante es una opción si el riesgo de recidiva es elevado.
Literatura:
- Torre LA, et al: Estadísticas mundiales sobre el cáncer, 2012. CA: A Cancer J Clin 2015; 65(2): 87-108.
- Ferlay J, et al: Incidencia y mortalidad por cáncer en todo el mundo: fuentes, métodos y patrones principales en GLOBOCAN 2012. Int J Cancer 2015; 136(5): 359-386.
- Red Europea de Registros de Cáncer: Kidney cancer (KC) Factsheet. Febrero de 2017. www.encr.eu
- Shuch B, et al.: Comprender las variantes patológicas del carcinoma de células renales: Destilar oportunidades terapéuticas de la complejidad biológica. Eur Urol 2015; 67(1): 85-97.
- Ljungberg B, et al: Directrices de la EAU sobre el carcinoma de células renales. Asociación Europea de Urología. Actualización limitada de marzo de 2017. www.uroweb.org
- Capitanio U, Montorsi F: Cáncer renal. The Lancet 2016; 387: 894-906.
- Israel GM, Bosniak M: Cómo lo hago yo: evaluación de masas renales. Radiología 2005; 236(2): 441-450.
- Warren KS, McFarlane J: La clasificación Bosniak de las masas quísticas renales. BJU Int 2005; 95(7): 939-942.
- Schmid HP: Tendencias en el carcinoma de células renales: evolución de la clarificación y terapia localizada. info@oncology 2015; 5: 27-30.
- Edge S, et al: Manual de estadificación del cáncer del AJCC. 7ª edición. Nueva York: Springer-Verlag 2010.
- Moch H: El sistema de clasificación OMS/ISUP para el carcinoma renal. Patólogo 2016; 37(4): 355-360.
- Dagher J, et al: Carcinoma de células renales claras: validación de la clasificación de la Organización Mundial de la Salud/Sociedad Internacional de Patología Urológica. Histopathology 2017 Jul 18. DOI: 10.1111/his.13311 [Epub ahead of Print].
- Roos FC, et al: Ventaja de supervivencia de la nefrectomía parcial frente a la radical en pacientes que presentan un carcinoma de células renales localizado. BMC Cancer 2014; 14(1): 372.
- Zini L, et al: Nefrectomía radical frente a nefrectomía parcial: efecto sobre la mortalidad general y no relacionada con el cáncer. Cáncer 2009; 115(7): 1465-1471.
- Huang WC, et al: Nefrectomía parcial frente a nefrectomía radical en pacientes con tumores renales pequeños: ¿hay diferencia en la mortalidad y los resultados cardiovasculares? J Urol 2009; 181(1): 55-62.
- Choueiri TK, et al: Cabozantinib frente a everolimus en el carcinoma avanzado de células renales (METEOR): resultados finales de un ensayo aleatorizado, abierto, de fase 3. Lancet Oncol 2016; 17: 917-927.
- Motzer RJ, et al: Nivolumab frente a everolimus en el carcinoma avanzado de células renales. N Engl J Med 2015; 373: 1803-1813.
- Ravaud A, et al: Sunitinib adyuvante en el carcinoma de células renales de alto riesgo tras nefrectomía. N Engl J Med 2016; 375(23): 2246-2254.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2017; 5(6): 23-26