Incluso en pacientes con tumores, deben buscarse deliberadamente causas tratables de anemia antes de la transfusión. No transfundir por estar por debajo de un “desencadenante de transfusión”: La indicación de una transfusión debe hacerse siempre en función de la situación clínica. Una estrategia de transfusión restrictiva también es apropiada en pacientes tumorales. En pacientes hemato-oncológicos, pueden estar indicados los hemoderivados irradiados. Los agentes estimulantes de la eritropoyesis (eritropoyetina, darbopoyetina) son una alternativa a las transfusiones en casos individuales, pero sólo en caso de anemia bajo quimioterapia. En la situación curativa, deben evitarse.
La anemia es un problema frecuente en los pacientes tumorales (Tab. 1) . Deteriora la calidad de vida, es un cofactor importante de la fatiga asociada al tumor y constituye un factor pronóstico negativo en muchas entidades tumorales. La etiología de la anemia suele ser multifactorial. Además de las comorbilidades (por ejemplo, insuficiencia renal, deficiencias), la enfermedad tumoral (hemorragia, hiperesplenismo, infiltración de la médula ósea, medio de citoquinas proinflamatorias) y su tratamiento (efecto mielosupresor y nefrotóxico de la quimioterapia y/o la radioterapia, rara vez hemólisis inducida por fármacos) contribuyen a su desarrollo.

El tratamiento es preferiblemente causal, a menudo sólo son posibles medidas de apoyo. Para ello existen las transfusiones de sangre y la administración de agentes estimulantes de la eritropoyesis (ESA). A continuación se destacan algunos aspectos de la transfusión sanguínea en pacientes tumorales. Las directrices válidas en Suiza para la evaluación previa a la transfusión, así como aspectos seleccionados de la aplicación práctica, se han presentado recientemente en el Foro Médico Suizo y no se mencionan aquí por separado [1].
Aclaraciones antes de la transfusión
Las evaluaciones iniciales antes de iniciar la transfusión deben garantizar que no se pasen por alto otras causas tratables de anemia. Las aclaraciones deben realizarse antes de iniciar las transfusiones y en caso de un curso imprevisto, como un aumento de la frecuencia de las transfusiones.
La evaluación visual del frotis sanguíneo aporta pruebas de una causa contribuyente de la anemia, por ejemplo, signos de displasia en el síndrome mielodisplásico (SMD), microesferocitos en la hemólisis autoinmune o fragmentocitos en la microangiopatía trombótica. La determinación de los reticulocitos permite distinguir la anemia hipo de la hiperregenerativa, según la cual una anemia hiperregenerativa es siempre una indicación de un aumento del consumo con una capacidad de síntesis intacta, una situación poco habitual en el contexto de una anemia tumoral y que requiere más aclaraciones.
La búsqueda de deficiencias de sustrato incluye un estado del hierro (hierro, transferrina, saturación de transferrina, ferritina y PCR, receptor soluble de transferrina si los hallazgos no son claros), vitamina B12 (si los hallazgos son dudosos, holotranscobalamina, posiblemente ácido metilmalónico y homocisteína) y ácido fólico eritrocítico. Una determinación de creatinina revela una disfunción renal concomitante; en caso de disfunción renal manifiesta, es útil la determinación de eritropoyetina. El aumento de la LDH y la disminución de la haptoglobina indican hemólisis. La prueba de Coombs está indicada principalmente en pacientes con leucemia linfocítica crónica, linfoma no Hodgkin o antecedentes de enfermedades autoinmunes.
Si es previsible una dependencia transfusional más prolongada (por ejemplo, en caso de SMD o de larga duración de la terapia), puede ser útil caracterizar el patrón de antígenos de los eritrocitos del paciente con respecto a otros sistemas de grupos sanguíneos, además de las aclaraciones pretransfusionales obligatorias, para poder seleccionar los concentrados de eritrocitos de forma más específica. Esto puede reducir la probabilidad de formación de aloanticuerpos, lo que dificulta los cuidados posteriores. Después de la primera transfusión, estas pruebas serológicas ya no son posibles y deben utilizarse métodos biológicos moleculares.
Activación de la transfusión y dosis de transfusión
El objetivo de la transfusión es minimizar los síntomas relacionados con la anemia y prevenir los daños orgánicos relacionados con la hipoxia. El beneficio potencial debe contrastarse con los efectos secundarios asociados a la transfusión (Tab. 2) [2].

La indicación no puede hacerse depender únicamente de que se esté por debajo de un “umbral de transfusión”, ya que las consecuencias clínicas dependen no sólo del grado de anemia, sino también del tipo de aparición, la duración y el contexto clínico de la anemia. Los síntomas graves son más probables con una aparición rápida, mientras que con un desarrollo lento de la anemia, entran en acción mecanismos compensatorios de varios niveles (por ejemplo, aumento del gasto cardíaco, ajuste de la capacidad de fijación de oxígeno, alteración del consumo de oxígeno y ajuste de la extracción de oxígeno en los tejidos diana) [3]. Las enfermedades pulmonares y cardio o cerebrovasculares preexistentes limitan a menudo la capacidad de adaptación. Así pues, la indicación de una transfusión depende crucialmente de la situación del paciente y es siempre una decisión clínica individual (tab. 3).

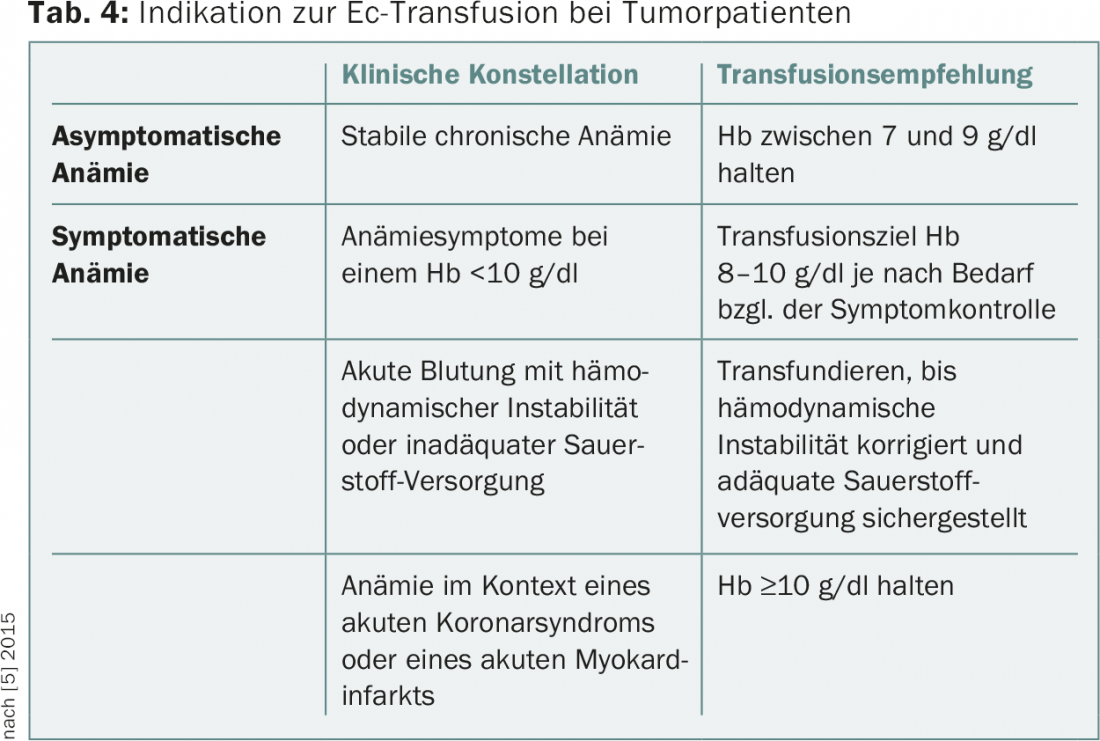
En general, puede distinguirse una estrategia de transfusión restrictiva (transfusión a Hb de ≤7-9 g/dl) de una liberal (transfusión a Hb ≤9-10 g/dl). Se ha demostrado mediante ensayos aleatorios que una estrategia restrictiva no ofrece desventajas quo ad vitam, sino que ayuda a evitar las complicaciones asociadas a las transfusiones y a reducir los costes. Según un análisis Cochrane, una estrategia de transfusión restrictiva conlleva una reducción estadísticamente significativa de la mortalidad asociada al hospital y no aumenta la tasa de acontecimientos adversos como infartos de miocardio o insultos cerebrovasculares [4]. Sin embargo, los datos prospectivos proceden en su mayoría del contexto de la gestión de la anemia perioperatoria o de la medicina intensiva y no se refieren a pacientes ambulatorios. No existen estudios prospectivos aleatorizados para los pacientes con tumores, pero en general también se acepta una estrategia de transfusión restrictiva para este grupo de pacientes. La tabla 4 muestra las recomendaciones para la transfusión en pacientes con tumores realizadas en las directrices actuales de la NCCN (febrero de 2015) [5].
Para los pacientes con trombocitopenia grave concomitante, debe tenerse en cuenta que el riesgo de hemorragia aumenta con la disminución de la concentración de hemoglobina. Por ello, se recomienda en pacientes trombopénicos mantener la hemoglobina >8 g/dl.
Un concentrado de eritrocitos (CE, volumen aprox. 300 ml) produce un aumento de la concentración de Hb de aprox. 1 g/dl. Siguiendo un dogma no escrito, se suelen administrar dos CE por transfusión. Sin embargo, existen pruebas de que la transfusión de un único CE también puede ser eficaz, al menos en pacientes hospitalizados sometidos a quimioterapia intensiva [6]. En el contexto de un programa individual de transfusión ambulatoria, también es una opción, por ejemplo en pacientes con comorbilidad cardiaca o si se toleran mal las grandes fluctuaciones de hemoglobina con un intervalo de transfusión más largo.
Si los síntomas subjetivos desempeñan un papel en la indicación, es aconsejable registrarlos de forma semicuantitativa antes de la primera transfusión y documentar su evolución durante la terapia (por ejemplo, utilizando una escala analógica visual).
Productos sanguíneos irradiados en pacientes con inmunosupresión
Los pacientes con inmunosupresión grave relacionada con la terapia corren el riesgo de padecer la enfermedad de injerto contra huésped asociada a la transfusión (ta-EICH). En este caso, los linfocitos T del donante contenidos en el hemoderivado se dirigen contra el tejido receptor porque no pueden ser reconocidos como extraños y eliminados. La enfermedad es mortal en >90% de los casos. Tras la introducción de la depleción leucocitaria (que limita el contenido de leucocitos de un hemoderivado a <1× 106), la tasa de indicación, ya de por sí muy baja, ha disminuido aún más, pero se han notificado casos aislados incluso tras la administración de hemoderivados con depleción leucocitaria [7].
Después de la irradiación (min. 25 Gy), los linfocitos del hemoderivado ya no son capaces de dividirse y ya no pueden desencadenar la ta-GvHD. Las indicaciones para la administración de hemoderivados irradiados según las directrices actuales se resumen en la tabla 5 [8,9]. No existen directrices vinculantes para Suiza. Además de las indicaciones indiscutibles (pacientes tras un trasplante de células madre hematopoyéticas, terapia con análogos de las purinas), hay situaciones que se valoran de forma diferente.
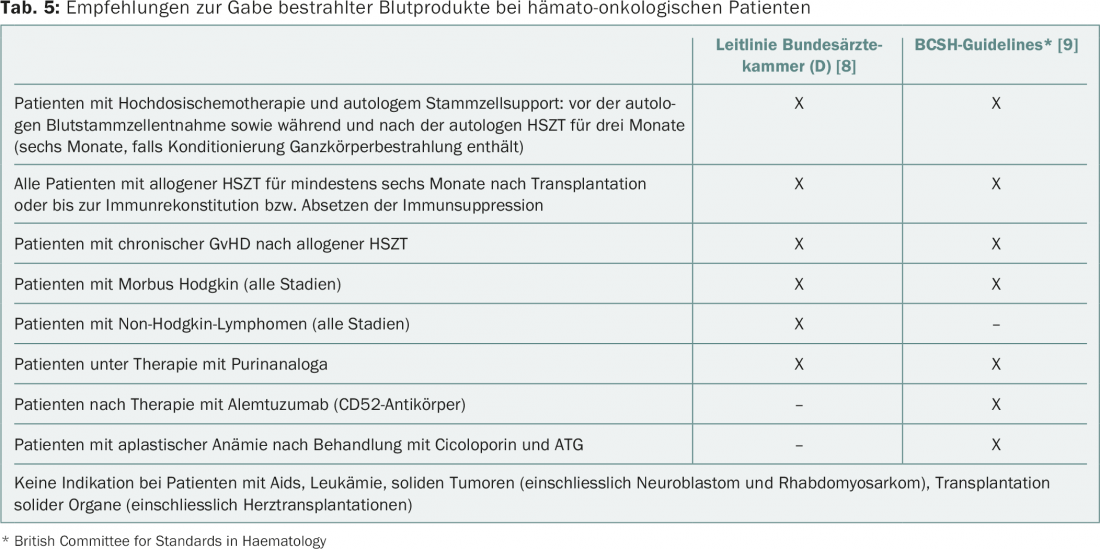
La inactivación patógena de los concentrados de plaquetas, que se practica a escala nacional en Suiza, tiene el mismo efecto que la irradiación. Por lo tanto, sólo los concentrados de CE y granulocitos, que de todas formas sólo se utilizan en indicaciones muy especiales, necesitan ser irradiados.
La quelación del hierro en la dependencia transfusional a largo plazo
Cada CE contiene unos 200-250 mg de hierro. Dado que el organismo sólo puede eliminar el hierro a través de la pérdida de sangre, cabe esperar una sobrecarga de hierro clínicamente relevante a partir de aprox. 20 EC. Así, la sustitución regular de Ec a largo plazo provoca efectos secundarios cardíacos o hepáticos mortales. Por lo tanto, la quelación del hierro es estándar para enfermedades hematológicas benignas como la talasemia.
No está claro si esto también puede mejorar el pronóstico de los pacientes con SMD dependientes de transfusiones a largo plazo. Las directrices actuales mencionan la opción de la quelación del hierro especialmente en pacientes dependientes de transfusiones con SMD de riesgo bajo o intermedio, una concentración de ferritina de >1000 mcg/l y una esperanza de vida de >1-2 años [10].
Agentes estimulantes de la eritropoyesis como alternativa a la transfusión
La eritropoyetina recombinante y la darbopoyetina forman parte del repertorio estándar en pacientes con SMD de bajo riesgo y un aumento inadecuado de la producción endógena de EPO; estos agentes también se han promovido intensamente para su uso en pacientes tumorales. En pacientes seleccionados, pueden reducir la frecuencia de las transfusiones y mejorar la calidad de vida. Sin embargo, hay indicios de que en los tumores sólidos el curso de la enfermedad puede verse influido desfavorablemente por la estimulación de, por ejemplo, los receptores de eritropoyetina en las células tumorales, así como por efectos fuera de diana, aunque la situación de los datos a este respecto es compleja y controvertida. Además, los agentes estimulantes de la eritropoyesis (AEE) aumentan el riesgo de episodios tromboembólicos.
Según la etiqueta de la Agencia Médica Europea (EMA), su uso sólo está indicado en la anemia asociada a la quimioterapia a partir de una Hb ≤10 g/dl; el objetivo es mantener estable la concentración de hemoglobina o elevarla un máximo de 2 g/dl. Cuando se administra con un objetivo de Hb >12 g/dL, se indica un aumento de la mortalidad. En la situación coadyuvante, los AEE deben utilizarse con precaución [11].
Me gustaría dar las gracias a mis colegas, la Dra. Christina Appenzeller y el Prof. Dr. Christoph Driessen, por su revisión crítica del manuscrito.
Literatura:
- Fontana S, Rigamonti V: Transfusión de hemoderivados. Foro Med Suiza 2013; 13(05): 89-93.
- Fopp M, Wernli M: Seguridad de las transfusiones de sangre en la actualidad. Foro Med Suiza 2006; 6: 139-144.
- Klein HG, et al: Transfusión de glóbulos rojos en la práctica clínica. Lancet 2007; 370 (9585): 415-426.
- Carson JL, et al: Umbrales de transfusión y otras estrategias para guiar la transfusión alogénica de hematíes. Cochrane Database Syst Rev 2012; 4: CD002042.
- Guía Nacional de Práctica Clínica en Oncología: Anemia inducida por cáncer y quimioterapia 2.2.01. www.nccn.org/professionals/physician_gls/pdf/anemia.pdf (consultado el 27.02.15)
- Berger MD, et al: Reducción significativa de las necesidades de transfusión de glóbulos rojos al cambiar de una política de transfusión de doble unidad a una de unidad única en pacientes que reciben quimioterapia intensiva o trasplante de células madre. Haematologica 2012; 97(1): 116-122.
- Williamson LM, et al: The impact of universal leukodepletion of the blood supply on hemovigilance reports of posttransfusion purpura and transfusion-associated graft-versus-host disease. Transfusión 2007; 47(8): 1455-1467.
- Bundesärztekammer: Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten – 4. aktualisierte und überarbeitete Auflage, 2014. www.bundesaerztekammer.de/downloads/QLL_Haemotherapie_2014.pdf (consultado el 27.02.2015)
- Treleaven J, et al: Directrices sobre el uso de componentes sanguíneos irradiados elaboradas por el grupo de trabajo sobre transfusión sanguínea del Comité Británico de Normas en Hematología. Revista Británica de Hematología 2010; 152: 35-51.
- Malcovati L, et al: Diagnóstico y tratamiento de los síndromes mielodisplásicos primarios en adultos: recomendaciones de la Red Europea contra la Leucemia. Sangre 2013; 122(17): 2943-2964.
- Schrijvers D, et al: Agentes estimulantes de la eritropoyesis en el tratamiento de la anemia en pacientes con cáncer: Guía práctica de uso de ESMO Clinica. Ann Oncol 2010; 21 Suppl 5: v244-247.
- Salama A, Welte M: Terapia con eritrocitos. En: Medicina transfusional e inmunohematología, Berlín Heidelberg Nueva York 2010, 311-319.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2015; 3(3-4): 15-18