En el tratamiento de las lesiones cerebrales traumáticas graves, hay mucha literatura y pocas pruebas. El cumplimiento estricto de un protocolo de tratamiento conduce a mejores resultados, y el tratamiento debe realizarse en centros especializados. Las causas y los desencadenantes del daño secundario deben buscarse y tratarse de forma agresiva. Normocapnia, normoxemia, normotensión, normoglucemia, normotermia y PIC normal resp. CPP son el objetivo. El tratamiento de todo el organismo se lleva a cabo según las “buenas prácticas clínicas en medicina intensiva”. Un pronóstico fiable y serio sólo puede hacerse a largo plazo. No es aconsejable tomar decisiones precipitadas basándose en los datos morfológicos de la imagen.
El tratamiento de cuidados intensivos tras un traumatismo craneoencefálico grave (TCEG) es un reto para todo el equipo de tratamiento. Participan médicos de cuidados intensivos, enfermeras de cuidados intensivos, neurocirujanos, neurólogos y otros especialistas de los campos de la logopedia, la terapia ocupacional y la fisioterapia. El tratamiento interdisciplinar en particular requiere una estrecha coordinación y gestión de los especialistas. Por ello, en Suiza, el tratamiento del SHT grave en adultos sólo puede llevarse a cabo en centros que dispongan de la infraestructura y el personal especializado necesarios. En la mayoría de las unidades de cuidados intensivos, los pacientes son tratados según un estricto protocolo de tratamiento [1–5]. Aunque faltan pruebas de la superioridad de un protocolo de tratamiento u otro [6], los estudios demuestran que seguir y cumplir un protocolo suele beneficiar al paciente [7].
En Suiza, aproximadamente 715 personas sufren un SHT grave al año [8]. La gravedad de la lesión suele determinarse mediante la escala de coma de Glasgow (GCS) o la puntuación abreviada de lesiones (AIS). El SHT grave se define como GCS <9 o AIS “cabeza” cuatro o cinco y tiene una gran importancia socioeconómica.
El tratamiento médico intensivo es una parte importante, pero no la única decisiva, de la cadena de tratamiento en la atención del SHT grave. Los principios del tratamiento de cuidados intensivos también se aplican en las áreas previas, empezando por la atención prehospitalaria de urgencia, pasando por la atención clínica de urgencia y la fase quirúrgica, hasta el ingreso en la unidad de cuidados intensivos.
Se denomina daño primario al causado por una fuerza directa o indirecta que actúa sobre la cabeza y el cerebro durante un tiempo muy breve (<0,2 mseg). Según la causa del accidente (accidente a alta velocidad), la intensidad y la dirección de la fuerza (fuerzas de aceleración o de rotación), se manifiesta en heridas por laceración-aplastamiento, fracturas de la bóveda craneal (fig. 1 ) , hemorragias extraaxiales (fig. 2) e intracerebrales, contusiones del tejido cerebral, edema cerebral perifocal o generalizado y lesiones por cizallamiento de las neuronas. Este daño estructural puede detectarse mediante TC o RMNc y no puede revertirse con ninguna terapia. Tras la angio-TC de urgencia inicial en la sala de shock (dependiendo de la causa del accidente, el curso de los acontecimientos, etc., incluso debe realizarse una TC de politraumatismo), debe tomarse una decisión interdisciplinar sobre si es necesaria una intervención quirúrgica o un enfoque conservador. tiene sentido.

Evite daños secundarios
El principio básico en el tratamiento del SHT es la prevención del llamado daño secundario, es decir, el daño que se produce después del insulto inicial. El objetivo principal es el suministro suficiente de oxígeno al cerebro. Por lo tanto, por un lado, se hace todo lo posible para permitir un suministro suficiente de oxígeno al cerebro y, por otro, se minimiza el consumo de oxígeno del cerebro. Esto incluye una terapia agresiva de volumen y catecolaminas, ventilación controlada con objetivos ajustados de paO2 y paCO2, y analgesia profunda (benzodiacepinas, propofol y opiáceos) del paciente.
La presión de perfusión cerebral (PPC) se sigue utilizando como marcador de una oxigenación adecuada debido a la falta de técnicas clínicamente viables. Es la diferencia de presión entre la presión arterial media (PAM) y la presión intracerebral (PIC) (PPC = PAM-PIC). Esto requiere la medición invasiva de la PIC [9]. Lo más habitual es introducir una sonda de presión intracraneal en el parénquima cerebral o en el sistema ventricular. Esto permite medir la presión intracraneal de forma continua. Una PPC >60 mmHg se considera actualmente suficiente en la mayoría de las directrices. Otras técnicas de examen que pueden utilizarse en el curso del tratamiento en función del problema son la electrofisiología (EEG, SSEP), los exámenes Doppler transcraneales y las mediciones de la perfusión.
La monitorización cerebral multimodal con medición local del metabolismo del tejido cerebral, como la microdiálisis cerebral (lactato, piruvato, glutamato y glicerol), las mediciones de O2 tisular (ptO2) y la temperatura cerebral, aún no ha podido establecerse como estándar. En la actualidad se carece de estudios clínicos que hayan podido demostrar un beneficio para el paciente cuando se utiliza la monitorización multimodal, ya que normalmente se analizan los llamados marcadores sustitutos.
Dado que el cerebro está encerrado por el cráneo óseo y la duramadre, cualquier aumento de volumen intracerebral (edema cerebral, hemorragia, acumulación de LCR, dilatación vascular venosa o arterial), tras el agotamiento de los mecanismos compensatorios, provoca un aumento de la PIC y compromete así la perfusión intracerebral (doctrina Monro-Kellie). Por lo tanto, el control de la PIC es otro objetivo terapéutico central además de la PPC.
Los aumentos de la PIC pueden ser intracerebrales (aumento del volumen intracerebral) o extracerebrales [10]. Las causas extracerebrales del aumento de la PIC son la hipoventilación/hipercarbia (dilatación vascular cerebral con aumento de la paCO2), la hiponatremia (potenciación del edema cerebral), los descensos de la tensión arterial, la hipoxemia, la fiebre debida a infecciones extracerebrales y los trastornos de la coagulación. La hiper o la hipoglucemia provocan un déficit energético.
Por lo general, cualquier trastorno de la coagulación debe tratarse de forma agresiva, porque los trastornos de la coagulación provocan hemorragias secundarias en el tejido cerebral traumatizado. Debido a la inmovilidad de los pacientes con SHT grave, aumenta el riesgo tromboembólico, que no se trata con medicación en los primeros días, sino sólo con medidas físicas como medias antitromboembólicas (ATS) y medias inflables secuenciales (“sequential stocking devices”, SCD).
Los daños en el SNC conducen a una neuroinflamación con formación de edema cerebral vasogénico o citotóxico con aumento de la PIC acompañante, necrosis y/o apoptosis de las células nerviosas. La administración de altas dosis de esteroides no puede suprimir esta neuroinflamación e incluso conduce a un peor resultado neurológico [11,12]. La interrupción de los esteroides es una de las pocas recomendaciones en el tratamiento del SHT grave con pruebas de grado I.
Si la terapia inicial conservadora o posneuroquirúrgica no estabiliza la PIC, debe realizarse un diagnóstico por imagen de urgencia para descartar una hemorragia postoperatoria, un edema cerebral o una congestión del LCR (Fig. 3) . Junto con los neurocirujanos, se discute una opción quirúrgica como la evacuación del hematoma, la hemicraniectomía [13] y/o el drenaje del líquido cefalorraquídeo. Si no es posible ninguna opción quirúrgica, se realiza una escalada adicional en el régimen por etapas (analgesia más profunda, relajación muscular, osmoterapia con manitol o solución salina hipertónica, hipotermia terapéutica y coma barbitúrico) [14].
Tras la estabilización, que suele durar varios días, puede realizarse un intento de recuperación bajo estricto control de la PIC. Esta fase de vigilia se caracteriza por una reacción masiva de estrés del organismo, que debe suprimirse en consecuencia con medicación.
Tratar todo el organismo
Otro principio básico es establecer la homeostasis y tratar todo el organismo, no sólo el SHT. Especialmente en el caso de lesiones múltiples, los principios de tratamiento específicos de cada órgano pueden competir entre sí, como en el caso de una lesión pulmonar grave con estrategia de ventilación protectora en combinación con un SHT grave (sin hipoventilación debido a la vasodilatación y al aumento de la PIC).
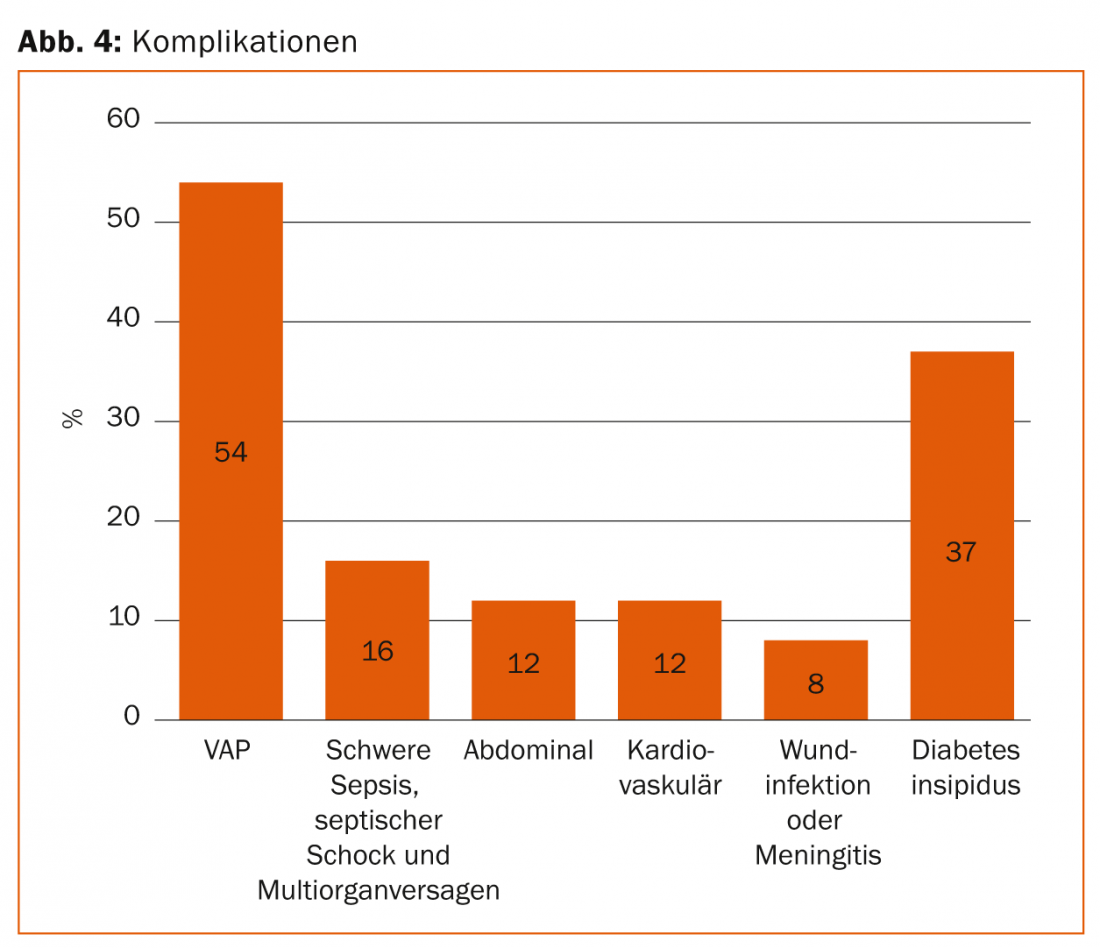
Los cuidados intensivos regulares a largo plazo provocan complicaciones como la neumonía asociada a la ventilación mecánica (NAV), la parálisis intestinal con una acumulación nutricional problemática, la translocación de bacterias intestinales con la consiguiente sepsis, el catabolismo grave (descomposición muscular) y el fallo multiorgánico (Fig. 4).
Neurorrehabilitación y pronóstico
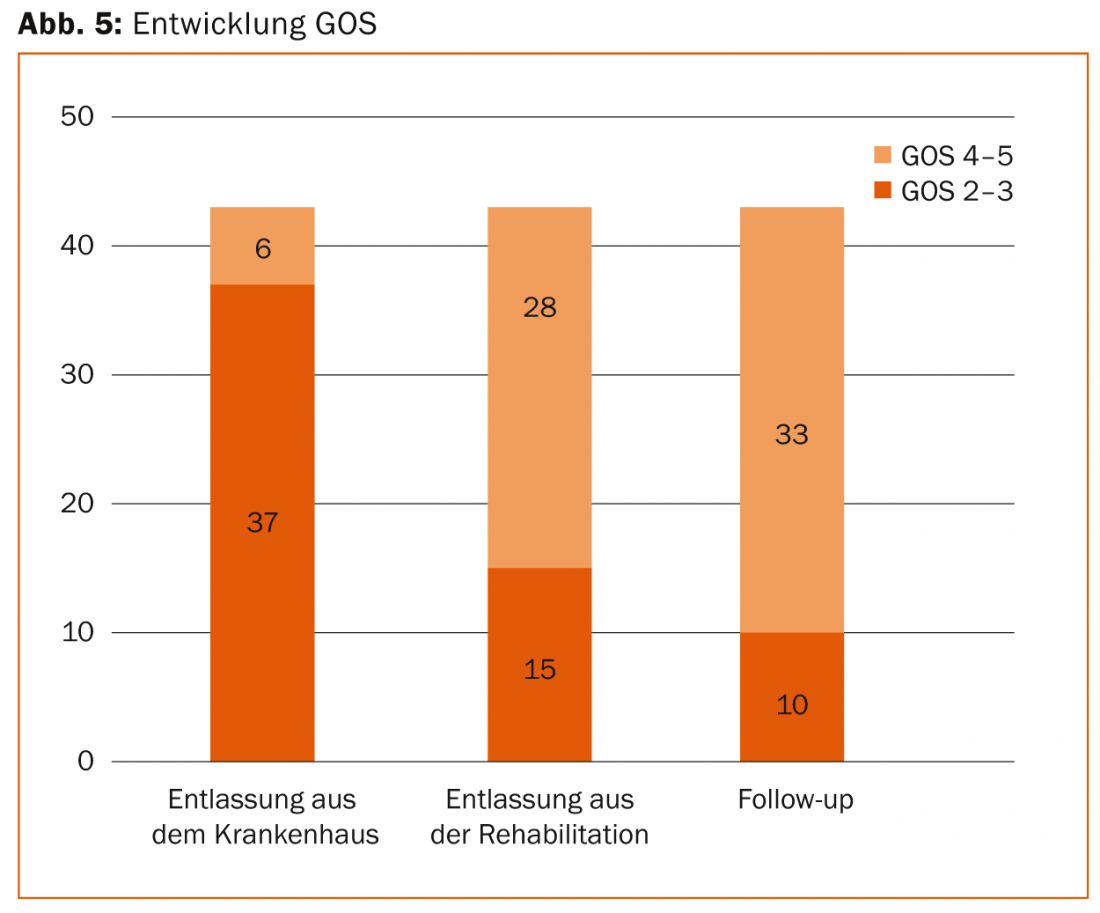
Todo paciente con un SHT grave necesita de varias semanas a meses de neurorrehabilitación tras la fase de cuidados intensivos. La neurorrehabilitación precoz, que ya se inicia durante la fase de recuperación en la unidad de cuidados intensivos y se continúa posteriormente en clínicas especiales, puede aportar una mejora significativa de la neurología en muchos casos. Por ejemplo, nuestros propios datos retrospectivos mostraron que tres cuartas partes de los pacientes con un SHT grave salieron de la UCI con déficits neurológicos graves (GOS 2-3) hacia la neurorrehabilitación, para poder volver de forma independiente a la vida cotidiana meses después de la neurorrehabilitación en tres cuartas partes de los casos en buen estado neurológico (GOS 4-5). (Fig. 5).
Por lo tanto, un pronóstico neurológico fiable sólo puede hacerse después de varias semanas, meses o sólo después de un año si se sobrevive a la fase inicial inestable crítica. Esto se debe a que la mayoría de los pacientes con SHT grave mueren en los primeros días debido a la PIC incontrolable, que conduce al cese de la perfusión cerebral y, por tanto, a la muerte cerebral. En tales situaciones, se plantea la cuestión de la donación de órganos, que debe discutirse con los familiares -de acuerdo con la presunta voluntad del paciente- porque los pacientes jóvenes rara vez tienen un testamento vital o una tarjeta de donante de órganos. Así, el equipo de cuidados intensivos se enfrenta a un gran reto a la hora de elegir la intensidad del tratamiento. Los ancianos y las personas mayores sufren con mayor frecuencia un SHT grave y, debido a las limitadas reservas orgánicas relacionadas con la edad y a la falta de potencial de rehabilitación, la cuestión de la intensidad del tratamiento se plantea de forma bastante explícita. Especialmente con este tipo de lesiones, la máxima “supervivencia a toda costa” es un consejo equivocado. Las secuelas neurológicas son a menudo tan graves que el objetivo de la terapia médica intensiva debe modificarse de acuerdo con la presunta voluntad del paciente, lo que conduce a una terapia paliativa.
En la mayoría de los casos, los pacientes tras un TCE grave presentan minusvalías cognitivas, motoras, sensoriales, psicológicas y, por tanto, sociales, de diversos grados, que deben ser observadas y tenidas en cuenta por quienes les proporcionan un tratamiento de seguimiento. Por lo tanto, cada paciente debe recibir un tratamiento de seguimiento individualizado y centrado en el paciente.
Enlaces útiles:
www.braintrauma.org
www.snacc.org
www.dgnc.de
www.pebita.ch
www.swissneurosurgery.ch
www.swissneuro.ch
www.awmf-online.de
Literatura:
- The Brain Trauma Foundation: Asociación Americana de Cirujanos Neurológicos; Congreso de Cirujanos Neurológicos: Directrices para el tratamiento de lesiones cerebrales traumáticas graves. J Neurotrauma 2007; 24(Suppl 1): S1-S106.
- Maas AI, et al: Directrices EBIC para el tratamiento de traumatismos craneoencefálicos graves en adultos. Consorcio Europeo sobre Daño Cerebral. Acta Neurochir (Viena) 1997; 139(4): 286-294.
- Grände PO: El “concepto Lund” para el tratamiento de traumatismos craneoencefálicos graves – principios fisiológicos y aplicación clínica. Intensive Care Med 2006; 32(10): 1475-1484.
- Welling KL, Eskesen V, Romner B, El Comité Danés de Neurotrauma: Cuidados neurointensivos de la lesión cerebral traumática grave. Ugeskr Laeger 2010; 172: 2091-2094.
- Menon DK: Protección cerebral en lesiones cerebrales graves: determinantes fisiológicos del resultado y su optimización. Br Med Bull 1999; 55(1): 226-258.
- Sundstrøm T, et al.: Tratamiento de la lesión cerebral traumática grave. Pruebas, trucos y escollos. Springer 2012. ISBN 978-3-642-28125-9.
- Gerber LM, et al: Marcada reducción de la mortalidad en pacientes con lesión cerebral traumática grave. J Neurosurg 2013; 119: 1583-1590.
- Walder B, et al.: Lesiones cerebrales traumáticas graves en un país de renta alta: un estudio epidemiológico. Revista de Neurotrauma 2013; 30: 1934-1942.
- Chesnut RM, et al: Un ensayo de monitorización de la presión intracraneal en lesiones cerebrales traumáticas. New England Journal of Medicine 2012; 367(26): 2471-2481.
- Maas AI, Stocchetti N, Bullock R: Lesión cerebral traumática moderada y grave en adultos. Lancet Neurol 2008; 7(8): 728-741.
- Colaboradores del ensayo CRASH: Effects of intravenous corticosteroids on death within 14 days in 1008 adults with clinically significant head injury (MRC CRASH trial): randomised placebo-controlled trial. Lancet 2004; 364: 1321-1328.
- Colaboradores del ensayo CRASH: Final results of MRC CRASH: a randomised placebo-controlled trial of intravenous corticosteroid in adults with head injury-outcomes at 6 months. Lancet 2005; 365: 1957-1959.
- Cooper DJ, et al. para los investigadores del ensayo DECRA y el grupo de ensayos clínicos de la sociedad australiana y neozelandesa de cuidados intensivos: Decompressive craniectomy in diffuse traumatic brain injury. New England Journal of Medicine 2011; 364(16): 1493-1502.
- Stubbe H, Wölfler J: Traumatismo craneoencefálico en adultos. Medicina Intensiva up2date 2012; 8: 253-269.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2015; 13(2): 10-14











