El uso del inhibidor del VEGF bevacizumab mejora el resultado de los pacientes con cáncer colorrectal metastásico independientemente de la quimioterapia elegida. Datos recientes sugieren que la duración de la inhibición del VEGF desempeña un papel importante en el resultado del tratamiento.
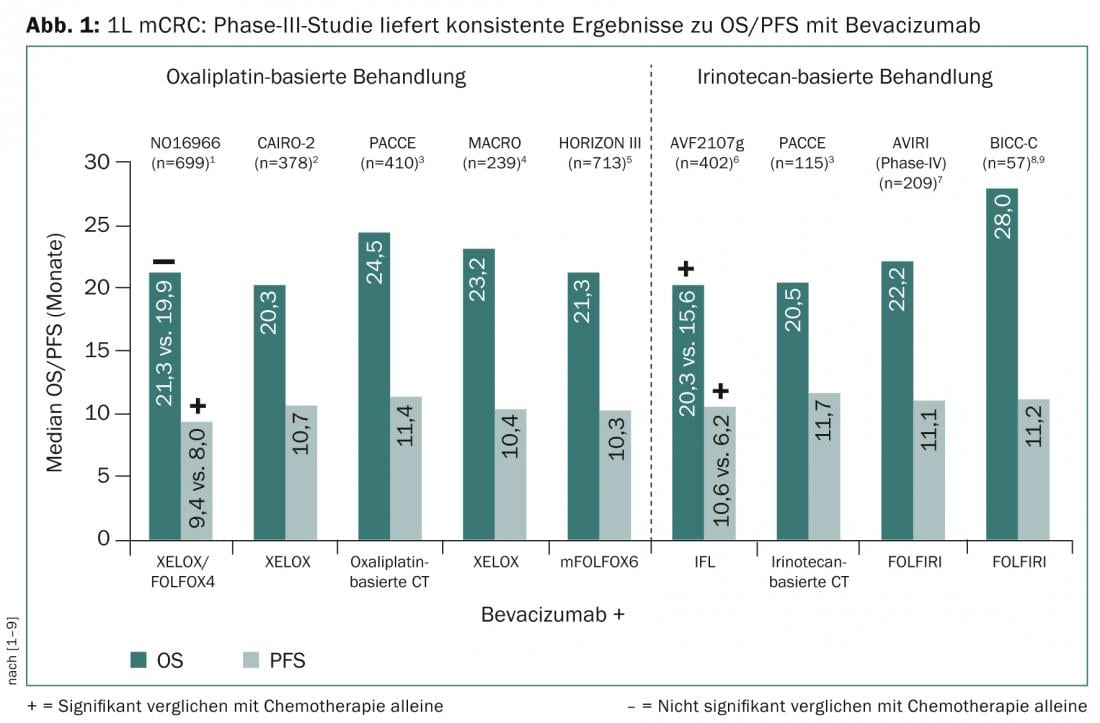
La posibilidad de reducir el tamaño de las metástasis primarias irresecables y maximizar el tiempo de supervivencia son algunos de los objetivos terapéuticos del cáncer colorrectal metastásico (CCRm). En estudios sobre el tratamiento de primera línea del CCRm, el uso del inhibidor del factor de crecimiento endotelial vascular (FCEV) bevacizumab a la quimioterapia combinada basada en oxaliplatino o irinotecán mostró sistemáticamente una supervivencia libre de progresión (SLP) de 10-12 meses y una prolongación de la supervivencia global (SG) de 22-28 meses (Fig. 1).
El estudio AVEX [10] proporcionó buenas razones para el uso del inhibidor del VEGF como monoterapia en el mCRC sin tratamiento. Esto demostró que bevacizumab más capecitabina condujo a un aumento significativo de la SLP en comparación con la capecitabina sola (9,1 meses frente a 5,1; HR: 0,53; p<0,0001). “Se trata de un gran paso adelante y de una buena razón para combinar terapias menos intensivas, en particular con un inhibidor del VEGF”, afirmó el Dr. Dirk Arnold, director del Centro de Biología Tumoral de Friburgo de Brisgovia. en la 2ª Conferencia sobre Cáncer Gastrointestinal de la EORTC St. El experto respondió a la pregunta sobre el uso de inhibidores del VEGF en una combinación triple basándose en los resultados del TRIBE, un estudio de fase III que comparó el bevacizumab en combinación con FOL-FOXIRI (5-FU, ácido folínico, oxaliplatino, irinotecán) o con FOLFIRI (5-FU, ácido folínico, irinotecán) en el tratamiento de primera línea del CCRm irresecable [11]. Se produjo una mejora significativa de la SLP (12,2 frente a 9,7 meses; 0,73; p=0,0012) y de la tasa de respuesta (65 frente a 53%) con la combinación triple más bevacizumab. “El ensayo TRIBE muestra una tolerabilidad sorprendentemente buena y los mejores resultados de eficacia de todos los ensayos de fase III sobre el mCRC realizados hasta la fecha”, explicó el Prof. Arnold. La estrategia de triple terapia está respaldada por los datos del ensayo OLIVIA, que mostró, entre otras cosas, el doble de tasa de resección R0 (criterio de valoración secundario; 48,8 frente a 23,1) con FOLFOXIRI más bevacizumab en comparación con un régimen FOLFOX6 modificado más bevacizumab [12].
Los datos sobre el beneficio de los inhibidores del VEGF en la terapia de segunda línea proceden del ensayo E3200 de quimioterapia basada en oxaliplatino (FOLFOX) más bevacizumab, y del ensayo VELOUR de aflibercept como complemento del FOLFIRI [13,14]. Ambas estrategias mostraron una mejora significativa de la supervivencia global.
Las pruebas de que los inhibidores del VEGF deben utilizarse de forma continua en la terapia de primera y segunda línea proceden del ensayo TML. Esto había demostrado que la administración continua de bevacizumab más allá de la progresión de la combinación de quimioterapia de primera línea en combinación con la terapia de segunda línea mejoraba la supervivencia global de los pacientes [15]. Este enfoque está respaldado por los resultados del estudio BEBYP, así como por un subanálisis de VELOUR, en este caso con aflibercept [16,17]. Sin embargo, una comparación indirecta de los datos de los ensayos TML y VELOUR mostró que la adición de aflibercept provocó un aumento más significativo de los efectos secundarios relacionados con la quimioterapia, mientras que éstos no aumentaron con la continuación del bevacizumab [17]. Desde el año pasado, también se discute si el tratamiento con inhibidores del VEGF debe continuarse o interrumpirse durante el periodo libre de progresión como “terapia de mantenimiento”. Los resultados de fase III del ensayo CAIRO-3 presentados en ASCO GI en enero respaldan el tratamiento de extremo a extremo [18]. Los resultados del AIO 0207, cuyos resultados se presentarán en ASCO 2014, aportarán más información.
Fuente: “Biologicals in colorectal cancer – state of the art”, Roche Satellite Symposium at the2nd St. Gallen EORTC (European Organisation for Research and Treatment of Cancer) Gastrointestinal Cancer Conference (GICC) 2014, 7 de marzo de 2014, St.
Literatura:
- Saltz, et al: JCO 2008; 26(12): 2013-2019.
- Tol, et al: NEJM 2009; 360(6): 563-572.
- Hecht, et al: JCO 2009; 27(5): 672-680.
- Díaz-Rubio, et al: Oncologist 2012; 17(1):15-25.
- Schmoll, et al: JCO 2012; 30(29): 3588-3595.
- Hurwitz, et al: NEJM 2004; 350(23): 2335-2342.
- Sobrero, et al: Oncología 2009; 77(2): 113-119.
- Fuchs, et al: JCO 2008; 26(4): 689-690.
- Fuchs, et al: JCO 2007; 25(30): 4779-4786.
- Cunningham D, et al: Lancet Oncol 2013; 14(11): 1077-1085.
- Falcone A, et al: JCO 2013 (Suppl. abstr 3505).
- Bridgewater J, et al: Congreso Europeo del Cáncer 2013. Resumen 2159.
- Giantonio BJ, et al: JCO 2007; 25(12): 1539-1544.
- Van Cutsem E, et al: JCO 2012; 30(28): 3499-3506.
- Bennouna J, et al: Lancet Oncol 2013; 14(1): 29-37.
- Masi G, et al: Ann Oncol 2012; 23 (Suppl. 9): resumen LBA17.
- Carmen JA, et al: JCO 2012; 31 (Suppl. abstr 3505).
- Koopman M, et al: JCO 2013; 31 (Suppl. abstr 3502).
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(5): 30-31