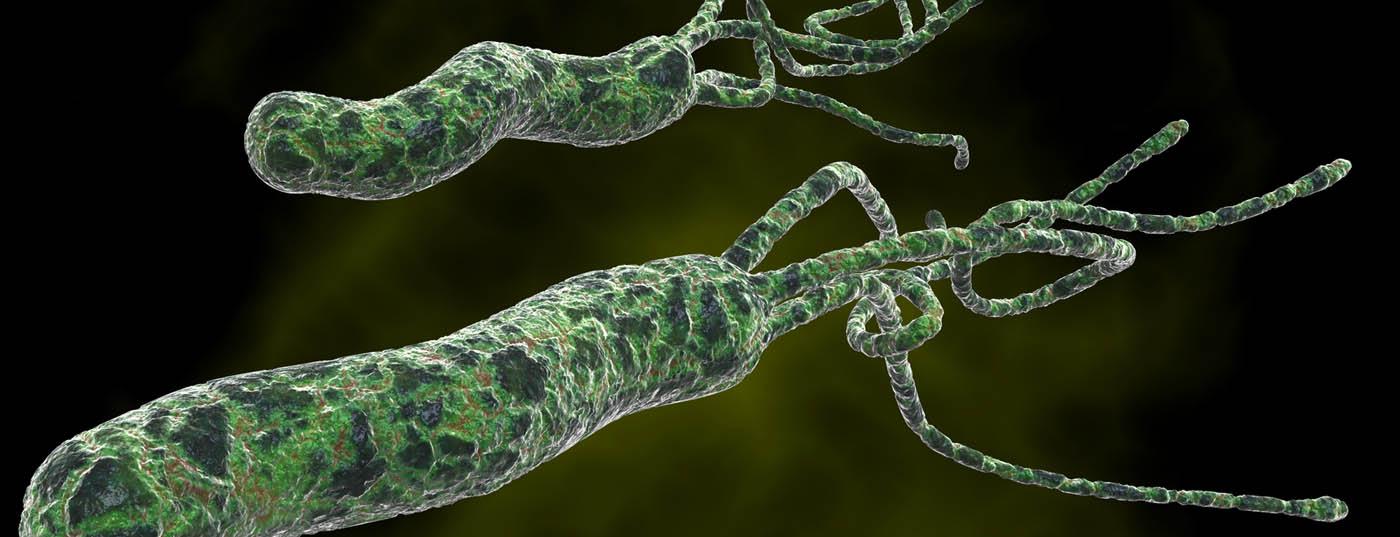
En la ASCO-GI de San Francisco, el doctor David Graham, del Baylor College of Medicine, hizo una presentación sobre la relación entre el Helicobacter pylori y el cáncer gástrico, en la que destacó la importancia de los programas de erradicación preventiva. Además, describió con detalle cómo se relacionan las bacterias con la patogénesis y ofreció una visión general de los avances más importantes en este sentido en los últimos años.
Según el doctor David Graham, de Houston, el Helicobacter pylori (H. pylori) es tan crítico en el cáncer gástrico porque se trata de un cáncer asociado a la inflamación, en el que ésta se debe a la infección crónica del estómago por esta especie bacteriana patógena. La inflamación inducida por H. pylori provoca daños progresivos y acumulativos en la mucosa gástrica, que se reflejan clínicamente en el aumento exponencial de la incidencia del cáncer gástrico (normalmente después de los 50 años). Más del 95% de estos cánceres se deben a la inflamación por H. pylori.
“Esta infección es una causa necesaria pero no suficiente en el cáncer gástrico. Los grandes avances en la comprensión de la fisiología, la histopatología y la microbiología gástricas condujeron a la primera relación entre el cáncer gástrico y la gastritis atrófica a finales del siglo XIX [1]”, explicó Graham. “Así pues, los investigadores posteriores tuvieron claro que debían buscar la causa de la gastritis para poder prevenir teóricamente el cáncer de estómago [2]. Después de que en 1951 se resumieran por primera vez los múltiples avances en este campo [3], siguió un largo periodo de sequía de 35 años hasta que se estableció con certeza que H. pylori era una de las causas más importantes de gastritis. Sin embargo, tuvieron que pasar casi otros treinta años para que Japón se convirtiera finalmente en el primer país en aprobar un programa integral de prevención del cáncer gástrico mediante la erradicación de H. pylori, consistente en un enfoque de prueba y tratamiento, en febrero de 2013 [4].”
Inestabilidad genética
Además de la inflamación, el contacto de H. pylori con las células epiteliales gástricas puede conducir directamente a la inestabilidad genética [5]. En la mayoría de los casos, una combinación de ambos efectos es la responsable del cáncer. Las inestabilidades asociadas al H. pylori se dan en todas las infecciones por H. pylori, incluidas las que no suponen un gran aumento del riesgo de cáncer gástrico (como la gastritis no atrófica o la úlcera duodenal). Normalmente, los mecanismos de reparación celular parecen ser capaces de responder adecuadamente a estos daños inducidos por H. pylori.
Dado que el cáncer gástrico se asocia a una pérdida de células epiteliales gástricas normales, sería interesante comparar los mecanismos de reparación de los distintos tipos de epitelios gástricos, según Graham: “Las pruebas de que el daño genético asociado al H. pylori desempeña un papel en la carcinogénesis proceden de un estudio de 544 pacientes con alto riesgo de desarrollar cánceres metacrónicos. Aquí, un seguimiento de 3 años demostró que la erradicación de 272 pacientes prevenía mejor la interacción entre H. pylori y las células gástricas y, por tanto, la progresión a carcinoma (9 frente a 24 en el grupo de control) [6].”
¿La erradicación como prevención segura?
La erradicación, según Graham, puede abordar la causa más fundamental del cáncer de estómago. No obstante, los efectos de un programa de este tipo no serán evidentes de inmediato, ya que en los países de alto riesgo sigue habiendo muchas personas en las que la gastritis ya ha progresado hasta el punto de que el riesgo de cáncer de estómago sigue siendo elevado a pesar de la erradicación. Aunque la erradicación detiene la progresión tanto del riesgo de cáncer como de los daños, algunos riesgos permanecen; después de todo, según Graham, algunos daños son irreversibles. La progresión también varía en los distintos individuos. Está influida por la fuerza de la respuesta inflamatoria del huésped, que a su vez está relacionada con factores genéticos, medioambientales y dietéticos.
Riesgo tras la erradicación
“¿Cuál es el riesgo tras la erradicación del H. pylori?”, se preguntó Graham. “Por supuesto, esto tiene que ver con la extensión y la gravedad de la gastritis atrófica en el momento de la erradicación: Por ejemplo, si se trata de una gastritis no atrófica, el riesgo es pequeño; si es una pangastritis atrófica, es alto [1]”.
Por lo tanto, en las regiones de alta incidencia, se recomienda realizar una estratificación del riesgo junto con la erradicación para identificar a los pacientes que podrían beneficiarse de la vigilancia del cáncer tras la erradicación. Esta estratificación, como ya se ha mencionado, se basa en la extensión y la gravedad de la gastritis atrófica (de forma no invasiva por cambios en los niveles séricos de pepsinógeno/gastrina, o por biopsia de la mucosa gástrica que indique atrofia) [7, 8]. Según Graham, el enfoque combina la prevención primaria (erradicación del H. pylori) y la secundaria (vigilancia endoscópica), identificando a los pacientes para los que resulta rentable continuar el seguimiento. Esta forma de estratificación ha sustituido a la basada en la edad.
“La mayoría de las veces, sólo un pequeño porcentaje de los tratados pertenecen al grupo de vigilancia [1]”, afirma Graham. “En conclusión, el H. pylori es un importante patógeno humano cuyos posibles efectos positivos han demostrado ser inútiles y que, por lo tanto, debe erradicarse. Queda por ver con qué frecuencia y durante cuánto tiempo debe llevarse a cabo la vigilancia y qué estrategias de reducción de riesgos deben considerarse: ¿Erradicación del H. pylori para todos? ¿Dieta (frutas y verduras frescas)? ¿Dejar de fumar? ¿Medicación (antiinflamatoria, gastroprotectora)? En cualquier caso, es urgente reflexionar sobre estas cuestiones”.
Fuente: Gastric Cancer – Etiology, Development, and Implication for Therapy, Sesión general 2 en ASCO GI – Gastrointestinal Cancers Symposium, 16-18 de enero de 2014, San Francisco
Literatura:
- Graham DY, Asaka M: Erradicación del cáncer gástrico y vigilancia más eficaz del cáncer gástrico en Japón: dos guisantes en una vaina. J Gastroenterol 2010; 45: 1-8.
- Massarrat S. Konjetzny: Un cirujano alemán del siglo pasado y su hipótesis pionera de una etiología bacteriana para la gastritis, la úlcera péptica y el cáncer gástrico. Z Gastroenterol 2005; 43: 411-413.
- Comfort MW: Acidez gástrica antes y después del desarrollo del cáncer gástrico: su importancia etiológica, diagnóstica y pronóstica. Ann Intern Med. 1951; 36: 1331-1348.
- Asaka M: Un nuevo enfoque para la eliminación de las muertes por cáncer gástrico en Japón. Int J Cancer 2013; 132: 1272-1276.
- Shiotani A, Cen P, Graham DY: La erradicación del cáncer gástrico es ahora posible y práctica. Semin Cancer Biol. 2013 (en prensa).
- Fukase K, et al: Efecto de la erradicación del Helicobacter pylori en la incidencia del carcinoma gástrico metacrónico tras la resección endoscópica del cáncer gástrico precoz: un ensayo controlado aleatorio abierto. Lancet 2008; 372: 392-397.
- Rugge M, et al: Estadificación de la gastritis en la práctica clínica: el sistema de estadificación OLGA. Gut 2007; 56: 631-636.
- Dinis-Ribeiro M, et al: Validez del cociente pepsinógeno sérico I/II para el diagnóstico de displasia epitelial gástrica y metaplasia intestinal durante el seguimiento de pacientes con riesgo de adenocarcinoma gástrico de tipo intestinal. Neoplasia 2004; 6: 449-456.
InFo Oncología y Hematología 2014; 2(3): 38-39