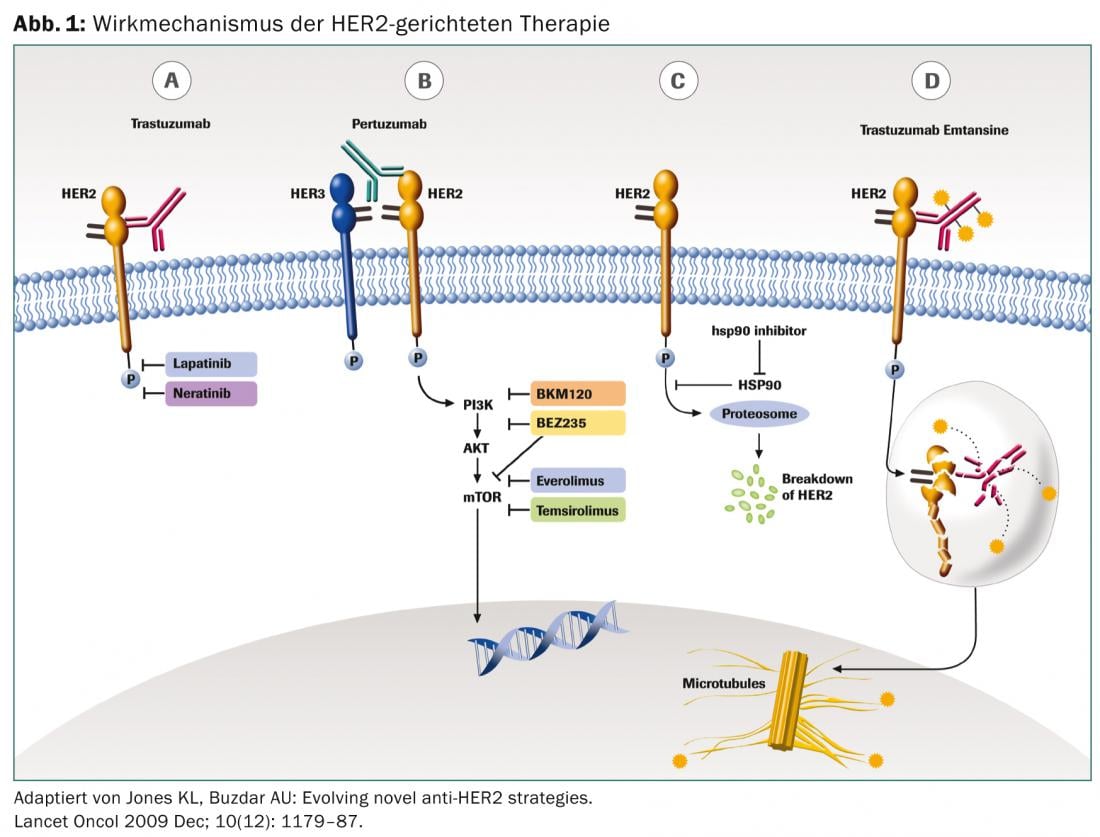
El receptor HER2 pertenece a la familia de cuatro receptores transmembrana tirosina quinasas (EGFR/HER1, HER2, HER3 y HER4) que influyen en el crecimiento, la diferenciación y la supervivencia de las células. La sobreexpresión de HER2 se da en aproximadamente el 20% de todos los cánceres de mama tempranos y se asocia a un curso más agresivo de la enfermedad y a un mal pronóstico. Sólo la introducción de sustancias específicas dirigidas contra el HER2 ha mejorado significativamente el pronóstico de las pacientes con cáncer de mama HER2-positivo.
La única sustancia aprobada para la fase inicial del carcinoma de mama es el anticuerpo monoclonal trastuzumab (Herceptin®), según la Conferencia Internacional de Consenso de St. Gallen [1]. Otras sustancias como el lapatinib (Tyverb®) y el pertuzumab (Perjeta®) se están probando actualmente en esta indicación en grandes ensayos internacionales. Éstos ya están aprobados en la situación metastásica, y el T-DM1 (Kadcyla®) es otra nueva opción terapéutica.
Trastuzumab
El anticuerpo monoclonal trastuzumab se dirige al dominio extracelular del receptor HER2. Como mediador de la citotoxicidad mediada por células dependientes de anticuerpos (ADCC), impide una mayor proliferación. La administración es intravenosa. La terapia suele tolerarse bien. La primera aplicación puede provocar una reacción relacionada con la infusión con fiebre, escalofríos y dolor articular, que puede tratarse bien con paracetamol. Se conoce la cardiotoxicidad acumulativa, por lo que se recomienda realizar una ecocardiografía antes de iniciar la terapia y a intervalos regulares a partir de entonces.
Lapatinib
El lapatinib, administrado por vía oral, inhibe de forma reversible los dominios tirosina quinasa de los receptores EGF (ErbB1) y ErbB2 (HER2). A diferencia del trastuzumab, la molécula lapatinib también es más pequeña, lo que podría explicar el mejor efecto sobre las metástasis cerebrales. Los efectos secundarios son principalmente síntomas gastrointestinales con diarrea, pérdida de apetito y náuseas, así como erupciones cutáneas, fatiga y hepatotoxicidad. También se ha descrito cardiotoxicidad acumulativa con lapatinib, por lo que se recomienda una monitorización adecuada.
Pertuzumab
El pertuzumab es también un anticuerpo monoclonal y se une específicamente al dominio de dimerización extracelular (subdominio II) del receptor HER2, mientras que el trastuzumab se une al dominio IV. De este modo, el pertuzumab bloquea la formación de heterodimerización dependiente de ligando de HER2 con otros miembros de la familia HER2, incluidos HER1, HER3 y HER4. Así, el pertuzumab se une a una región diferente del receptor HER2 que el trastuzumab, lo que da lugar a un efecto sinérgico. El perfil de efectos secundarios corresponde al del trastuzumab.
T-DM1
El trastuzumab emtansina es un conjugado de trastuzumab y el fármaco citostático mertansina, un inhibidor de la microtubulina. El anticuerpo se une específicamente a las células tumorales HER2-positivas, por lo que el fármaco citostático causa comparativamente poco efecto fuera de las manifestaciones tumorales. Esto también explica la buena tolerancia.
Se observan los siguientes efectos secundarios: Reacciones a la infusión con escalofríos y fiebre, hematotoxicidad con trombocitopenia en particular que requiere control y elevaciones de las enzimas hepáticas (ALT, AST).
Indicaciones
Antes de cualquier terapia, debe determinarse el estado HER2 mediante un examen inmunohistoquímico validado de la preparación tumoral. También puede examinarse en un bloque tumoral previamente extirpado. Sólo un resultado triple positivo se considera suficiente para la terapia anti-HER2 y, por tanto, positivo. En caso de duda (2+), también se determina la amplificación del gen HER2 mediante hibridación fluorescente in situ (FISH), que se considera positiva a partir de una proporción >2,2 y, por tanto, apta para la terapia dirigida.
Fase temprana – Tratamiento adyuvante
Por el momento, sólo se ha aprobado el trastuzumab, en combinación con quimioterapia. La aprobación se produjo tras la publicación del ensayo HERA en 2005, que demostró un beneficio significativo en la supervivencia libre de enfermedad y en la supervivencia global de las pacientes con cáncer de mama HER2-positivo que recibían tratamiento con trastuzumab durante un año. Tomar trastuzumab durante dos años no aumenta aún más su eficacia, como sabemos desde finales de 2012 [2]. Recientemente, también se mostraron los datos del estudio PHARE, que comparó la terapia de seis meses frente a la de un año de trastuzumab [3]. Este estudio fue negativo, resp. no cumplió el criterio de valoración primario de “no inferioridad”.
Según los datos de NOAH, el trastuzumab también se utiliza de forma neoadyuvante, es decir, preoperatoriamente en combinación con quimioterapia. La supervivencia libre de recaída a los 3 años fue significativamente mejor, del 71%, en comparación con el 56% tratadas sin trastuzumab [4].
La inmunoterapia adyuvante con trastuzumab suele iniciarse tras la quimioterapia que contiene antraciclinas (sin combinación debido a la posible cardiotoxicidad acumulativa ) y puede combinarse con quimioterapia que no contenga antraciclinas, terapia endocrina y radioterapia.
El lapatinib también se está probando actualmente en ensayos. Este año se publicó un estudio de fase III que comparaba el lapatinib con el trastuzumab y mostraba una supervivencia libre de progresión comparable con una toxicidad mayor [5].
Los datos de ALTTO, que también probaron esta cuestión y además una combinación de trastuzumab y lapatinib, están pendientes, y el brazo de lapatinib tuvo que cerrarse antes de tiempo. Esto se debe a que el brazo de lapatinib parece ser inferior al brazo de trastuzumab.
Por tanto, el tratamiento estándar actual en el contexto adyuvante para el cáncer de mama HER2-positivo incluye la inmunoterapia con trastuzumab durante un año.
Estadio avanzado, con metástasis
Existen varias opciones terapéuticas para el tratamiento de las pacientes con cáncer de mama HER2-positivo metastásico. Además de la terapia endocrina y la terapia citostática, la inmunoterapia es de gran importancia en este caso. En principio, a toda paciente con cáncer de mama HER2-positivo debería ofrecérsele una terapia dirigida adecuada.
Mientras que hasta hace unos años sólo se disponía de trastuzumab y lapatinib, el espectro de opciones terapéuticas ha vuelto a ampliarse en los últimos meses.
Terapia de primera línea: En 2001, Slamon publicó el primer gran estudio de fase III, que demostró una supervivencia libre de progresión significativamente mayor, una respuesta mejor y más prolongada, así como una ventaja de supervivencia para un tratamiento combinado con quimioterapia y trastuzumab [6]. También se demostró un beneficio en combinación con la terapia endocrina [7].
Un estudio de la SAKK (Asociación Suiza para la Investigación Clínica del Cáncer, www.sakk.ch) investiga si la monoterapia con trastuzumab es suficiente como primer tratamiento, seguido de la combinación con quimioterapia. Los resultados aún están pendientes. Hoy en día, el trastuzumab se utiliza sobre todo en primera línea en combinación con quimioterapia o, si la quimioterapia no parece adecuada, con terapia endocrina.
Los datos recientes del ensayo CLEOPATRA han demostrado que el docetaxel en combinación con trastuzumab y pertuzumab es superior al docetaxel y trastuzumab en términos de supervivencia sin progresión, así como de supervivencia global. Sin embargo, también debe aceptarse una mayor toxicidad, especialmente neutropenia febril y diarrea [8]. El pertuzumab está ahora autorizado por Swissmedic para esta indicación y también está sujeto a la cobertura obligatoria del seguro médico tras la aprobación previa de los costes.
De la terapia de segunda línea: A pesar del tratamiento dirigido, se produce una progresión de la enfermedad con trastuzumab debido al desarrollo de resistencia. Este desarrollo de resistencia se basa, entre otras cosas, en un cambio en el receptor HER2 y en la vía de señalización PI3K/Akt. Además, se produce una regulación al alza de HER3 o IGF1R [9]. Sin embargo, la terapia dirigida contra el HER2 debe continuarse según el consenso general (directrices de la ESMO) [10].
Una opción es continuar con el trastuzumab con un cambio de componente quimioterápico [11, 12]. Alternativamente, el lapatinib (en combinación con capecitabina) también está disponible a partir de la terapia de segunda línea [13]. La ventaja de esta combinación terapéutica es la aplicación oral con, sin embargo, una toxicidad mayormente aumentada (especialmente síndrome mano-pie, síntomas gastrointestinales). Además del lapatinib, actualmente también se utiliza el T-DM1 a partir de la segunda línea, que se comparó con la combinación de lapatinib y capecitabina y resultó superior tanto en términos de supervivencia global como de tolerabilidad [14]. Está aprobado en Suiza desde 2013, pero aún no está sujeto a la cobertura obligatoria del seguro médico y requiere la aprobación previa de los costes.
La mejor secuencia de tratamiento en la situación metastásica no está clara. El ensayo SAKK 22/10 está probando actualmente las nuevas sustancias pertuzumab y T-DM1. En la terapia de primera línea, se aleatoriza el bloqueo dual HER2 (trastuzumab y pertuzumab) con quimioterapia frente a sin quimioterapia. La T-DM1 se planea entonces como terapia de segunda línea.
Outlook
Ya se ha probado la aplicación subcutánea de trastuzumab [15], que puede ser un modo de aplicación nuevo y posiblemente atractivo en el futuro.
Actualmente se está investigando en grandes estudios internacionales si las nuevas sustancias también son eficaces en la situación adyuvante.
Además, se están probando nuevos inhibidores de la tirosina quinasa (TKI) perorales. En particular, el neratinib, un TKI EGFR-HER2 irreversible, parece prometedor.
MENSAJE PARA LLEVAR A CASA
- El pronóstico del cáncer de mama HER2-positivo puede mejorar significativamente con la inmunoterapia dirigida.
- En la fase inicial (adyuvante), el trastuzumab es la terapia estándar actual durante un total de un año.
- En la situación paliativa, la terapia dirigida contra el HER2 debe continuarse incluso después de la progresión. Además del trastuzumab y el lapatinib, existen nuevas opciones terapéuticas eficaces y bien toleradas con T-DM1 y pertuzumab.
A RETENIR
- Una inmunoterapia blanca puede mejorar sensiblemente el pronóstico del cáncer de mama HER2 positivo.
- La terapia estándar en el estadio previo (adyuvante) consiste actualmente en la administración de trastuzumab durante un año.
- En situación paliativa, la terapia anti-HER2 debe continuarse, incluso en caso de progresión. Además del trastuzumab y el lapatinib, el T-DM1 y el pertuzumab ofrecen nuevas opciones de tratamiento eficaces y bien toleradas.
Dr. Michael Schwitter
Literatura:
- Goldhirsch A, et al: Personalización del tratamiento de las mujeres con cáncer de mama precoz: aspectos destacados del Consenso internacional de expertos de St Gallen sobre la terapia primaria del cáncer de mama precoz 2013 Ann Oncol 2013 Sep; 24(9): 2206-23.
- Goldhirsch A, et al: 2 años frente a 1 año de trastuzumab adyuvante para el cáncer de mama HER2-positivo (HERA): un ensayo abierto, aleatorizado y controlado. Lancet 2013 Jul 17. pii: S0140-6736(13)61094-6.
- Pivot X, et al: 6 meses frente a 12 meses de trastuzumab adyuvante para pacientes con cáncer de mama precoz HER2-positivo (PHARE): un ensayo aleatorizado de fase 3. Lancet Oncol 2013 jul; 14(8): 741-8.
- Gianni L, et al: Quimioterapia neoadyuvante con trastuzumab seguida de trastuzumab adyuvante frente a quimioterapia neoadyuvante sola, en pacientes con cáncer de mama localmente avanzado HER2-positivo (el ensayo NOAH): un ensayo de superioridad aleatorizado y controlado con una cohorte paralela HER2-negativa. Lancet 2010 Ene 30; 375(9712): 377-84.
- Goss PE, et al: Lapatinib adyuvante para mujeres con cáncer de mama HER2-positivo en estadio temprano: un ensayo aleatorizado, controlado, de fase 3. Lancet Oncol 2013 Ene; 14(1): 88-96.
- Slamon DJ, et al: Uso de quimioterapia más un anticuerpo monoclonal contra HER2 para el cáncer de mama metastásico que sobreexpresa HER2. N Engl J Med 2001 Mar 15; 344(11): 783-92.
- Huober J, et al: Mayor eficacia del letrozol en combinación con trastuzumab en comparación con la monoterapia con letrozol como tratamiento de primera línea en pacientes con cáncer de mama metastásico HER2-positivo y con receptores hormonales positivos – resultados del ensayo eLEcTRA. Mama 2012; 21: 27-33.
- Swain SM, et al: Pertuzumab, trastuzumab y docetaxel para el cáncer de mama metastásico HER2-positivo (estudio CLEOPATRA): resultados de supervivencia global de un estudio de fase 3 aleatorizado, doble ciego y controlado con placebo. Lancet Oncol 2013 mayo; 14(6): 461-71.
- Wong AL, Lee SC: Mecanismos de resistencia al trastuzumab y estrategias terapéuticas novedosas en el cáncer de mama HER2 positivo. Int J Breast Cancer 2012; 2012: 415170.
- Cardoso F, et al: Cáncer de mama localmente recurrente o metastásico: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento. Ann Oncol 2012 oct; 23(7): vii11-9.
- von Minckwitz G, et al: Trastuzumab beyond progression in human epidermal growth factor receptor 2-positive advanced breast cancer: a German breast group 26/breast in-ternational group 03-05 study. J Clin Oncol 2009; 27: 1999-2006.
- Huober J, et al.: Tratamiento con trastuzumab más allá de la progresión en el cáncer de mama avanzado: pautas de atención en seis centros suizos de cáncer de mama. Oncología 2011; 81(3-4): 160-6.
- Geyer CE, et al: Lapatinib más capecitabina para el cáncer de mama avanzado HER2-positivo. N Engl J Med 2006; 355: 2733-2743.
- Verma S, et al: Trastuzumab emtansina para el cáncer de mama avanzado HER2-positivo. N Engl J Med 2012 Nov 8; 367(19): 1783-91.
- Ismael G, et al: Administración subcutánea frente a intravenosa de tras-tuzumab (neo)adyuvante en pacientes con cáncer de mama HER2-positivo, en estadio clínico I-III (estudio HannaH): un ensayo de fase 3, abierto, multicéntrico y aleatorizado. Lancet Oncol 2012 Sep; 13(9): 869-78.
InFo Oncología y Hematología 2014; (2)1: 5-7