La terapia intervencionista para la fibrilación auricular se basa en la eliminación del desencadenante y la modificación del sustrato. La modificación del sustrato se refiere a la creación de lesiones lineales en la aurícula izquierda y a la ablación focal en lugares con señales eléctricas auriculares fraccionadas complejas (CFAE). La recomendación de que la FA paroxística debe tratarse mediante la eliminación del gatillo y la fibrilación persistente mediante la creación adicional de lesiones lineales está siendo cuestionada por los nuevos métodos de diagnóstico que pueden localizar y cuantificar los cambios estructurales y eléctricos en las aurículas.
La fibrilación auricular es la arritmia más frecuente en la sociedad occidental. Los informes de despolarizaciones eléctricas focales en los filamentos musculares dentro de las venas pulmonares como desencadenantes de la fibrilación auricular por Haissaguerre fueron la base de la terapia intervencionista de la fibrilación auricular [1]. Utilizando la tecnología de catéter y diversas formas de energía (radiofrecuencia, frío, láser), estos filamentos musculares se seccionan endocárdicamente, aislando el gatillo del miocardio auricular. El aislamiento de las venas pulmonares se ha convertido en el tratamiento de elección para la FA paroxística, pero cada vez se realiza más para la FA persistente. Sin embargo, la tasa de éxito del tratamiento intervencionista de la fibrilación auricular no es satisfactoria. En los pacientes con fibrilación auricular paroxística, la tasa de éxito desciende del 80% al cabo de un año al 60% al cabo de cinco años, a pesar de las múltiples intervenciones y las constantes mejoras de la técnica y el método. Sólo alrededor del 40% de los pacientes con FA persistente siguen en ritmo sinusal al cabo de tres años [2]. Los mecanismos subyacentes de la fibrilación auricular, especialmente en la fibrilación auricular persistente, no están muy claros. Aunque las recurrencias en la FA paroxística pueden explicarse a menudo por lagunas en la línea de ablación, es probable que existan otros mecanismos para el desarrollo o el mantenimiento de la arritmia en una proporción de pacientes, sobre todo en aquellos con FA persistente.
El sustrato describe los cambios celulares y ultraestructurales en el miocardio auricular que, junto con el desencadenante en las venas pulmonares, constituye la base para el desarrollo o el mantenimiento de la arritmia. Las despolarizaciones focales ectópicas múltiples, la generación de múltiples “ondas” eléctricas que se propagan heterogéneamente por el miocardio auricular, los rotores, las excitaciones que dan vueltas rápidamente en un espacio reducido, pero también los mecanismos de reentrada funcionales sin presencia de cambios estructurales del miocardio se consideran responsables del mantenimiento de la fibrilación auricular [3–5]. Este artículo presenta una revisión de los nuevos avances para diferenciar con mayor precisión los cambios estructurales y eléctricos en los pacientes con fibrilación auricular.
Fibrilación auricular: desencadenante y sustrato
La explicación electrofisiológica del desarrollo y mantenimiento de la fibrilación auricular es el desencadenante y el sustrato. Los factores desencadenantes de la fibrilación auricular suelen ser prolongaciones musculares de la aurícula izquierda hacia las venas pulmonares [6]. Otras despolarizaciones focales que pueden fingirse como desencadenantes pueden encontrarse, por ejemplo, dentro del miocardio auricular o en las fibras musculares en la transición de la aurícula derecha a la vena cava superior. Los grupos de ganglios nerviosos se encuentran a menudo cerca de la unión de la aurícula izquierda con las venas pulmonares y pueden provocar despolarizaciones eléctricas de estas fibras musculares, iniciando la fibrilación auricular. Las influencias externas sobre el sistema nervioso autónomo (por ejemplo, cirugía, estrés) y sustancias nocivas como el alcohol, que pueden inducir la fibrilación auricular, también se consideran factores desencadenantes.
La fibrosis de la aurícula izquierda es la causa de la fibrilación auricular. Sin embargo, la definición de este tejido llamado sustrato es incoherente. La descripción aproximada de la fibrosis se basa en los cambios celulares y ultraestructurales de la musculatura auricular. La fibrilación auricular crónica provoca a su vez cambios electrofisiológicos, especialmente un acortamiento del periodo refractario de las células musculares, lo que a su vez favorece el mantenimiento de la fibrilación auricular.
La progresión clínica de la fibrilación auricular paroxística a persistente y finalmente a permanente debe reflejar estos cambios en la aurícula. Los pacientes con fibrilación auricular paroxística experimentan, por tanto, una fibrilación auricular debida a una actividad eléctrica espontánea de alta frecuencia en las venas pulmonares. En cuanto cesa la actividad eléctrica en las venas pulmonares, se produce la conversión a ritmo sinusal. Si la fibrilación auricular persiste, por definición durante siete días o más, se denomina fibrilación auricular persistente y se supone que los cambios en los músculos auriculares favorecen el mantenimiento de la fibrilación. Se desarrollan más desencadenantes y excitaciones circulares – rotores – que mantienen la fibrilación auricular. Durante las fases de ritmo sinusal, estos mecanismos se invierten, al menos parcialmente. Así, la fibrilación auricular promueve la fibrilación auricular y el ritmo sinusal promueve el ritmo sinusal [7–9]. Sobre esta base, se hicieron recomendaciones para el tratamiento de la FA mediante catéter: aislamiento de la vena pulmonar con creación de una línea de ablación circunferencial alrededor de ambos pares de venas pulmonares para la paroxística, y además lesiones lineales en la aurícula izquierda, o ablación de los desencadenantes fuera de la aurícula izquierda para la fibrilación persistente y permanente. La base de las lesiones lineales, con las que se pretende modificar el sustrato, se ha adoptado del tratamiento quirúrgico de la fibrilación auricular. En la llamada operación laberinto, la aurícula izquierda se corta y se sutura siguiendo un patrón específico. La cicatrización posterior, que era una barrera para los impulsos eléctricos, pudo interrumpir los impulsos eléctricos descoordinados.
Sin embargo, basándose en estudios recientes de diagnóstico por imagen en pacientes con fibrilación auricular, cabe preguntarse si la elección del tratamiento con catéter debe basarse en la presentación clínica. Generalmente se acepta el aislamiento de las venas pulmonares de la aurícula izquierda como base para la intervención con catéter. Sin embargo, quién se beneficia de las lesiones adicionales no está claro y en la práctica se lleva a cabo de forma muy diferente. Esta cuestión es importante entre otras cosas porque cualquier creación de una lesión lineal aumenta el riesgo de la intervención y conlleva un riesgo adicional de arritmia.
El sustrato de la fibrilación auricular
La fibrosis de los músculos auriculares se considera un sello distintivo de la remodelación estructural [10]. La proliferación de fibroblastos modifica la arquitectura celular. Las influencias externas como la isquemia, el estrés oxidativo y mecánico, así como los estímulos inflamatorios, provocan la proliferación y migración de fibroblastos y su diferenciación en miofibroblastos, que a su vez promueven la fibrosis mediante la producción de citoquinas y factores de crecimiento [11, 12]. La arquitectura celular alterada y las interacciones miocélula-fibroblasto modifican la velocidad de conducción, el potencial de membrana en reposo, la repolarización y la excitabilidad. Se desarrolla un sustrato arritmogénico con despolarizaciones espontáneas, aparición de rotores y mecanismos de reentrada y, por tanto, la base para el mantenimiento de la fibrilación auricular.
Curiosamente, la fibrosis auricular se observa no sólo en pacientes con fibrilación auricular y cardiopatía estructural, sino también en aquellos con “fibrilación auricular solitaria”; parece existir una correlación entre la cantidad de fibrosis auricular y la persistencia de la fibrilación [13, 14]. Los mecanismos por los que la fibrosis auricular mantiene la fibrilación auricular son objeto de una intensa investigación. Sería interesante que el clínico conociera el grado de fibrosis antes de una intervención con catéter para planificar la intervención en consecuencia (aislamiento de las venas pulmonares o lesiones lineales adicionales en función del grado de fibrosis o, en caso de fibrosis pronunciada, desaconsejar una intervención).
Tratamiento farmacológico
Los enfoques terapéuticos farmacológicos se basan en influir en la actividad o proliferación de los fibroblastos. En estudios experimentales, las estatinas y la inhibición del sistema renina-angiotensina-aldosterona (SRAA) mediante inhibidores de la ECA, antagonistas de los receptores de la angiotensina y de la aldosterona podrían influir favorablemente en el sustrato. Sin embargo, los datos clínicos son actualmente insuficientes para hacer recomendaciones generales. Sin embargo, el bloqueo del sistema RAAS, al menos en determinadas poblaciones de pacientes, es un enfoque interesante en el tratamiento farmacológico de la FA.
Evaluación no invasiva del sustrato auricular
Su tamaño permite una evaluación indirecta de la aurícula izquierda. Los métodos habituales para ello son la ecocardiografía transtorácica y la tomografía computarizada o la resonancia magnética (RM). Generalmente se asume que la fibrosis auricular aumenta con el incremento del tamaño de la aurícula izquierda.
Varios estudios han demostrado una mayor tasa de recurrencia tras el tratamiento de la fibrilación auricular con catéter en pacientes con un diámetro o volumen de la aurícula izquierda agrandados [15, 17]. Las limitaciones de este método son la disponibilidad de un ordenador y, sobre todo, de una tomografía por resonancia magnética en la consulta y la escasa sensibilidad del método. La IRM ofrece una ventaja decisiva sobre otros métodos, a saber, la visualización del tejido fibrótico.
Mientras que la mayoría de los pacientes con FA paroxística presentan una pequeña cantidad de fibrosis y los que padecen FA persistente tienen una mayor cantidad de fibrosis, la fibrosis auricular izquierda se encuentra de forma heterogénea en ambos grupos. Además, la tasa de recurrencia tras la ablación con catéter se correlaciona con el grado de fibrosis y los pacientes con fibrosis auricular izquierda se benefician de lesiones lineales adicionales. Sin embargo, la cantidad de fibrosis no se correlaciona con el volumen auricular [18]. Nuestras propias observaciones respaldan este enfoque. La determinación endocárdica del voltaje eléctrico del miocardio auricular (mapa de voltaje) mostró, por un lado, que el agrandamiento de la aurícula no se asocia necesariamente a zonas de voltaje disminuido y, por otro, que las zonas de “bajo voltaje” se encontraban en el 20% de los pacientes con fibrilación auricular paroxística y en la fibrilación auricular persistente sólo en el 35% de los casos(Fig. 1, datos no publicados).
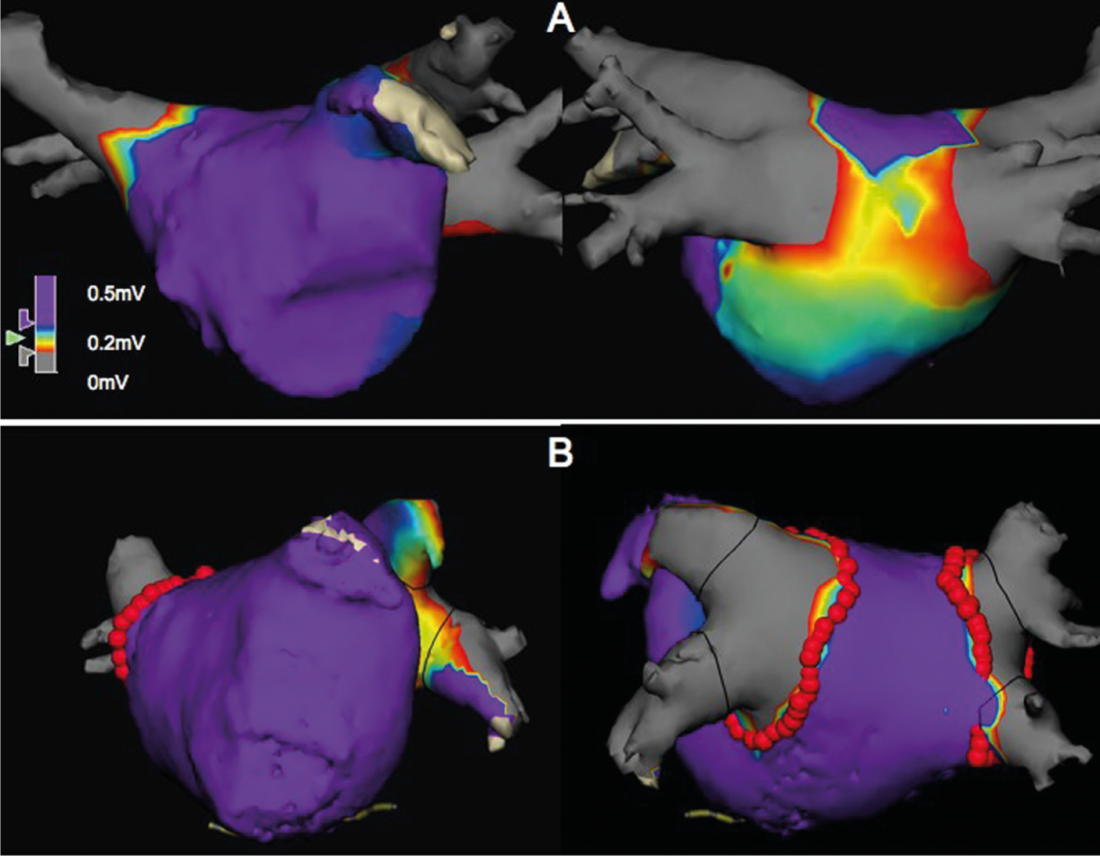
Fig. 1: Mapas bipolares de voltaje endocárdico de la aurícula izquierda, vista anteroposterior izquierda, posteroanterior derecha con 2 venas pulmonares derechas y 2 izquierdas y la orejuela auricular (vista anteroposterior). Las zonas en morado tienen una tensión eléctrica >0,5mV. La zona de verde a rojo tiene un voltaje de 0,2-0,5 mV y corresponde a una zona de “bajo voltaje”, lo que es coherente con la fibrosis. Las dos imágenes superiores muestran una zona de “bajo voltaje” extensa en la pared posterior en un paciente con FA paroxística, mientras que en las imágenes inferiores no se encontraron zonas de “bajo voltaje” en un paciente con FA persistente. Los puntos rojos representan la línea de ablación antral circunferencial.
Con la IRM de las aurículas, se podría aconsejar a los pacientes sobre las posibilidades de éxito y los riesgos esperados según la proporción de fibrosis, y el intervencionista podría planificar mejor la intervención, por ejemplo para evitar lesiones lineales en la FA persistente sin fibrosis relevante. Sin embargo, este método aún no está disponible para su uso rutinario.
La cartografía endocárdica de alta resolución de las aurículas mediante catéteres multipolares ha identificado rotores eléctricos estables que mantienen la fibrilación en pacientes con fibrilación auricular [19]. Se encontraron rotores y desencadenantes focales tanto en la aurícula izquierda como en la derecha, independientemente del tipo de fibrilación auricular (paroxística, persistente, de larga duración). La ablación por radiofrecuencia de tales rotores tuvo una probabilidad significativamente mayor de provocar la interrupción aguda o la ralentización de la FA y mostró una mayor libertad de recurrencia en comparación con el aislamiento convencional de la vena pulmonar [20]. Este hallazgo sugiere que los rotores eléctricos desempeñan un papel crucial en el mantenimiento de la fibrilación auricular.
Curiosamente, no se encontraron rotores estables en las zonas con electrogramas auriculares fraccionados complejos (CFAE) [21], cuya ablación, además del aislamiento de las venas pulmonares, se recomienda en pacientes con FA persistente.
Basándose en los hallazgos del mapeo intracardiaco, se intenta transferir la actividad eléctrica altamente compleja durante la fibrilación auricular a parámetros del ECG de superficie. Cabe preguntarse si esta información puede convertirse en un método no invasivo para la localización exacta y posterior ablación por radiofrecuencia de dichos rotores. Sin embargo, es posible hacer afirmaciones sobre el número y la localización en la aurícula derecha o izquierda, que hacen que una intervención sea planificable en cierto sentido [22].
Otro método no invasivo que se está probando actualmente es el “mapeo de la superficie corporal”. La actividad de la fibrilación auricular se mide a través de un gran número (>250) de electrodos de superficie corporal. La posición relativa de los electrodos se transfiere entonces a un tomograma informático de las aurículas. Tras procesar esta información eléctrica, el número y la localización de los rotores y las despolarizaciones focales se transfieren a la superficie de las aurículas. Los informes iniciales que utilizan este método para la ablación selectiva de gatillos y rotores son prometedores, pero aún deben probarse en poblaciones de pacientes más amplias [23].
Conclusiones
Actualmente no existe ningún método aplicable de forma rutinaria para diferenciar el sustrato auricular en pacientes con fibrilación auricular. Las estrategias terapéuticas intervencionistas anteriores se han basado en la suposición de un aumento de la fibrosis en la FA persistente y la consiguiente recomendación de producir lesiones lineales además de aislar las venas pulmonares. Los nuevos estudios son prometedores para caracterizar la localización y cuantificación del sustrato eléctrico, los rotores y las despolarizaciones eléctricas focales y permitir una ablación dirigida.
Es concebible que en el futuro el tratamiento de la FA mediante catéter sea individualizado, basándose en la presencia de tejido fibrótico o en la identificación de factores desencadenantes y rotores.
Dr. David Altmann
Literatura:
- Haissaguerre M, Jais P, Shah DC, et al: Iniciación espontánea de la fibrilación auricular por latidos ectópicos originados en las venas pulmonares. N Engl J Med 1998; 339: 659-666.
- Ganesan AN, Shipp NJ, Brooks AG, et al: Resultados a largo plazo de la ablación con catéter de la fibrilación auricular: revisión sistemática y metaanálisis. J Am Heart Assoc 2013; 2: e004549.
- Moe GK, Abildskov JA: La fibrilación auricular como arritmia autosostenida independiente de la descarga focal. Am Heart J 1959; 58: 59-70.
- Jalife J, Berenfeld O, Mansour M: Rotores madre y conducción fibrilatoria: un mecanismo de la fibrilación auricular. Cardiovasc Res 2002; 54: 204-216.
- Eckstein J, Verheule S, de Groot NM, Allessie M, Schotten U: Mecanismos de perpetuación de la fibrilación auricular en aurículas crónicamente dilatadas. Prog Biophys Mol Biol 2008; 97: 435-451.
- Cheung DW: Actividad eléctrica de la vena pulmonar y su interacción con la aurícula derecha en la cobaya. J Physiol 1981; 314: 445-456.
- Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA: La fibrilación auricular engendra fibrilación auricular. Un estudio en cabras despiertas crónicamente instrumentadas. Circulation 1995; 92: 1954-1968.
- Morillo CA, Klein GJ, Jones DL, Guiraudon CM: Estimulación auricular rápida crónica. Características estructurales, funcionales y electrofisiológicas de un nuevo modelo de fibrilación auricular sostenida. Circulation 1995; 91: 1588-1595.
- Kaseda S, Zipes DP: Retroalimentación contracción-excitación en las aurículas: una causa de los cambios en la refractariedad. J Am Coll Cardiol 1988; 11: 1327-1336.
- Burstein B, Nattel S: Fibrosis auricular: mecanismos y relevancia clínica en la fibrilación auricular. J Am Coll Cardiol 2008; 51: 802-809.
- Swynghedauw B: Mecanismos moleculares del remodelado miocárdico. Physiol Rev 1999; 79: 215-262.
- Weber KT, Sun Y, Tyagi SC, Cleutjens JP: Red de colágeno del miocardio: función, remodelación estructural y mecanismos reguladores. J Mol Cell Cardiol 1994; 26: 279-292.
- Boldt A, Wetzel U, Lauschke J, et al: Fibrosis en el tejido auricular izquierdo de pacientes con fibrilación auricular con y sin valvulopatía mitral subyacente. Corazón 2004; 90: 400-405.
- Frustaci A, Chimenti C, Bellocci F, Morgante E, Russo MA, Maseri A: Sustrato histológico de las biopsias auriculares en pacientes con fibrilación auricular solitaria. Circulation 1997; 96: 1180-1184.
- den Uijl DW, Tops LF, Delgado V, et al: Effect of pulmonary vein anatomy and left atrial dimensions on outcome of circumferential radiofrequency catheter ablation for atrial fibrillation. Am J Cardiol 2011; 107: 243-249.
- Berruezo A, Tamborero D, Mont L, et al: Predictores preprocedimiento de la recurrencia de la fibrilación auricular tras la ablación circunferencial de la vena pulmonar. Eur Heart J 2007; 28: 836-841.
- Shin SH, Park MY, Oh WJ et al. El volumen auricular izquierdo es un factor predictivo de la recurrencia de la fibrilación auricular tras la ablación con catéter. J Am Soc Echocardiogr 2008; 21: 697-702.
- Akoum N, Daccarett M, McGann C, et al: La fibrosis auricular ayuda a seleccionar al paciente y la estrategia adecuados en la ablación con catéter de la fibrilación auricular: un enfoque guiado por RMN. J Cardiovasc Electrophysiol 2011; 22: 16-22.
- Shivkumar K, Ellenbogen KA, Hummel JD, Miller JM, Steinberg JS: Terminación aguda de la fibrilación auricular humana mediante la identificación y ablación con catéter de rotores y fuentes localizados: primera experiencia multicéntrica de la ablación con modulación de impulsos focales y rotores (FIRM). J Cardiovasc Electrophysiol 2012; 23: 1277-1285.
- Narayan SM, et al: Treatment of atrial fibrillation by the ablation of localized sources: CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. J Am Coll Cardiol 2012; 60: 628-636.
- Narayan SM, et al: La cartografía electrofisiológica panorámica, pero no la morfología de los electrogramas, identifica las fuentes estables de la fibrilación auricular humana: los rotores de fibrilación auricular estable y las fuentes focales se relacionan mal con los electrogramas fraccionados. Circ Arritmia Electrofisiol 2013; 6: 58-67.
- Jones AR, Krummen DE, Narayan SM: Identificación no invasiva de rotores estables y fuentes focales de la fibrilación auricular humana: clasificación mecanicista de la fibrilación auricular a partir del electrocardiograma. Europace 2013.
- Haissaguerre M, et al.: Cartografía panorámica no invasiva de los mecanismos de la fibrilación auricular humana: Un informe de viabilidad. J Cardiovasc Electrophysiol 2012 doi: 10.1111/jce.12075. [Epub ahead of print]