El siguiente artículo pretende ofrecer una visión general de los síntomas no motores (SNM) más comunes en la EP, cómo se diagnostican y cómo se tratan, especialmente porque algunos son tratables y su mejoría tiene un impacto significativo en la calidad de vida de los pacientes. La apatía puede responder a la terapia dopaminérgica. En el caso de la depresión, el tratamiento debe ser principalmente con terapia dopaminérgica y después, preferiblemente, con agonistas dopaminérgicos con afinidad por el receptor D3. La terapia para las psicosis y los trastornos del control de los impulsos consiste inicialmente en reducir la medicación responsable. La demencia puede verse influida positivamente por la terapia con inhibidores de la colinesterasa. Dado que la dopamina desempeña un papel en el ciclo sueño-vigilia, los trastornos del sueño también pueden responder a la terapia dopaminérgica. La optimización y el uso de analgésicos ayudan con el dolor. La estimulación cerebral profunda también puede mejorar los síntomas no motores.
Los síntomas no motores (SNM) aparecen en el curso de la enfermedad de Parkinson en casi todos los pacientes [1]. Se trata de un amplio espectro de síntomas que a menudo limitan la calidad de vida más que los síntomas motores y a los que la persona afectada, los cuidadores y los médicos no suelen prestar suficiente atención [2, 3]. Como consecuencia, también están infradiagnosticados e infratratados, y algunos de los síntomas se consideran un efecto adverso de la terapia dopaminérgica.
En general, los síntomas no motores son más frecuentes en la EP avanzada, pero algunos, como la hiposmia, el trastorno del comportamiento del sueño REM, el estreñimiento y la depresión, pueden preceder a la EP motora en varios años [4]. En la actualidad está bien establecido que los NMS como la depresión o los trastornos del sueño, pero sobre todo el número total de NMS, reducen significativamente la calidad de vida de los pacientes con EP [3, 4]. La fisiopatología es compleja y puede distinguirse entre síntomas dopaminérgicos y no dopaminérgicos; es probable que también estén implicadas conexiones serotoninérgicas y noradrenérgicas. Según el concepto de una patología de cuerpos de Lewy ascendente en seis etapas iniciado por Braak y colaboradores a partir de autopsias [5], que comienza en el bulbo olfatorio y los núcleos inferiores del tronco encefálico, algunos de los NMS parecen explicarse como síntomas premotores (Fig. 1).

Las pruebas histológicas de α-sinucleína en los núcleos parasimpáticos sacros, los ganglios simpáticos y en el plexo nervioso entérico también apoyan la hipótesis de una patología ascendente, pero también sistémica. La tríada clásica de síntomas motores puede asignarse a los estadios tres y cuatro con afectación de la sustancia negra.
La tabla 1 ofrece una visión general del amplio espectro de NMS.

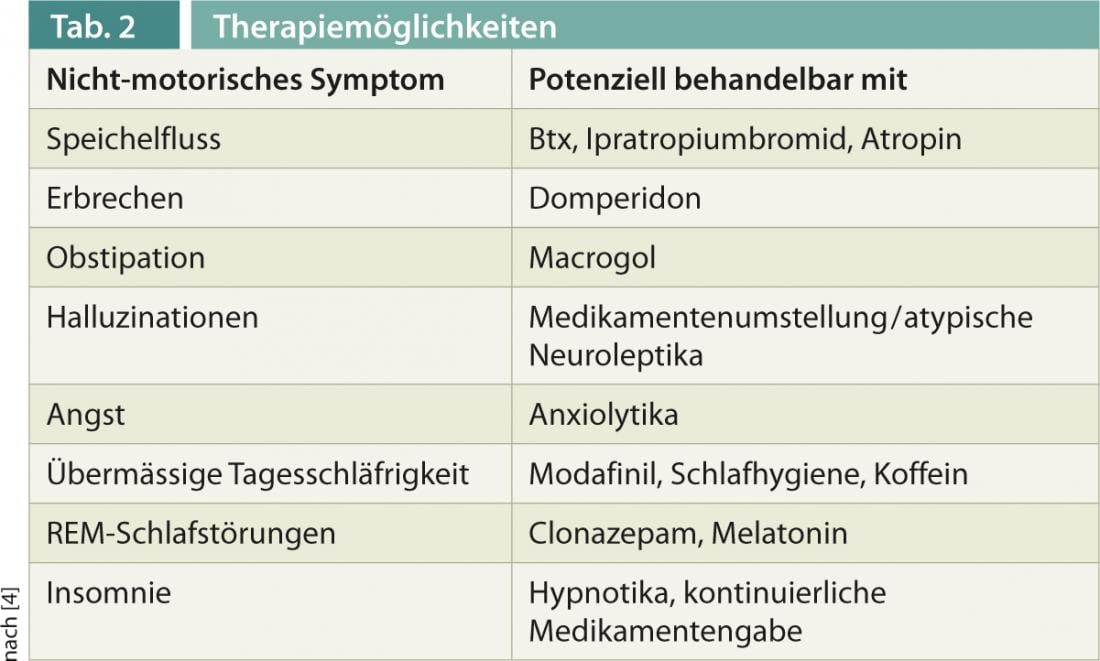
Para la exploración y documentación de los SNM, en los últimos años se han establecido diversas escalas, como la Escala de Síntomas No Motores (NMSS), o cuestionarios para preguntas específicas, como la Escala de Sueño de la Enfermedad de Parkinson (PDSS-2). Para algunos síntomas, existen actualmente terapias bien probadas, que se presentan a continuación y también en la tabla 2 .
Apatía, depresión y psicosis
Los síntomas neuropsiquiátricos tienen un impacto significativo en la calidad de vida, y los pacientes con EP no dominante por temblor presentan un mayor riesgo de deterioro cognitivo, depresión, apatía y alucinaciones [4].
La apatía es un problema específico de la enfermedad de Parkinson y puede responder a la terapia dopaminérgica, en particular a la administración de agonistas dopaminérgicos.
La depresión puede preceder a los síntomas motores y no existe correlación entre la depresión y la gravedad del síndrome de Parkinson motor. Los agonistas dopaminérgicos con una clara afinidad por el receptor D3, en este caso especialmente el pramipexol y el ropinirol, parecen ser superiores a otros agonistas dopaminérgicos en cuanto a su efecto antidepresivo. Como paso siguiente, pueden utilizarse los ISRS y los IRSN, bastante más recientes, y también se consideran aquí los antidepresivos más nuevos, como la mirtazapina, la reboxetina y la venlafaxina, a pesar de las pruebas aún limitadas [6].
La psicosis es una de las complicaciones no motoras más incapacitantes de la enfermedad de Parkinson. Las alucinaciones visuales pueden preceder o acompañar al deterioro cognitivo y se consideran una señal de advertencia del desarrollo de demencia en la EP [4]. La terapia, tras descartar otros factores desencadenantes como infecciones o trastornos metabólicos, consiste en primer lugar en reducir o suspender los fármacos responsables (por orden: anticolinérgicos, antidepresivos, amantadina, agonistas dopaminérgicos, inhibidores de la MAO-B y, por último, inhibidores de la COMT y levodopa) y después la administración de neurolépticos atípicos como la clozapina o también la quetiapina, por lo que sólo la clozapina está aprobada para esta indicación.
Demencia, control de impulsos y Trastornos del sueño
La prevalencia de la demencia en los pacientes con EP es del 30-40%. La edad se considera el principal factor de riesgo para desarrollar demencia, más que la duración de la enfermedad. En primer lugar, deben suspenderse los fármacos que puedan provocar un deterioro cognitivo; en un segundo paso, se utilizan inhibidores de la colinesterasa, siendo los datos más convincentes los de la rivastigmina, que está aprobada para la demencia de Parkinson de leve a moderada [4].
Los trastornos del control de los impulsos, como el juego patológico, la alimentación, las compras o incluso la hipersexualidad, no suelen notificarse, también por vergüenza, y se dan con mayor frecuencia en asociación con los agonistas dopaminérgicos, así como en los hombres. Los médicos tratantes deben preguntar activamente sobre estos síntomas, porque si se pasan por alto los trastornos del control de los impulsos, pueden surgir graves problemas permanentes en las relaciones y también dificultades financieras. La terapia consiste en la reducción inmediata o la interrupción de los agonistas dopaminérgicos en particular.
Los trastornos del sueño pueden presentarse de muchas formas (Tab. 1), son un problema muy común y a menudo grave y pueden tener diversas causas. Dado que la dopamina desempeña un papel en el ciclo sueño-vigilia, algunos trastornos del sueño en la EP pueden responder a una terapia dopaminérgica optimizada. Esto se demostró, por ejemplo, en el caso de la rotigotina transdérmica, que produjo una mejora significativa tanto de las alteraciones motoras matutinas como de las alteraciones del sueño, registradas con la PDSS-2 [7]. Cuando se utilicen agonistas dopaminérgicos, debe prestarse atención a los posibles efectos secundarios de aumento de la somnolencia diurna y ataques repentinos de insomnio, que pueden hacer necesaria una reducción de la dosis o incluso su interrupción [8]. El trastorno del comportamiento durante el sueño REM se caracteriza por la representación de sueños (a menudo pesadillas) debido a la falta de atonía muscular durante el sueño REM. El tratamiento farmacológico consiste en el uso de clonazepam por la noche [9]. Para el tratamiento del síndrome de las piernas inquietas se utilizan principalmente agonistas dopaminérgicos, alternativamente, dependiendo de la gravedad, gabapentina o pregabalina, en casos graves también opioides [10]. Un componente importante en el tratamiento de todos los trastornos del sueño sigue siendo siempre el mantenimiento de una buena higiene del sueño (horarios regulares de sueño y vigilia, tiempo adecuado en la cama, es decir, normalmente no más de 8 horas). Deben descartarse otras causas tratables de trastornos del sueño, como el síndrome de apnea obstructiva del sueño.
Dolor
El dolor es un síntoma común en los pacientes con EP y puede tener muchas causas diferentes (musculoesquelético, secundario a la distonía, central, radicular, neuropático). El ajuste de la terapia dopaminérgica puede conducir a una mejoría; en un siguiente paso, debe considerarse el uso de analgésicos, dependiendo de la causa.
Además de las fluctuaciones motoras, la estimulación cerebral profunda (ECP) en el núcleo subtalámico mejora la gravedad y las fluctuaciones de los síntomas no motores, como las alteraciones sensoriales, el dolor, la urgencia urinaria, la disautonomía y los trastornos del sueño. Las molestias gastrointestinales también se alivian, lo que conlleva una notable mejora general de la calidad de vida un año después del THS [11].
Relevancia para las terapias neuroprotectoras
Especialmente de cara a posibles terapias neuroprotectoras en el futuro, un diagnóstico precoz que tenga en cuenta las NMS mencionadas podría ser clínicamente muy relevante [10]. La atención, la investigación y la terapia de la NMS en la enfermedad de Parkinson serán cada vez más relevantes.
Dr. Stephan Nitschke
Prof. Dra. med. Barbara Tettenborn
Dr. Stefan Hägele-Link
Literatura:
- Barone P, et al: El estudio PRIAMO: una evaluación multicéntrica de los síntomas no motores y su impacto en la calidad de vida en la enfermedad de Parkinson. Mov Disord 2009; 24(11): 1641-1649.
- Chaudhuri KR, et al: La no declaración de los síntomas no motores de la enfermedad de Parkinson a los profesionales sanitarios: un estudio internacional mediante el cuestionario de síntomas no motores. Mov Disord 2010; 25 (6): 704-709.
- Chaudhuri KR, et al: Enfermedad de Parkinson: los problemas no motores. Parkinsonism Relat Disord 2011 dic; 17(10): 717-723.
- Chaudhuri KR, et al: Manual de síntomas no motores en la enfermedad de Parkinson. Springer 2011.
- Braak H, et al: Estadificación de la patología cerebral relacionada con la enfermedad de Parkinson esporádica. Neurobiol Aging 2003; 24 (2): 197-211.
- Directrices de la DGN, septiembre de 2012.
- Trenkwalder C, et al.: Rotigotine effects on early morning motor function and sleep in Parkinson’s disease: a double-blind, randomised, placebo-controlled study (RECOVER). Mov Disord 2011, 26(1): 90-99.
- Maass A, et al: Sueño y síntomas no motores en la enfermedad de Parkinson. J Neural Transm 2013 abr; 120(4): 565-569.
- Aurora RN, et al: Guía de buenas prácticas para el tratamiento del trastorno de conducta del sueño REM (RBD). J Clin Sleep Med 2010; 6(1): 85-95.
- Garcia-Borreguero D, et al.: Directrices europeas sobre el tratamiento del síndrome de las piernas inquietas: informe de un grupo de trabajo conjunto de la Federación Europea de Sociedades Neurológicas, la Sociedad Neurológica Europea y la Sociedad Europea de Investigación del Sueño. Eur J Neurol 2012; 19(11): 1385-1396.
- Steigerwald F, Volkmann J: Estimulación cerebral profunda (ECP) en la enfermedad de Parkinson: Comprobación de la indicación de la ECP ya en las primeras fluctuaciones del efecto. InFoNeurología&Psiquiatría 2013; 15(5): 38-45.











