La ablación con catéter de la fibrilación auricular paroxística sintomática es una modalidad de tratamiento establecida con buenas perspectivas de éxito y bajo riesgo. El aislamiento de las venas pulmonares sigue siendo la base del éxito de la ablación con catéter. Sin embargo, en una proporción de pacientes con fibrilación auricular se encuentra una enfermedad auricular fibrótica independiente, que proporciona el sustrato para el mantenimiento de la fibrilación auricular. Esto se aplica en particular (pero no exclusivamente) a los pacientes con fibrilación auricular persistente. Este conocimiento ha allanado el camino a conceptos de ablación individualizados para lograr la estabilización a largo plazo del ritmo sinusal incluso en esta población de pacientes tan difícil. El tratamiento específico de los “moduladores” de la fibrilación auricular (es decir, los factores favorecedores como la hipertensión arterial, la obesidad, la apnea del sueño, la diabetes, etc.) deberá realizarse en el futuro de forma interdisciplinar.
La ablación con catéter de la fibrilación auricular (FA) se ha convertido en un procedimiento rutinario con buenos resultados clínicos. Las tasas de éxito a largo plazo son actualmente del 80-90% para la fibrilación auricular paroxística (FAP) y del 50-60% para la fibrilación auricular persistente (FAPP) [1,2].
La ablación con catéter puede mejorar significativamente la calidad de vida de los pacientes. Además, los estudios no sólo demuestran la superioridad de la ablación con catéter sobre los fármacos antiarrítmicos en lo que respecta a la recurrencia de la FVC, sino que ahora también aportan pruebas de que la ablación puede influir en el pronóstico del ictus isquémico y la mortalidad [3].
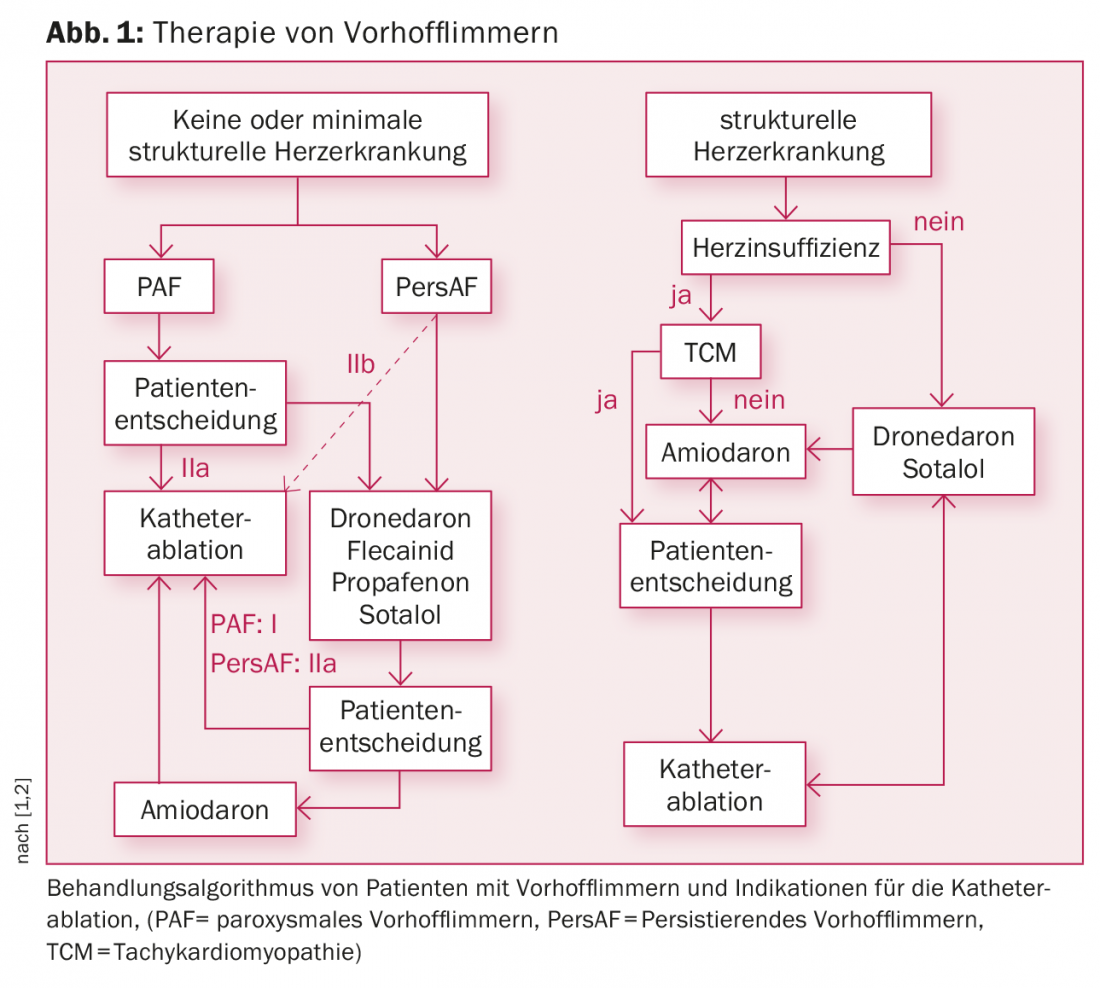
Dependiendo de si se utilizan o no fármacos antiarrítmicos previamente, las directrices actuales enumeran una indicación de clase I o IIa para la PAF y una indicación de clase IIa o IIb para la persAF (Fig. 1) [1,2]. Especialmente para la FAP, la ablación con catéter ya se utiliza como terapia de primera línea.
La fisiopatología de la FVC no valvular ha sido objeto de una intensa investigación en los últimos años, y nuestro conocimiento del trasfondo fisiopatológico se ha ampliado considerablemente.
El papel de los desencadenantes
Haissaguerre y colaboradores describieron por primera vez el papel de los desencadenantes de las venas pulmonares (VP) en el inicio de la FVC hace casi dos décadas [4]. Esta observación sentó las bases para el desarrollo del aislamiento de las venas pulmonares (AVP) como estrategia de tratamiento potencialmente curativa. Desde entonces, ésta ha sido la piedra angular de la ablación con catéter de la FVC. En raras ocasiones, los desencadenantes ajenos a la PV desempeñan un papel en el inicio. Algunas de estas últimas pueden originarse en la orejuela auricular izquierda, el seno coronario o el tabique interauricular.
El aislamiento de la vena pulmonar
El IVP es una parte integral de cualquier ablación con catéter de la FVC y puede lograrse utilizando diversas herramientas y técnicas (Fig. 2 A-C).
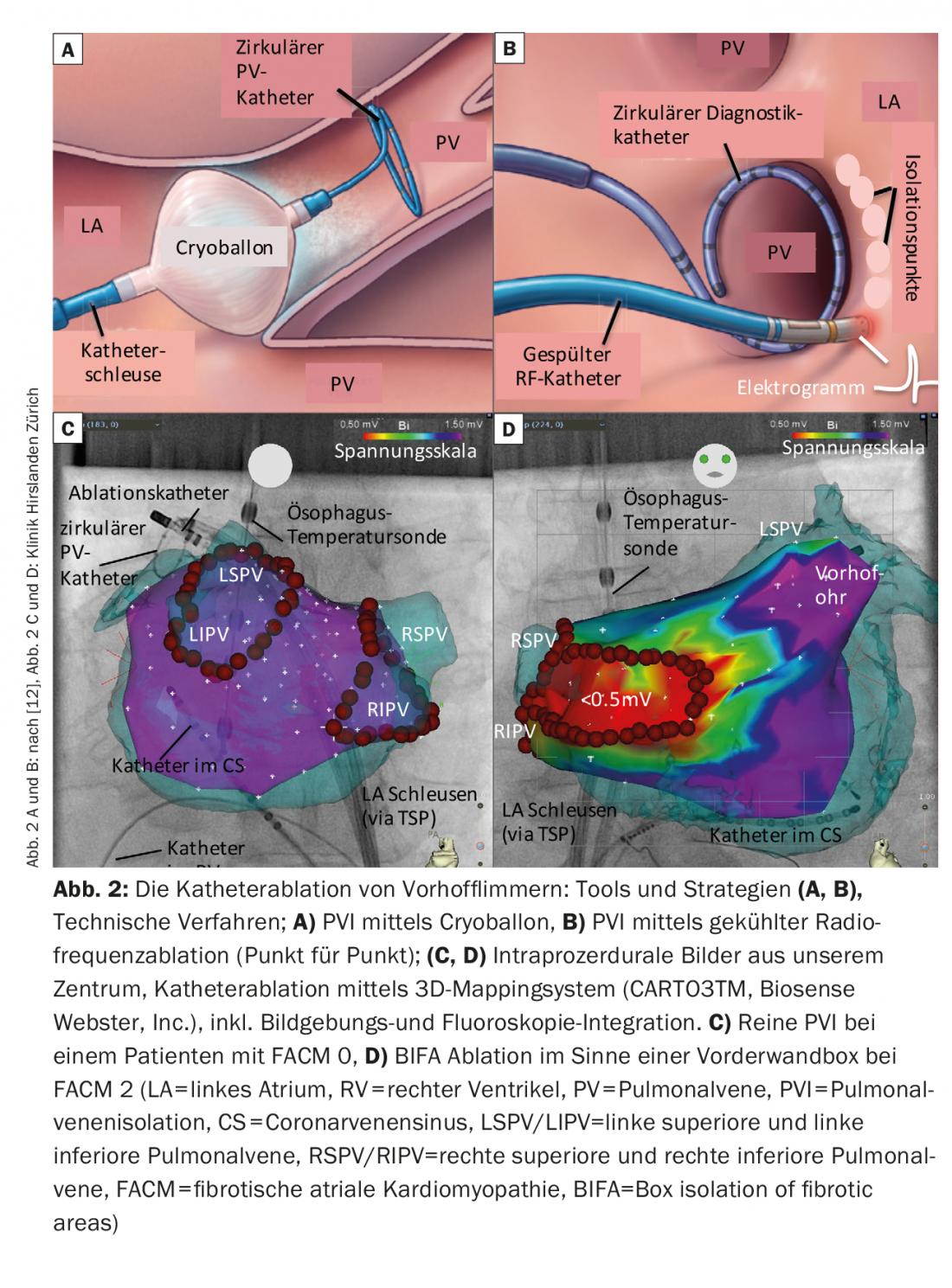
La forma de energía con la que se tiene más experiencia en todo el mundo es la corriente de alta frecuencia (= radiofrecuencia, RF). Se suele crear una línea circunferencial alrededor de la VP ipsilateral mediante la ablación punto por punto sobre la punta del catéter. El aislamiento eléctrico suele comprobarse mediante el uso periprocedimiento de catéteres circulares de mapeo. A menudo se utilizan sistemas de cartografía electroanatómica o técnicas de imagen para la integración de imágenes (TC, IRM, ecografía intracardiaca). Éstas facilitan la navegación dentro de la aurícula, contribuyen a la seguridad de la intervención y reducen los tiempos de fluoroscopia. La sostenibilidad de las lesiones de ablación también ha mejorado con tecnologías físicas como las esclusas navegables, diversas técnicas de lavado del catéter y, en particular, la medición de la presión de contacto del catéter. La tasa de recuperación de las líneas fotovoltaicas podría verse reducida como consecuencia de ello.
Además de la ablación por radiofrecuencia, hoy en día se utiliza cada vez con más frecuencia la ablación con criobalón. Las 4 VP se aíslan individualmente y se utiliza la fluoroscopia con ayuda de inyecciones de contraste para evaluar una posición óptima del balón. Los balones suelen ser más fáciles de manejar, pero tienen la limitación de que no es posible realizar un diagnóstico/terapia detallados de las arritmias consecutivas o un análisis de los electrogramas de la aurícula izquierda fuera de la VP durante el procedimiento.
En muy raras ocasiones se utiliza la energía láser para la IVP. La experiencia a este respecto sigue siendo limitada.
En la PAF, por lo general pueden lograrse muy buenos resultados a largo plazo con un solo procedimiento utilizando IVP puro. Por el contrario, a pesar de los avances técnicos y estratégicos, las tasas de éxito de la persAF son limitadas, incluso después de múltiples procedimientos. Las recurrencias tras la ablación no siempre pueden explicarse por la recuperación de la conducción de las VP.
El sustrato auricular izquierdo
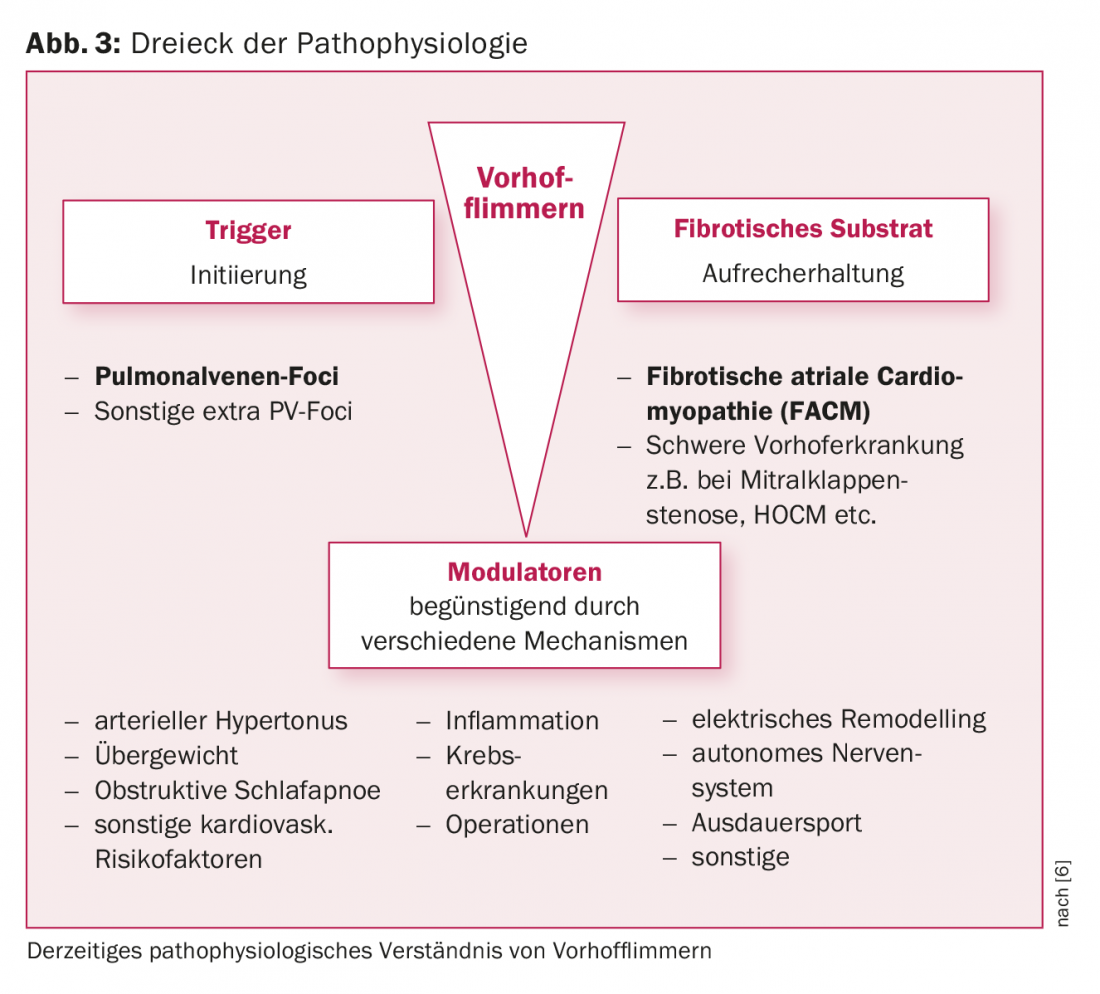
La presencia de fibrosis auricular izquierda es un hallazgo patológico típico en pacientes con FVC. Este sustrato auricular izquierdo desempeña un papel crucial en el mantenimiento de la FVC. Esta última puede desarrollarse sobre la base de una cardiopatía estructural significativa (por ejemplo, estenosis de la válvula mitral, HOCM) o puede existir en forma de enfermedad auricular independiente. El término miocardiopatía auricular fibrótica preexistente (MCAF) se ha impuesto en los últimos años [5, 6] (Fig. 3, 4). Los estudios experimentales han demostrado que los procesos de remodelación estructural fibrótica conducen a una situación eléctricamente anisotrópica (alteración de las velocidades de conducción, periodos refractarios, contactos célula-célula), que favorece el mantenimiento de la FVC. Ahora sabemos que las tasas de éxito de la ablación dependen significativamente de la extensión de la fibrosis auricular subyacente.
La creación de un mapa de voltaje bipolar durante el procedimiento puede cartografiar bien este sustrato auricular izquierdo (las zonas sanas están codificadas en color morado, las zonas muy fibróticas <0,5 mV rojo).
Nuestro centro divide ahora la FACM en 5 estadios en función del grado de gravedad (Fig. 4) (FACM 0: sin zonas de baja tensión significativas en el mapa de tensión, FACM 1: fibrosis local de menor extensión, FACM 2: zonas de fibrosis más grandes y confluentes, FACM3: fibrosis auricular pronunciada, pero aún limitada regionalmente, FACM 4: fibrosis casi ubicua).
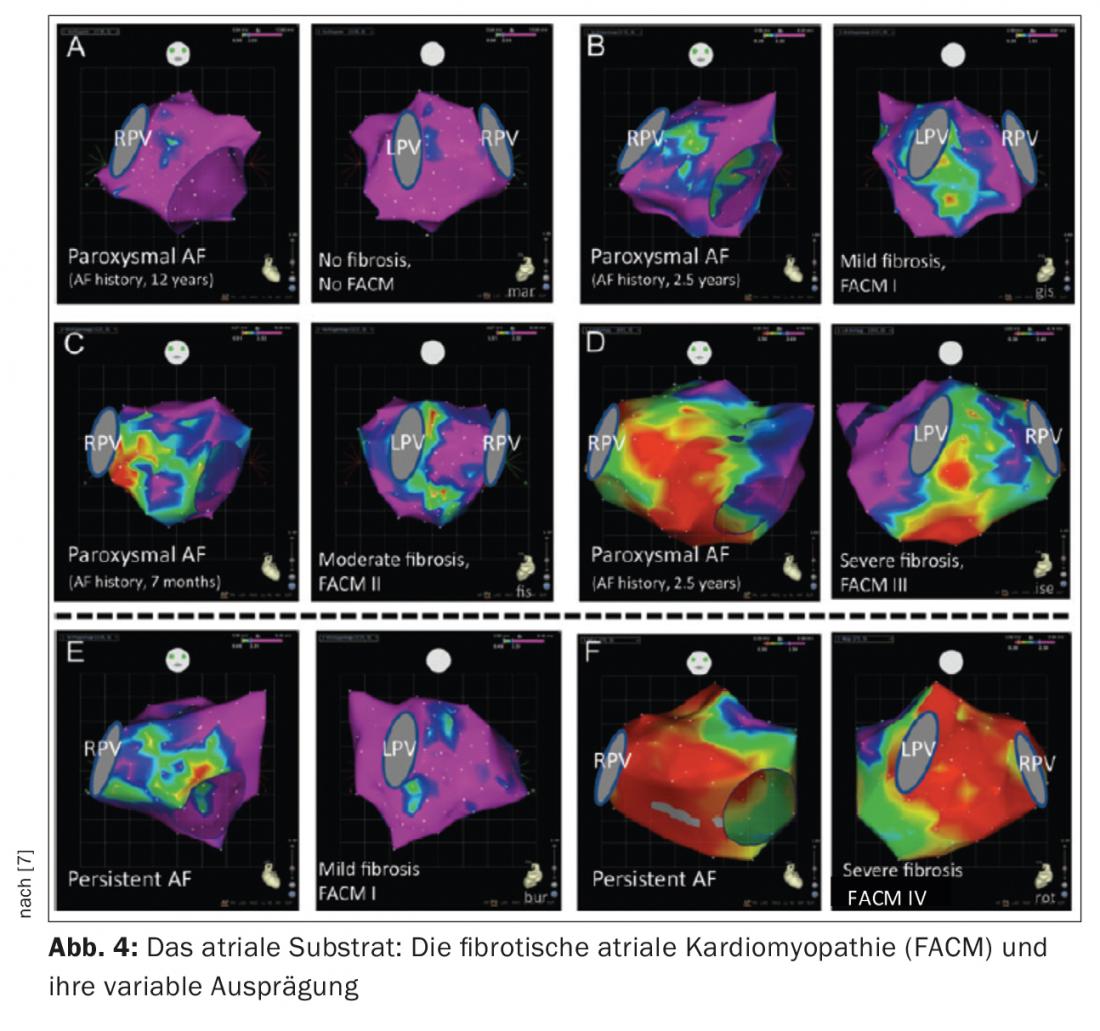
Durante mucho tiempo se ha supuesto que la duración y la magnitud de los episodios de fibrilación auricular proporcionan el estímulo crítico para la remodelación fibrótica de las aurículas (“la FA engendra FA”). Mientras tanto, existen dudas sobre esta teoría. Esto se debe a que se ha demostrado que tanto los pacientes con PAF como con persAF pueden tener una enfermedad auricular significativa. En nuestros pacientes, pueden detectarse zonas de fibrosis en casi el 20% de los pacientes con PAF y en el 70% de los pacientes con persAF.
Métodos individualizados anteriores y nuevos para la modificación de sustratos
La IVP por sí sola sólo tiene éxito en algo menos del 50% de los pacientes con persAF. Sin embargo, las estrategias de ablación anteriores que van más allá del IVP (por ejemplo, la ablación de electrogramas fraccionados complejos, los llamados CFAE, o la creación de líneas, o una combinación de ambas) no han contribuido a ninguna mejora significativa de los resultados de la ablación. Esto último lo ha demostrado en particular el estudio multicéntrico prospectivo STAR AF II [1,8].
Por lo tanto, se han desarrollado conceptos de ablación individualizados que (además de la IVP) tienen en cuenta los patomecanismos subyacentes de la FVC.
Por un lado, desde un punto de vista funcional, los “rotores” auriculares han cobrado protagonismo en los últimos 5 años. Las nuevas técnicas de mapeo electrofisiológico permiten identificar estos “motores” de la FVC mediante un catéter multielectrodo en forma de cesta, o más raramente de forma no invasiva mediante un “mapeo de la superficie corporal”, y hacerlos accesibles para una ablación dirigida. Sin embargo, su valor clínico, especialmente en pacientes con persAF, necesita más investigación. Los resultados de la ablación son controvertidos [9].
Por otro lado, hoy en día existen conceptos de ablación que se centran en los cambios estructurales, es decir, en la fibrosis auricular izquierda. El aislamiento en caja de las zonas fibróticas (BIFA), que va más allá de la IVP circunferencial, es una de estas estrategias desarrolladas en nuestro centro (Fig. 2B). Basándose en un mapa de voltaje creado por la aurícula en ritmo sinusal, se aíslan eléctricamente las zonas fibróticas, es decir, las “zonas de bajo voltaje” (<0,5 mV). El objetivo es eliminar las zonas auriculares enfermas y, por tanto, el sustrato potencialmente arritmogénico.
A pesar de tratarse de una población de pacientes difícil, el concepto BIFA logra buenos resultados de ablación con tasas iniciales de éxito a 1 año en torno al 85% con sólo 1,2 procedimientos por paciente [10].
Debido a la expresión altamente variable de la FACM, puede elegirse individualmente un concepto de ablación óptimo durante el procedimiento. Los procedimientos de diagnóstico por imagen como método de cribado preliminar aún están en fase de prueba. En pacientes sin FACM detectable (FACM 0), la IVP por sí sola parece suficiente incluso en la persAF. En este caso, existe una buena probabilidad pronóstica de preservación a largo plazo del ritmo sinusal (80-90%) con sólo 1,2 procedimientos/paciente [10]. La ablación con catéter es mucho más exigente en pacientes con enfermedad auricular existente. Aún no se ha aclarado de forma concluyente hasta qué punto los pacientes con el grado más alto de fibrosis auricular (FACM 4) pueden beneficiarse de la ablación con catéter a largo plazo.
Moduladores de la fibrilación auricular
Varios factores de riesgo clínicos (edad, hipertensión, obesidad, apnea del sueño, diabetes, alcohol, etc.) favorecen la aparición de la FVC. Ciertas circunstancias concomitantes como la inflamación/infección o un entorno perioperatorio también favorecen la recurrencia de la arritmia (Fig. 3).
En los últimos años se ha demostrado que el tratamiento dirigido con los llamados “moduladores de la fibrilación auricular” tiene un efecto positivo. Por ejemplo, el grupo de investigación australiano dirigido por Sanders pudo demostrar que el tratamiento específico de los factores de riesgo clínicos conduce a una reducción de los síntomas asociados a la FVC, provoca un remodelado cardiaco e incluso puede mejorar significativamente los resultados de la ablación con catéter [11].
Por lo tanto, el control de los factores de riesgo debe ser un componente esencial del control del ritmo en la consulta, no sólo antes, sino también después de la ablación con catéter. Por lo tanto, es deseable un tratamiento interdisciplinar de los pacientes con FVC.
Complicaciones
Las posibles complicaciones de la ablación con catéter de la FVC dependen de las tecnologías y estrategias de ablación utilizadas y de la experiencia del investigador.
La tasa global de complicaciones es de aproximadamente un 4-5%, y las complicaciones vasculares periféricas asociadas al acceso inguinal representan aproximadamente la mitad [1,12,13]. Las complicaciones graves son poco frecuentes.
Se notifican derrames/taponamientos pericárdicos en el 1-2,5% de los casos, con tasas ligeramente inferiores del 0,5% para los criobalones. El riesgo de complicaciones cerebrovasculares (AIT/ictus) se ha reducido en los últimos años gracias a medidas como la exclusión de trombos previa a la intervención mediante ecocardiografía transesofágica, la heparinización periprocedimiento (guiada por ACT), así como el lavado continuo de catéteres/conductos, y en la actualidad es de sólo un 0,5% aproximadamente.
Las estenosis de las VP como efecto térmico de la ablación prácticamente ya no se producen hoy en día debido a las nuevas estrategias de ablación fuera de las zonas del orificio de las VP y en la literatura se habla de un 0-0,3%.
La paresia diafragmática es una complicación rara pero típica de la ablación con criobalón (2-5%). Sin embargo, a menudo sólo es detectable temporalmente, de modo que al cabo de 3 meses sólo se describe en el 0,2% de los casos. Una complicación extremadamente rara pero potencialmente mortal es la aparición de una fístula atrioesofágica (informes de un solo caso o aproximadamente el 0,04%). Se recomiendan claramente medidas profilácticas en este sentido: Reducciones de energía en la pared posterior de la aurícula y el uso de sondas de temperatura esofágica que detectan temperaturas excesivamente altas o bajas durante la ablación.
Una mirada al futuro
La FVC es una enfermedad compleja y heterogénea. La ablación con catéter puede tratar eficazmente a una gran proporción de pacientes y establecer un ritmo sinusal estable a largo plazo. Sin embargo, la gravedad de la enfermedad auricular subyacente, que no siempre se correlaciona con el aspecto clínico (PAF frente a persAF), tiene una importancia decisiva para el pronóstico a largo plazo.
Por lo tanto, los conceptos de ablación individualizados “a medida” son cruciales para lograr unos resultados óptimos. Las nuevas técnicas de diagnóstico, idealmente de alta resolución y de mapeo automatizado durante la ablación con catéter, nos darán más información, especialmente sobre los mecanismos de mantenimiento de la FVC. Además, aumentará la importancia de las técnicas de imagen (por ejemplo, ecoanálisis específicos como la deformación, resonancias magnéticas cardiacas, etc.) con el potencial de decidir terapias adecuadas o conceptos específicos de ablación antes del procedimiento. Además, los biomarcadores (por ejemplo, marcadores de la matriz ex tracelular) o las predisposiciones genéticas conocidas podrían proporcionar pistas sobre el alcance y la progresión del sustrato auricular a medio plazo.
Literatura:
- Calkins H, et al: HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation: recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace. 2012; abr;14(4): 528-606.
- Kirchhof P, et al.: 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS: The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESCEndorsed by the European Stroke Organisation (ESO). Europace. 2016 Ago 27 [Epub].
- Friberg L, et al: La ablación con catéter para la fibrilación auricular se asocia a una menor incidencia de ictus y muerte: datos de los registros sanitarios suecos. Eur Heart J. 2016; Mar 16. pii: ehw087. [Epub ahead of print]
- Haïssaguerre M, et al. Inicio espontáneo de la fibrilación auricular por latidos ectópicos originados en las venas pulmonares. N Engl J Med. 1998; Sep 3;339(10): 659-66.
- Kottkamp H, et al: Ablación con catéter de la fibrilación auricular: ¿cómo modificar el sustrato? J Am Coll Cardiol. 2015; Jan 20;65(2): 196-206.
- Kottkamp H, et al.: El sustrato en la fibrilación auricular “precozmente persistente” ¿inducida por arritmias, por factores de riesgo o por una miocardiopatía auricular fibrótica específica? JACC CEP 2016; 2: 140-142.
- Kottkamp H: Sustrato de la fibrilación auricular humana: hacia una cardiomiopatía auricular fibrótica específica. Eur Heart J. 2013; Sep;34(35):2731-8.
- Verma A, Jiang CY, et. al.: STAR AF II Investigators. Enfoques de la ablación con catéter para la fibrilación auricular persistente. N Engl J Med. 2015; 7 de mayo;372(19): 1812-22.
- Guillem MS, Climent AM, et al: Presencia y estabilidad de los rotores en la fibrilación auricular: evidencias e implicaciones terapéuticas. Cardiovasc Res. 2016, 109(4): 480-92. [Epub].
- Kottkamp H, et. al.: Aislamiento en caja de las zonas fibróticas (BIFA): Un enfoque de modificación del sustrato adaptado al paciente para la ablación de la fibrilación auricular. J Cardiovasc Electrophysiol. 2016; Jan27(1):22-30
- Pathak RK, et al: Estudio de reducción agresiva de los factores de riesgo para la fibrilación auricular e implicaciones para el resultado de la ablación: el estudio de cohortes ARREST-AF. J Am Coll Cardiol 2014;64: 2222-2231.
- Kuck KH, et al: Ablación con criobalón o radiofrecuencia para la fibrilación auricular paroxística. N Engl J Med. 2016; 374: 2235-45.
- Shah RU, et al: Complicaciones del procedimiento y repetición de procedimientos tras la ablación con catéter para la fibrilación auricular. J Am Coll Cardiol 2012; 59: 143-9.
CARDIOVASC 2016; 15(6): 3-8