Clostridium difficile es una causa frecuente de diarrea y colitis asociadas a los antibióticos. La incidencia está aumentando. Las formas recurrentes de la enfermedad, en particular, conllevan una elevada “carga de enfermedad”.
Según datos epidemiológicos publicados en 2017, las cepas toxigénicas de Clostridium difficile (C.difficile ) están presentes en hasta el 15,5% de los pacientes hospitalizados, con una tasa de mortalidad de entre el 3% y el 14% [2]. En el 10-20% de los casos de diarrea asociada a antibióticos, se trata de una diarrea asociada a C. difficile . La aparición de los síntomas es típica entre horas y semanas después del tratamiento antibiótico; la prevalencia varía en función del principio activo utilizado (ampicilina 5-10%; amoxicilina-ácido clavulánico 10-25%; cefixima 15-20%; otros como cefalosporinas, fluoroquinolonas, macrólidos, tetraciclina 2-5%), según el ponente [3]. El riesgo de recurrencia tras un primer episodio tratado con éxito es de aproximadamente el 20% y aumenta hasta el 40-60% tras el segundo episodio, explica el Prof. Ansgar W. Lohse, MD, director de clínica y especialista en medicina interna y gastroenterología del Centro Médico Universitario de Hamburgo-Eppendorf [1,3].
Diagnóstico: ¿Qué recomiendan las directrices actuales?
Según el profesor Lohse, las características clínicas clásicas de una infección por C.difficile (CDI) son las siguientes: diarrea acuosa (raramente sanguinolenta), fiebre (28%), dolor abdominal (22%), íleo, megacolon tóxico, perforación intestinal, sepsis [3]. Para el estudio diagnóstico, los siguientes factores de riesgo pueden ser indicativos de una posible CDI como diagnóstico provisional si se presentan síntomas: terapia antibiótica (cefalosporinas, quinolonas, clindamicina, ácido clavulánico); inhibidores de la bomba de protones; inmunosupresión; edad>65 años; colonización con C. difficile (0-3% en personas no hospitalizadas; 20-40% en pacientes hospitalizados; enfermedad inflamatoria intestinal crónica [2–4].
Según la directriz S2k, el C. difficile gastrointestinal y los norovirus son posibles causas de gastroenteritis nosocomial; otros patógenos son irrelevantes y no es necesario analizarlos, explicó el ponente. Como medida de precaución, los pacientes deben ser aislados del contacto hasta 48 horas después de la aparición de los síntomas clínicos si se sospecha de gastroenteritis infecciosa (véase el recuadro) [3,5]. El ponente añadió que 48 h después del final de los síntomas, se podía realizar el des-aislamiento sin necesidad de volver a realizar las pruebas [3].

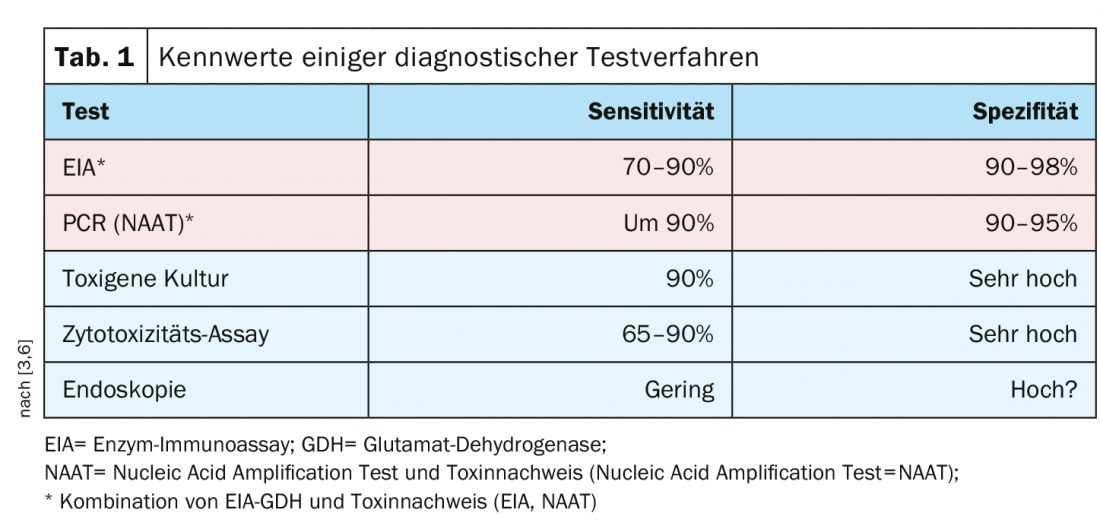
Existen varios métodos de prueba con una alta sensibilidad y especificidad, por lo que se recomienda una combinación de inmunoensayo enzimático/glutamato deshidrogenasa (EIA-GDH) y detección de toxinas (inmunoensayo enzimático=EIA; prueba de amplificación de ácidos nucleicos=NAAT) (Tab. 1).
La vancomicina se considera ahora terapia de primera línea
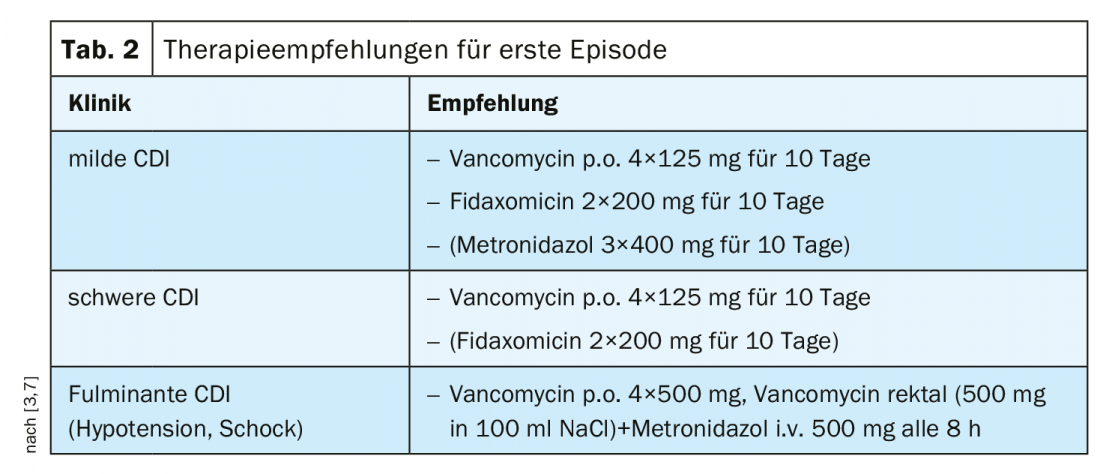
Anteriormente, se recomendaba el metronidazol para la ICD de leve a moderada como tratamiento rentable [1]. La vancomicina se ha utilizado en casos de intolerancia al metronidazol y/o mayor riesgo de recidiva [1]. Basándose en los resultados de los estudios pertinentes, la recomendación según las directrices IDSA/SHEA de 2018 se ajustó en función de la gravedad de la CDI [1]. Según las recomendaciones de consenso actuales, la vancomicina se considera terapia de primera línea tanto para los grados leves como graves de ICD. (Tab. 2). Si la ICD es leve y existe riesgo de recidiva, puede utilizarse fidaxomicina; contrariamente a evaluaciones anteriores, el uso de metronidazol debe limitarse a casos de falta de disponibilidad o intolerancia de los otros dos agentes [7]. En las formas graves y los cursos complicados de ICD, la vancomicina debe utilizarse siempre como tratamiento de primera línea [3]. Los predictores de ICD grave según la directriz S2k se muestran en el resumen 1. La vancomicina o la fidaxomicina pueden utilizarse para el tratamiento de la CDI recurrente [3,7] (Tab. 3).

La profilaxis de las recaídas es muy importante
Los datos muestran que incluso tras un tratamiento exitoso con alivio de los síntomas, una proporción significativa de pacientes recae y el riesgo de recaída aumenta con cada recaída [8]. El criterio temporal para una recaída es una nueva aparición de síntomas en el periodo comprendido entre al menos dos semanas y como máximo dos meses tras la mejoría de los síntomas iniciales (nueva infección frente a reinfección), según el ponente [3].

En los dos ensayos aleatorizados controlados con placebo MODIFY I y MODIFY II, la administración concomitante de una dosis única de bezlotoxumab (10 mg por kilogramo de peso corporal) durante la terapia estándar (vancomicina, metronidazol o fidaxomicina) para C. difficile dio lugar a una reducción del 38% en la tasa de recaídas en un plazo de 12 semanas [9].
En Suiza, el bezlotoxumab, un anticuerpo monoclonal con alta afinidad por la toxina B de C. difficile, está aprobado desde finales de 2017 para la prevención de las recidivas de Clostridioides difficile. El bezlotoxumab está dirigido contra la toxina B del C. difficile. Otra opción para la profilaxis de las recaídas con una elevada tasa de éxito es la transferencia del microbioma fecal (FMT) [2,3,12].

Existen nuevos resultados de investigación sobre estrategias preventivas, como el uso de probióticos, la microbiommanipulación intestinal durante la antibiosis, las vacunas, así como nuevos antibióticos que reducen los efectos negativos sobre el microbioma intestinal [1]. En cuanto a la opción de la vacunación, un ensayo de fase III sigue en fase de reclutamiento hasta 2020 [3,13].
Fuente: DGIM, Wiesbaden (D)
Literatura:
- Dieterle MG, Rao K, Young VB: Nuevas terapias y estrategias preventivas para las infecciones primarias y recurrentes por Clostridium difficile. Número especial: Antimicrobial Therapeutics Reviews 2019; 1435 (1): 110-138.
- Solbach P, Dersch P, Bachmann O: Estrategias de tratamiento individualizado de las infecciones por Clostridium difficile [Article in German]. Internist (Berl) 2017; 58(7): 675-681. doi: 10.1007/s00108-017-0268-2.
- Lohse A: Presentación de diapositivas, DGIM 2019, 05.05.2019, Abdomen agudo: Unidad 1: C. diff. Colitis, Prof. Dr. med. A. Lohse, Director de Clínica, Especialista en Medicina Interna y Gastroenterología, Centro Médico Universitario de Hamburgo-Eppendorf.
- Gould LH, Limbago B: Clostridium difficile en alimentos y animales domésticos: un nuevo patógeno de transmisión alimentaria. Clin Infect Dis 2010; 51(5): 577-582. doi: 10.1086/655692.
- AWMF: Infecciones gastrointestinales y enfermedad de Whipple, directriz S2k 2015, AWMF en línea. El portal de medicina científica, número de registro 021-024, a 31.01.2015 , válido hasta el 30.01.2020. www.awmf.org/leitlinien/detail/ll/021-024.html, último acceso: 15 de mayo de 2019.
- Manthey CF, Eckmann L, Fuhrmann C: Tratamiento de la infección por Clostridium difficile: ¿alguna novedad más allá del metronidazol y la vancomicina? Revisión experta de farmacología clínica 2017; 10 (11). www.tandfonline.com, último acceso: 15 de mayo de 2019.
- McDonald LC, et al: Guía de práctica clínica para la infección por Clostridium difficile en adultos y niños: actualización de 2017 de la Sociedad de Enfermedades Infecciosas de América (IDSA) y la Sociedad de Epidemiología Sanitaria de América (SHEA). Clin. Infect Dis 1018; 66: e1-e48.
- Deshpande A, et al: Factores de riesgo de infección recurrente por Clostridium difficile: revisión sistemática y metaanálisis. Infect Control Hosp Epidemiol 2015; 36: 452-460.
- Wilcox MH, et al: Bezlotoxumab para la prevención de la infección recurrente por Clostridium difficile. N Engl J Med 2017; 376(4): 305-317.
- Curry SR, et al: Alta frecuencia de resistencia a la rifampicina identificada en un clon epidémico de Clostridium difficile de un gran hospital universitario. Clin Infect Dis 2009; 48: 425-429.
- Muller L, Halfmann A, Herrmann M: [Current data and trends on the development of antibiotic resistance of Clostridium difficile]. Bundesgesundheitsblatt Investigación sanitaria Protección de la salud 2012; 55: 1410-1417.
- Van Nood, E: Infusión duodenal de heces de donante para Clostridium difficile recurrente. NEJM 2013; 368(5): 407-415.
- Pfizer Inc: Ensayo de eficacia de la vacuna contra Clostridium difficile: NCT03090191. www.pfizer.com/science/find-a-trial/nct03090191, último acceso: 15 de mayo de 2019.
HAUSARZT PRAXIS 2019; 14(6): 32-33 (publicado el 24.5.19, antes de impresión).