En el tratamiento de la diabetes mellitus de tipo 2, los últimos años han traído algunas innovaciones en cuanto al diagnóstico, los objetivos de la terapia y la elección de los fármacos antidiabéticos. “Un enfoque centrado en el paciente” son las palabras clave del documento de posición conjunto de las sociedades americana y europea de diabetes, en el que se propone una mayor individualización de los objetivos terapéuticos con respecto al control de la glucemia y los factores de riesgo cardiovascular [1]. La duración de la diabetes, la edad del paciente, el riesgo de hipoglucemia, las comorbilidades y el cumplimiento deben tenerse en cuenta a la hora de determinar los objetivos de la terapia. La aplicación de modificaciones en el estilo de vida sigue siendo la medida más importante en el tratamiento de la diabetes mellitus. Los fármacos antidiabéticos disponibles permiten una terapia adaptada a las necesidades y comorbilidades del paciente. Sin embargo, el creciente número de fármacos antidiabéticos también requiere una formación continua y experiencia por parte de los médicos tratantes. Este artículo pretende ofrecer una visión general de los objetivos y las opciones de tratamiento para los pacientes con diabetes tipo 2.
La HbA1c se introdujo por primera vez como criterio de diagnóstico de la diabetes en 2009. Es menos sensible que la glucemia en ayunas, pero es una herramienta práctica debido a que permite realizar pruebas independientes de la hora del día. Los criterios diagnósticos de la diabetes mellitus pre y manifiesta figuran en la tabla 1. Se sugiere el cribado en todos los pacientes mayores de 45 años y en individuos con sobrepeso con un IMC ≥25 kg/m2 con un factor de riesgo adicional de diabetes mellitus [1].

Dado que un trastorno de la tolerancia a la glucosa suele existir desde hace años cuando se diagnostica por primera vez la diabetes mellitus, se recomienda realizar un cribado de las complicaciones secundarias asociadas a la diabetes y de las comorbilidades cardiovasculares en el momento del diagnóstico (Tab. 2) . El cribado debe repetirse a intervalos anuales.
Objetivos de la terapia
Grandes ensayos clínicos como el UK Prospective Diabetes Study (UKPDS) o el estudio Steno-2 han demostrado que un control glucémico óptimo, junto con el tratamiento de los demás factores de riesgo cardiovascular, conlleva una reducción significativa de las complicaciones tanto microvasculares como macrovasculares [2–6]. Los datos de seguimiento a 10 años del UKPDS nos han enseñado que un control estricto de la glucemia tras el diagnóstico inicial de diabetes sigue reduciendo las complicaciones tardías y la mortalidad una década después del final del estudio (“memoria metabólica”) [5]. Tres grandes ensayos con objetivos de tratamiento mucho más agresivos (HbA1c <6% frente a 7-7,9% [7]) que, por ejemplo, en el UKPDS (7% frente a 7,9% [2]) mostraron un aumento de la mortalidad, por lo que ahora se favorece un objetivo “individualizado” [1, 2, 7, 8]. Hay que tener más en cuenta la duración de la diabetes, la edad del paciente, las comorbilidades y el cumplimiento. Para la mayoría de los pacientes (es decir, pacientes con una larga esperanza de vida, corta duración de la diabetes, sin comorbilidades graves y con un buen cumplimiento terapéutico), una HbA1c de <7% sigue considerándose el objetivo del tratamiento al tiempo que se evita la hipoglucemia. Si existen comorbilidades importantes, especialmente cardiovasculares, una esperanza de vida corta, un riesgo elevado de hipoglucemia y riesgo de caídas, debería reconsiderarse una relajación del objetivo de HbA1c al 7-8%.
Opciones terapéuticas
La terapia de la diabetes mellitus tipo 2 debe tener un enfoque holístico, es decir, siempre debe perseguirse la reducción de peso, la optimización del perfil de riesgo cardiovascular y la evitación de la hipoglucemia. La hipoglucemia recurrente, al igual que la hiperglucemia, es probablemente responsable de las complicaciones a largo plazo y debe evitarse.
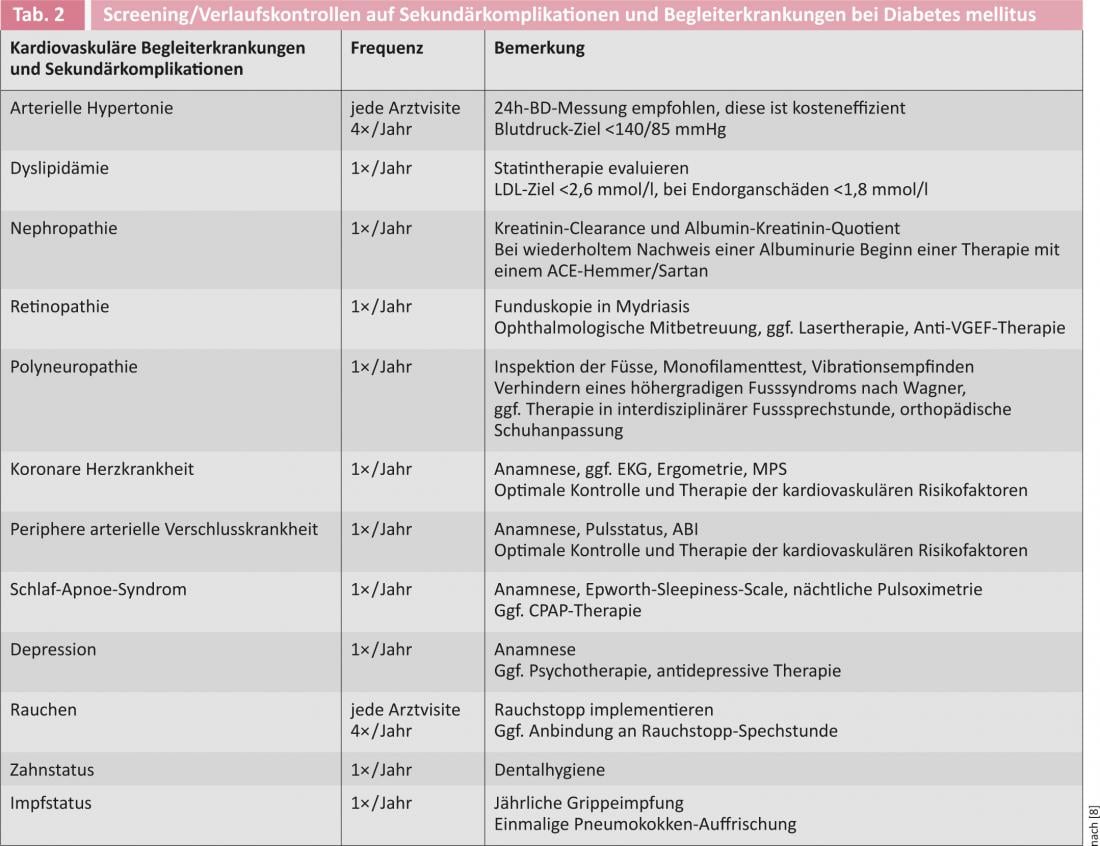
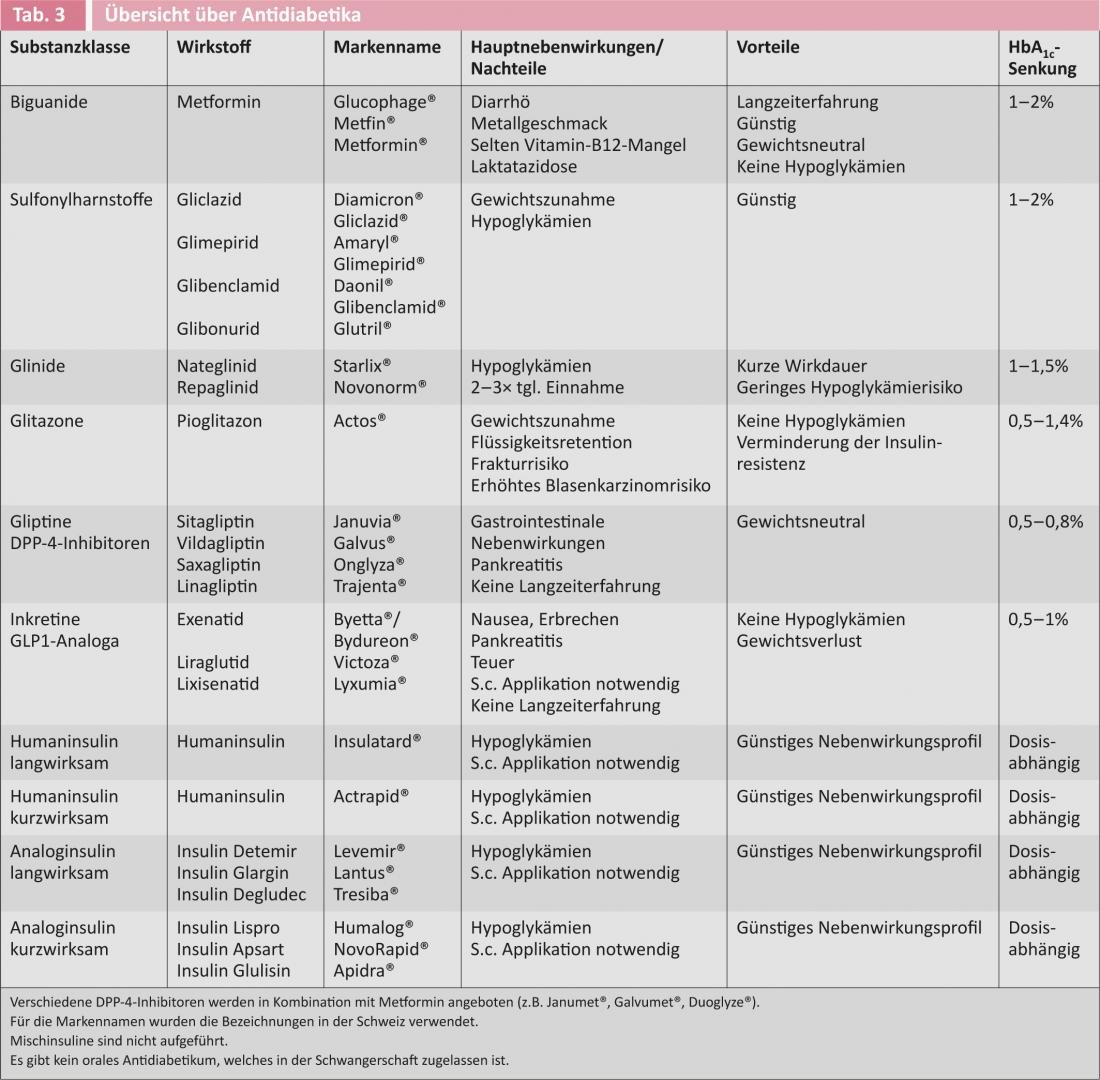
La figura 1 muestra la recomendación actual para iniciar la terapia antidiabética en los diabéticos de tipo 2 de las sociedades de diabetes americana y europea [6]. La tabla 3 ofrece una visión general de los fármacos antidiabéticos disponibles.
Intervención en el estilo de vida, deporte
La inactividad física y comer en exceso, que conducen a la obesidad y a la resistencia a la insulina, son los principales factores ambientales que aumentan el riesgo de diabetes. Incluso una pérdida de peso moderada del 5-10% del peso corporal conlleva una mejora significativa del estado metabólico diabético y del perfil de riesgo cardiovascular y puede hacer innecesaria la terapia farmacológica para la diabetes. Las modificaciones del estilo de vida incluyen una dieta sana, equilibrada y reducida en calorías durante toda la vida y una actividad física regular (por ejemplo, al menos 150 min/semana) [8]. Las intervenciones nutricionales y deportivas acompañadas suelen tener efectos sostenibles (por ejemplo, Diafit.ch).
Metformina
Siempre que no existan contraindicaciones, la metformina es el antidiabético oral de primera elección debido a su favorable perfil de eficacia y a sus muchos años de experiencia. La metformina es de peso neutro a ligeramente reductor y no provoca hipoglucemia. Sus principales efectos son la reducción de la gluconeogénesis hepática, la mejora de la captación de glucosa en las células musculares y adiposas y la reducción de los triglicéridos [9]. Recientemente, se ha recomendado su uso en pacientes con pocas perspectivas de realizar cambios drásticos en su estilo de vida ya en el momento del diagnóstico. Los estudios actuales postulan una reducción de la incidencia del cáncer y de la mortalidad bajo terapia con metformina. Los principales efectos secundarios son las molestias gastrointestinales, que pueden reducirse introduciendo lentamente el fármaco y proporcionando una buena información al paciente [9]. En casos extremadamente raros (<1 caso/100 000 pacientes), se ha descrito la aparición de acidosis láctica en pacientes con insuficiencia renal grave, por lo que la metformina está contraindicada en pacientes con un aclaramiento de creatinina <30 ml/min.
Sulfonilureas
Las sulfonilureas (glibenclamida, gliclazida, glimepirida, glibonurida) estimulan la secreción de insulina independientemente de la ingesta de alimentos, por lo que aumentan el riesgo de hipoglucemia y a menudo provocan un aumento de peso. La hipoglucemia se produce principalmente en ancianos y en presencia de insuficiencia renal grave (aclaramiento de creatinina <30 ml/min), siendo el riesgo mayor con las glibenclamidas. La ventaja de las sulfonilureas es que llevan muchos años establecidas y, por tanto, sus efectos secundarios son bien conocidos. Los pacientes en tratamiento con sulfonilureas deben ser capaces de medir la glucosa en sangre y ser instruidos sobre la hipoglucemia y las medidas de comportamiento antes de conducir [1, 6].
Glinide
Al igual que las sulfonilureas, las glinidas (nateglinida/repaglinida) también estimulan la secreción de insulina, por lo que no es aconsejable combinar estos preparados. Las glinidas tienen una semivida más corta y se administran con cada comida. El grado de aumento de peso es similar al de las sulfonilureas, y el riesgo de hipoglucemia es menor [1, 6].
Glitazonas
Las glitazonas también se denominan “sensibilizadores a la insulina” porque mejoran la sensibilidad a la insulina de los músculos, la grasa y el hígado. La rosiglitazona se retiró del mercado suizo en 2010 debido al aumento del riesgo cardiovascular, por lo que la pioglitazona es la única sustancia aprobada en Suiza. Además del conocido aumento de peso, la terapia con glitazonas puede provocar retención de líquidos, edema periférico y la consiguiente insuficiencia cardiaca, así como una disminución de la densidad ósea, un mayor riesgo de fracturas y un aumento de la incidencia de carcinomas de vejiga [1, 6]. La Sociedad Suiza de Endocrinología y Diabetología recomienda el uso de la pioglitazona sólo en pacientes seleccionados con una resistencia grave a la insulina y sin contraindicaciones, especialmente la insuficiencia cardiaca.
Incretinas
Agonistas de los receptores GLP1: El llamado efecto incretina describe el fenómeno de que una ingesta oral de glucosa induce una mayor liberación de insulina que una administración intravenosa de glucosa. El efecto incretina es responsable de alrededor del 60% de la secreción de insulina postprandial. Las dos incretinas conocidas, el péptido-1 similar al glucagón (GLP1) y el péptido insulinotrópico dependiente de la glucosa (GIP), son liberadas por las células enteroendocrinas de la pared intestinal tras la ingesta peroral de alimentos. Éstas activan las células β pancreáticas y provocan así un aumento de la secreción de insulina. Además, inhiben la gluconeogénesis a través de su efecto sobre las células α, retrasan el vaciado gástrico e inhiben centralmente el apetito. Dado que el efecto de las incretinas depende de la glucosa, la hipoglucemia no se produce con la monoterapia. Como efecto positivo adicional, los agonistas del GLP1 favorecen la reducción de peso. Los análogos del GLP1 son caros y deben aplicarse por vía subcutánea. Los principales efectos secundarios son náuseas, vómitos y diarrea [1, 6].
Gliptinas/Inhibidores de la DPP-4: El GIP y el GLP1 son degradados rápidamente por la dipetidil peptidasa-4 (DPP-4), por lo que se han desarrollado inhibidores de la DPP-4 como otra clase de sustancias. La hipoglucemia no se produce durante la terapia con inhibidores de la DDP-4 y su peso es neutro. La tolerabilidad de los inhibidores de la DPP-4 es buena, rara vez se producen molestias gastrointestinales. Sin embargo, existen pruebas de un mayor riesgo de cáncer de páncreas y de páncreas. Pronto se esperan estudios a largo plazo con criterios de valoración concretos y la aparición de efectos secundarios. En caso de insuficiencia renal, es necesario ajustar la dosis de la mayoría de los inhibidores de la DPP-4 [1, 6].
Insulina
La deficiencia de insulina existe en todas las formas de diabetes, por lo que la sustitución de la insulina es siempre, en principio, una opción terapéutica adecuada. Todos los pacientes a los que se les ajuste el tratamiento con insulina deben recibir formación sobre el autocontrol de la glucemia y el comportamiento en caso de hipoglucemia. Para los diabéticos de tipo 2, la insulina de cabecera se inicia antes de acostarse a 0,2 E/kgKG o 10 E y se va titulando lentamente hasta que los niveles de glucemia en ayunas estén por debajo de 7 mmol/l. La insulina básica puede combinarse con un antidiabético oral, preferiblemente metformina. La combinación con sulfonilureas no tiene un efecto aditivo significativo en la disminución de la HbA1c. Si la HbA1c sigue siendo >7%, cambie a un régimen de base/bolo [1, 6].
Operaciones bariátricas
La operación que se realiza con más frecuencia es el bypass gástrico (la llamada operación en Y de Roux), en la que se reduce considerablemente el tamaño del estómago y se conecta directamente el intestino delgado al estómago. Los resultados de estas operaciones son muy convincentes a corto plazo, con una esperada pérdida de peso de hasta un 30-40% en muchos casos. Los efectos secundarios incluyen signos de malabsorción, especialmente deficiencia de hierro y vitamina B12, que deben ser sustituidos. En el postoperatorio suelen aparecer problemas psicológicos, en parte debido a la pérdida del efecto gratificante de la comida. La mortalidad de la cirugía de bypass gástrico ronda el 0,5%. Hasta la fecha no puede responderse si la cirugía bariátrica es la panacea en la lucha contra la diabetes mellitus, ya que no se dispone de datos a largo plazo sobre la remisión de la diabetes y la reducción de la mortalidad. En un documento de posición de la Federación Internacional de Diabetes (FID) de 2011, la cirugía bariátrica se recomienda principalmente para los diabéticos tipo 2 obesos (IMC ≥35kg/m2) que no alcanzan los objetivos de tratamiento con las medidas convencionales y presentan comorbilidades cardiovasculares [10]. La cirugía bariátrica no debe evaluarse como “último recurso” en los diabéticos obesos con resistencia a la insulina, sino como una opción de tratamiento en una fase temprana.
Procedimiento en la práctica clínica diaria
Cuando se diagnostica diabetes mellitus, deben iniciarse intervenciones sobre el estilo de vida junto con la medicación con metformina. Para la intervención en el estilo de vida, existen programas de educación ambulatoria para diabéticos. Además, en este momento deben evaluarse todos los factores de riesgo cardiovascular y buscarse daños en los órganos finales. Si la diabetes sigue estando insuficientemente controlada con estas medidas (HbA1c >7,0%), la metformina debe combinarse con una sulfonilurea o una incretina o, alternativamente, con una insulina de cabecera. Si el control de la diabetes sigue siendo inadecuado, está indicada la implantación de una insulina a la hora de acostarse o un sistema de bolo básico. Recomendamos que los diabéticos obesos que no consigan reducir peso por sí mismos sean remitidos a un centro especializado en obesidad. Allí, la participación en un grupo de obesidad o en un grupo de personas con obesidad es posible. se evalúa la opción de una intervención bariátrica.
Bibliografía del editor
Dra. Stefanie Meyer
CARDIOVASC 2013; 12(4): 20-24











