Un enfoque prometedor para la terapia de la esclerosis múltiple reside en el tratamiento antígeno-específico. Su objetivo es inhibir específicamente la respuesta inmunitaria autoreactiva para evitar los riesgos de una inmunosupresión global.
Las enfermedades inmunomediadas, como las autoinmunes, se han tratado hasta ahora con terapias inespecíficas y globalmente inmunosupresoras. Esto suele provocar efectos secundarios y mayores riesgos de complicaciones. La esclerosis múltiple (EM) es una enfermedad autoinmune paradigmática del sistema nervioso central. El desarrollo de nuevas terapias para la EM ha tenido mucho éxito en la última década, y ahora disponemos de una variedad de fármacos nuevos y muy eficaces. Sin embargo, todas estas inmunoterapias tienen un efecto inespecífico y conducen a una inmunosupresión a veces más profunda, que se asocia a los conocidos efectos secundarios y, en ocasiones, a riesgos elevados. Otra consecuencia es una restricción en muchos ámbitos de la vida como la planificación familiar, las vacunas y los viajes.
El desarrollo de terapias antígeno-específicas que traten con gran selectividad sólo las partes del sistema inmunitario responsables de la inflamación autoreactiva tendría el potencial de tratar la enfermedad cerca de su causa y evitar los riesgos de la inmunosupresión global [1]. La aplicación con éxito de esta estrategia terapéutica sería un hito importante en la medicina y un paso más hacia la medicina de precisión.
Después de que los estudios iniciales con terapias antígeno-específicas no lograran en su mayoría el éxito esperado, en los últimos años se han producido importantes avances en este campo, por lo que la aplicación con éxito de este prometedor concepto terapéutico está al alcance de la mano. Entre ellas se incluyen estrategias terapéuticas innovadoras, que ya se encuentran en las primeras fases de desarrollo clínico, y la identificación de nuevos antígenos diana de la respuesta inmunitaria autoreactiva de los pacientes con EM, que permitirán enfoques totalmente nuevos de las terapias antígeno-específicas [2,3].
Un requisito previo esencial para el desarrollo de terapias antígeno-específicas es una buena comprensión de la patogénesis de la enfermedad y de los antígenos diana de la respuesta inmunitaria autoreactiva. Se desconoce la causa de la EM, pero se cree que tanto los factores ambientales como los genéticos contribuyen a la aparición y progresión de la enfermedad. Con diferencia, el factor genético más importante es un antígeno leucocitario humano (HLA) específico, una molécula de superficie responsable del reconocimiento de antígenos por parte de las células T y, por tanto, un factor importante en el perfil de las respuestas inmunitarias individuales. Por término medio, el 50% de los pacientes con EM son portadores del alelo de riesgo principal HLA DRB1*1501, y el resto se divide entre varios otros alelos HLA. Por lo tanto, el tipo de HLA individual deberá tenerse en cuenta en el futuro a la hora de probar terapias antígeno-específicas en pacientes con EM. Además, existen diversos hallazgos que sugieren una respuesta inmunitaria en la EM dirigida contra autoantígenos específicos [4].
El espectro de antígenos en la EM
Se han descrito varios antígenos diana diferentes en la esclerosis múltiple. Basándose en la fisiopatología centrada en la desmielinización del SNC, se investigaron en particular las proteínas de la capa de mielina de las neuronas del cerebro y la médula espinal. Las proteínas más importantes en este contexto son la proteína básica de la mielina (MBP), la proteolipídica (PLP) y la gilocoproteína de los oligodendrocitos de mielina (MOG). En varios modelos animales en ratones, ratas y monos, una respuesta inmunitaria inducida contra una de estas proteínas puede desencadenar una enfermedad desmielinizante inflamatoria que se asemeja a la EM en muchas características. Esta reacción inmunitaria se dirige principalmente contra unas pocas secuencias peptídicas de estas proteínas, que se describen como inmunodominantes. Curiosamente, estos péptidos inmunodominantes en animales coinciden en gran medida con las reactividades inmunitarias encontradas en pacientes con EM [4]. En un estudio de pacientes con EM, se identificaron siete péptidos de la mielina (MOG1-20, MOG35-5, MBP13-32; MBP83-99, MBP111-129, MBP146-170, PLP139-154) a partir de un mayor número de péptidos inmunodominantes de las proteínas de la mielina MBP, PLP, MOG y nucleótido cíclico fosfodiesterasa (CNP) para los que la reactividad difería en los pacientes con EM de los controles [5]. Este conjunto de péptidos sirve ahora de base para las terapias antígeno-específicas en varios enfoques.
Además de las proteínas de la mielina, otras proteínas pueden desempeñar un papel importante como antígenos diana de la respuesta inmunitaria autoreactiva en el SNC, y más recientemente se han identificado dos nuevos candidatos como antígenos diana importantes en pacientes con EM. A diferencia de los estudios anteriores, que se basaban esencialmente en conceptos fisiopatológicos preexistentes y transferidos de modelos animales a humanos, estos estudios recientes han tomado como punto de partida a pacientes con EM y han investigado qué secuencias peptídicas reconocen las células T aisladas directamente del tejido cerebral inflamatorio de pacientes con EM [3]. La proteína TSTA3, una GDP L-fucosa sintasa, fue descubierta como antígeno diana de la respuesta inmunitaria autoreactiva [3]. Un aspecto interesante y muy probablemente relevante desde el punto de vista fisiopatológico es que la proteína también es expresada por ciertas bacterias intestinales (Akkermansia), que se encuentran con frecuencia en los pacientes con EM. Estas bacterias podrían contribuir a la activación inmunitaria que, a su vez, provoca o mantiene la inflamación en el cerebro. Otro antígeno diana importante es la proteína RAS Guanyl Releasing Protein 2 (RASGRP2), que se expresa en los linfocitos B de la sangre periférica, así como en el cerebro. Las células T de los pacientes con EM, que se activan en la sangre periférica, tienden a aumentar la autoproliferación y migran preferentemente al cerebro, muestran una mayor reactividad contra la proteína RASGRP2 y pueden detectarse en las lesiones de los pacientes con EM [2].
No se puede asumir que la respuesta inmunitaria patógena de un paciente de EM, o en la EM en general, esté dirigida sólo contra un único antígeno, sino que puede afectar a varios antígenos. Además, se demostró en el modelo animal que esta autoreactividad puede diversificarse en el curso de la enfermedad y extenderse a diferentes antígenos. En los seres humanos existen pocos datos al respecto hasta la fecha, pero es importante porque en la mayoría de los casos el inicio de la enfermedad no está claramente establecido y, por lo tanto, se desconoce la cascada de diversificación y, por lo tanto, el espectro completo de antígenos en el paciente individual.
Mecanismos de tolerancia inmunitaria
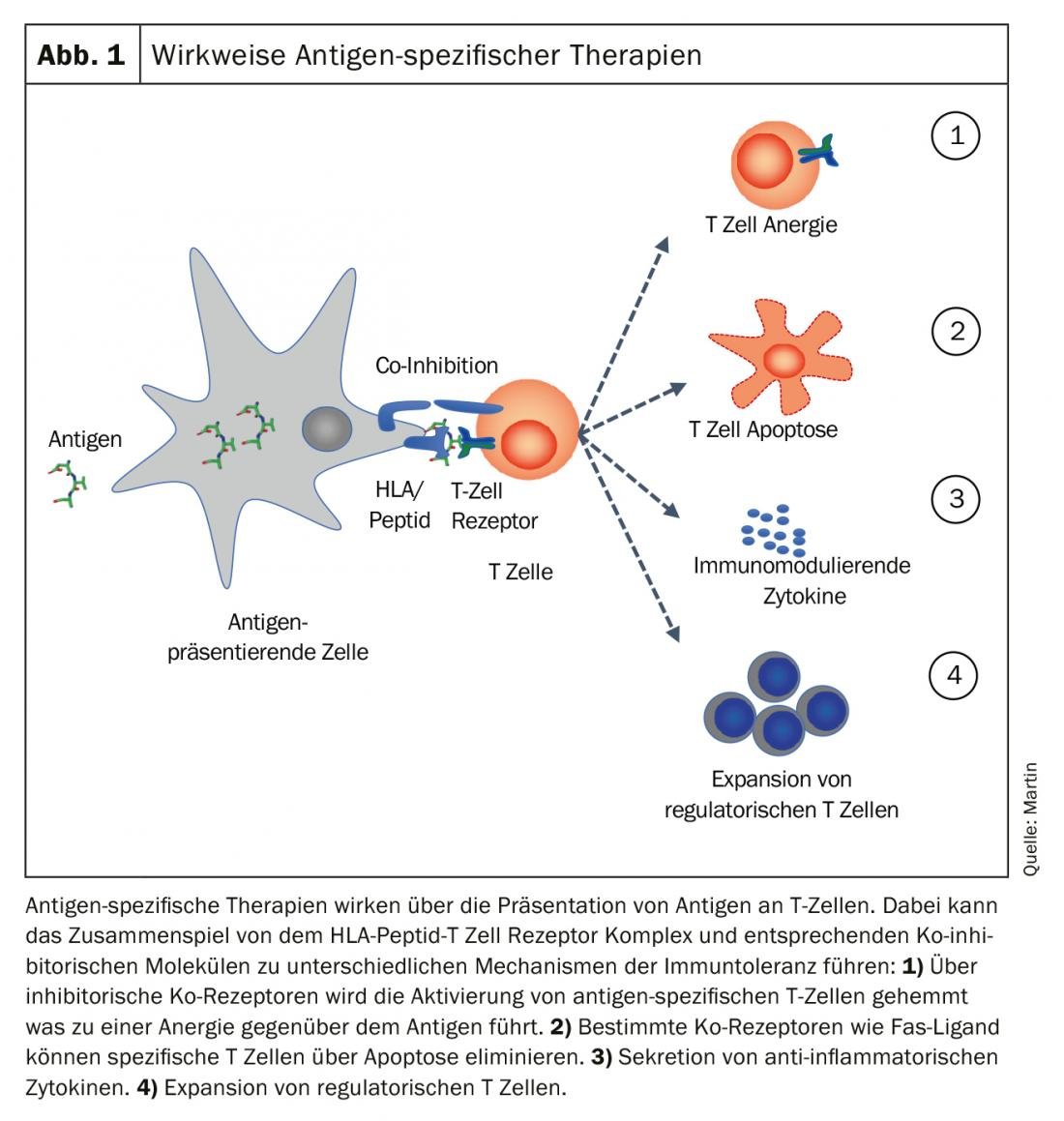
El objetivo de las terapias antígeno-específicas es “restablecer” la tolerancia inmunológica al antígeno específico. Diferentes mecanismos, solos o combinados, pueden contribuir al establecimiento y mantenimiento de la tolerancia inmunitaria. Los cuatro mecanismos principales se muestran en la figura 1.
- La célula presentadora de antígeno puede impedir la activación de las células T específicas de antígeno a través de correceptores inhibidores y generar anergia hacia el antígeno.
- Los correceptores como el ligando Fas pueden desencadenar la apoptosis en células T específicas y eliminarlas.
- Se crea un entorno tolerogénico mediante la secreción de citoquinas antiinflamatorias y se induce la expansión de las células T reguladoras.
Terapias antígeno-específicas en ensayos clínicos
Hasta ahora se han probado diferentes estrategias con terapias antígeno-específicas en ensayos clínicos en pacientes con EM. La mayoría de ellos se centraron en proteínas individuales de la mielina o en unos pocos péptidos como antígenos diana para la inducción de tolerancia. Sólo unos pocos enfoques han utilizado múltiples péptidos de diferentes proteínas de la mielina. Las vías de administración probadas fueron oral, transdérmica, epi- y subcutánea e intravenosa. Tras los resultados negativos de los estudios sobre la administración oral de mielina o la aplicación intravenosa de péptidos MBP, la vacunación de células T o de receptores de células T, algunos enfoques terapéuticos han mostrado recientemente resultados positivos en los estudios [1]. Un estudio de fase II investigó la administración transdérmica de tres péptidos de mielina MOG35-55, MBP85-99 y PLP139-151, que se aplicaron mediante un parche en la parte superior del brazo [6]. El estudio realizado en 30 pacientes con EM recidivante cumplió el criterio de valoración del estudio de una reducción de los focos que realzan con el contraste en la resonancia magnética cerebral. Los autores también pudieron demostrar una reducción de las células T específicas de péptidos a nivel mecanístico y describir la importancia de las células dendríticas en los ganglios linfáticos de drenaje [7]. Otro enfoque terapéutico utiliza cuatro péptidos MBP, que se administran por vía parenteral. Un estudio de fase II en 37 pacientes recidivantes que recibieron inyecciones intradérmicas quincenales de péptidos MBP demostró una reducción significativa de las lesiones que realzan con el contraste en la resonancia magnética cerebral [8]. El efecto fue dependiente de la dosis y persistió durante la duración del tratamiento. La inyección intramuscular de un ADN que conduce a la expresión de la proteína MBP en las células musculares se probó en 267 pacientes. El estudio no alcanzó el criterio de valoración primario, pero pudo demostrar una reducción de las nuevas lesiones de RM [9]. El procedimiento se está aplicando actualmente en el tratamiento de la diabetes de tipo I. Un pequeño ensayo clínico de fase Ib con células dendríticas tolerogénicas ha confirmado la seguridad y tolerabilidad del procedimiento y ha mostrado pruebas de un efecto sobre las células inmunitarias autoreactivas [10]. En el procedimiento, se obtuvieron monocitos autólogos por leucaféresis y se cultivaron in vitro células dendríticas tolerogénicas (tolDC) cargadas con péptidos de mielina. Los tolDC se inyectaron por vía intravenosa en ocho pacientes con EM.
Además de la estrategia específica y la vía de administración, la selección y presumiblemente el número de antígenos a los que se dirige la terapia son importantes para el éxito del procedimiento. Una estrategia terapéutica que hemos seguido en los últimos años es la inyección intravenosa de células sanguíneas (leucocitos o eritrocitos) que han sido acopladas ex vivo en la superficie celular con péptidos. Este enfoque permite utilizar un mayor número de péptidos y, por tanto, inhibir la respuesta inmunitaria antígeno-específica simultáneamente contra varios antígenos. En modelos animales, resultó muy eficaz para prevenir tanto la aparición de la enfermedad (profiláctica) como su progresión (terapéutica), y la terapia tuvo éxito en varios modelos de enfermedad autoinmune, alergia y trasplante. Además, las células acopladas a antígenos son el único método que ha demostrado evitar la diversificación de la respuesta inmunitaria.
En un primer estudio de fase Ib en nueve pacientes con EM, se investigó la seguridad y tolerabilidad de las células mononucleares autólogas de sangre periférica acopladas ex vivo con siete péptidos de mielina de MOG (MOG1-20, MOG35-55), MBP (MBP1-32, MBP83-99, MBP111-129, MBP146-170) y PLP (PLP139-154) [11]. En general, la terapia fue muy bien tolerada y el curso de la EM se mantuvo estable. Además, en los estudios inmunológicos concomitantes, no se encontraron indicios de actividad inflamatoria tras la terapia y, en los pacientes que recibieron la dosis más alta, se pudo demostrar una reducción de las reactividades de las células T específicas del péptido. Estos resultados también se han confirmado recientemente con eritrocitos autólogos como células portadoras tolerogénicas y se han encontrado pruebas de un efecto positivo a nivel celular y humoral [Lutterotti et al. Congreso ECTRIMS, Estocolmo, 2019]. Actualmente se está llevando a cabo una ampliación de este ensayo de fase Ib. En el futuro, podrán añadirse al procedimiento péptidos adicionales de nuevos antígenos, lo que lo convertirá en el conjunto más completo de autoantígenos utilizados en un procedimiento de terapia antígeno-específica hasta la fecha.
Retos actuales y futuros
En la era de la medicina de precisión, las terapias antígeno-específicas se están convirtiendo de nuevo en el centro de los nuevos desarrollos terapéuticos. Esta tendencia también se ve respaldada por una mejor comprensión de la génesis autoinmune de la enfermedad y la identificación de nuevos antígenos diana.
Las nuevas tecnologías, como los enfoques basados en nanopartículas y células, se encuentran ya en las primeras fases de desarrollo preclínico y ampliarán la gama de opciones terapéuticas en el futuro. Un reto importante para la evaluación y la comparabilidad de los nuevos enfoques terapéuticos es la prueba biológica de la tolerancia inmunitaria inducida. Hasta la fecha, no existen métodos biomédicos estandarizados para confirmar una reducción de la respuesta inmunitaria autoreactiva a nivel celular o humoral tras la terapia. El desarrollo de pruebas para identificar y cuantificar las respuestas inmunitarias antígeno-específicas tras una terapia adecuada son un aspecto importante del desarrollo clínico y también deberían utilizarse para seleccionar y estratificar a los pacientes en los ensayos clínicos de terapias antígeno-específicas. Lo ideal sería seleccionar a los pacientes en función de su reactividad inmunitaria individual, medir la reducción de la respuesta inmunitaria específica tras el tratamiento y correlacionarla con la respuesta clínica. Además, es un aspecto de seguridad relevante excluir una activación del sistema inmunitario por la terapia, ya que esto podría conducir a un aumento de la actividad de la enfermedad [12].
Las terapias antígeno-específicas mejorarán el arsenal terapéutico para el tratamiento de la EM e idealmente deberían utilizarse en las fases iniciales de la enfermedad para evitar una mayor propagación de las respuestas inmunitarias autoreactivas. La buena tolerabilidad y el elevado perfil de seguridad del enfoque terapéutico constituyen una ventaja sobre las terapias inespecíficas actuales, especialmente en la fase inicial de la enfermedad. En el futuro, especialmente en los pacientes con una elevada actividad de la enfermedad, también debería investigarse la combinación de enfoques antígeno-específicos con las terapias estándar actuales, con el objetivo de lograr un control rápido de la inflamación y tratar únicamente con terapia antígeno-específica en el curso posterior. Esto puede evitar los riesgos a largo plazo de las terapias actuales.
Una cuestión esencial será si puede lograrse una tolerancia inmunológica a largo plazo, es decir, la eliminación completa de la autoreactividad incluso tras la interrupción de la terapia, o si debe administrarse una terapia antígeno-específica permanente para controlar la enfermedad. En cualquier caso, las terapias antígeno-específicas revolucionarían el tratamiento de la EM y otras enfermedades autoinmunes y supondrían un gran avance en medicina.
Mensajes para llevarse a casa
- Las terapias antígeno-específicas son un concepto terapéutico prometedor para el tratamiento de la esclerosis múltiple.
- El objetivo de las terapias antígeno-específicas es inhibir específicamente la respuesta inmunitaria autoreactiva y evitar los riesgos de la inmunosupresión global.
- La identificación de nuevos antígenos diana en la EM constituye una base importante para el desarrollo de terapias antígeno-específicas.
- Diferentes enfoques terapéuticos se encuentran ya en fases tempranas de desarrollo clínico y están mostrando un éxito inicial en cuanto a su eficacia.
Literatura:
- Lutterotti A, Martin R: Enfoques de toleración antígeno-específica en la esclerosis múltiple. Expert Opin Investig Drugs 2014; 23:9-20.
- Jelcic I, Al Nimer F, Wang J, et al: Las células B de memoria activan las células T CD4(+) autoreactivas que se dirigen al cerebro en la esclerosis múltiple. Cell 2018; 175: 85-100 e123.
- Planas R, Santos R, Tomas-Ojer P, et al: La GDP-l-fucosa sintasa es un autoantígeno específico de células T CD4(+) en pacientes DRB3*02:02 con esclerosis múltiple. Sci Transl Med 2018; 10.
- Sospedra M, Martin R: Inmunología de la esclerosis múltiple. Annu Rev Immunol 2005; 23: 683-747.
- Bielekova B, Sung MH, Kadom N, et al: Expansión y relevancia funcional de las células T CD4+ específicas de mielina de alta acidez en la esclerosis múltiple. J Immunol 2004; 172: 3893-3904.
- Walczak, A, Siger M, Ciach A, et al: Aplicación transdérmica de péptidos de mielina en el tratamiento de la esclerosis múltiple. JAMA Neurol 2013; 70: 1105-1109.
- Jurynczyk M, Walczak A, Jurewicz A, et al: Regulación inmunológica de la esclerosis múltiple mediante péptidos de mielina aplicados transdérmicamente. Ann Neurol 2010; 68: 593-601.
- Chataway J, Martin K, Barrell K et al. Efectos de la inmunoterapia ATX-MS-1467 durante 16 semanas en la esclerosis múltiple recidivante. Neurología 2018; 90: e955-e962.
- Garren H, Robinson WH, Krasulova E, et al: Ensayo de fase 2 de una vacuna de ADN que codifica la proteína básica de la mielina para la esclerosis múltiple. Ann Neurol 2008; 63: 611-620.
- Zubizarreta I, Florez-Grau G, Vila G, et al: Tolerancia inmunitaria en la esclerosis múltiple y la neuromielitis óptica con células dendríticas tolerogénicas cargadas de péptidos en un ensayo de fase 1b. Proc Natl Acad Sci U S A 2019; 116: 8463-8470.
- Lutterotti A, Yousef S, Sputtek A, et al: Tolerancia antígeno-específica mediante células autólogas acopladas a péptidos de mielina – Un ensayo de fase I en esclerosis múltiple. Science Translational Medicine 2013; 5: 188ra75.
- Bielekova B, Goodwin B, Richert N, et al: Potencial encefalitogénico del péptido de la proteína básica de la mielina (aminoácidos 83-99) en la esclerosis múltiple: resultados de un ensayo clínico de fase II con un ligando peptídico alterado. Nat Med 2000; 6: 1167-1175.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2019; 17(6): 10-13.