Para la mayoría de los pacientes con melanoma, hoy en día se dispone de terapias mucho más eficaces que hace unos años. Esto también se aplica al tratamiento adyuvante del melanoma. Se han establecido muchos enfoques terapéuticos nuevos, que se están investigando sucesivamente en el marco de estudios de mayor y menor envergadura. Esto incluye el análisis provisional presentado en la reunión anual del ADF de este año.
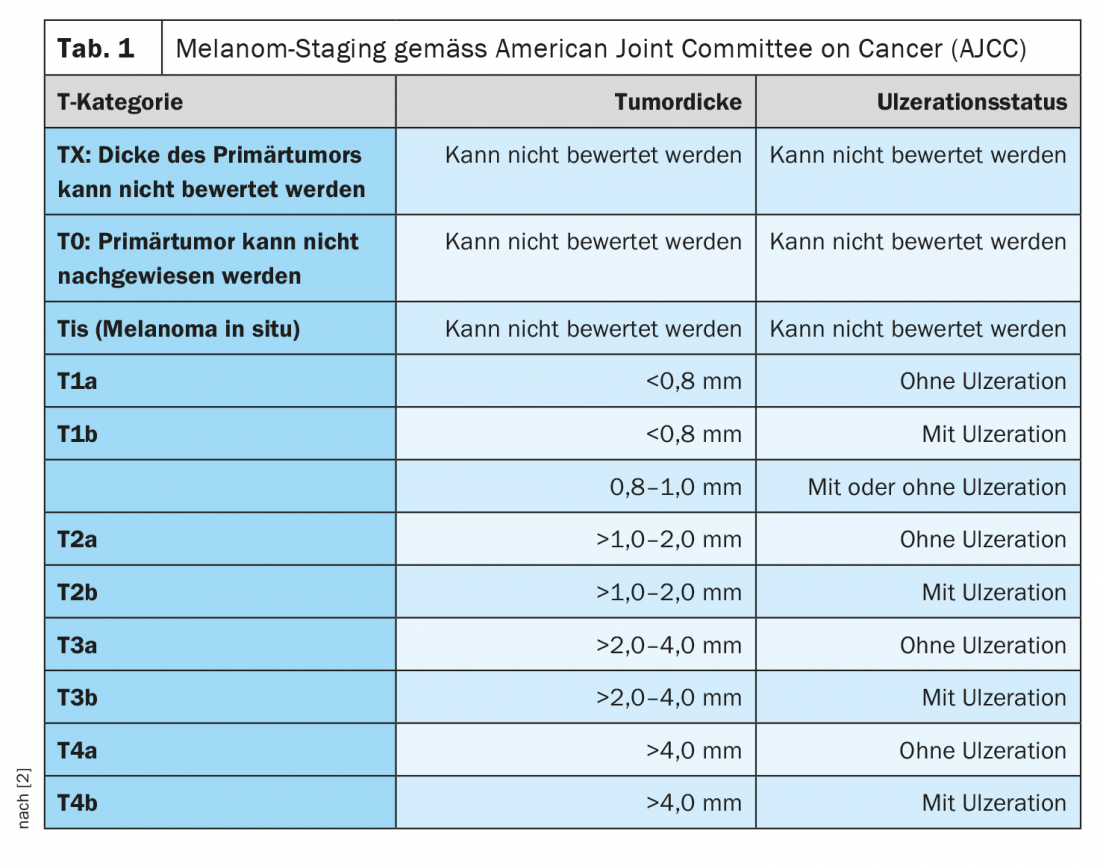
Se calcula que cada año unas 200.000 personas en todo el mundo desarrollan un melanoma maligno [1]. La incidencia ha aumentado de forma constante en las últimas décadas. La edad media de aparición es de unos 60 años en las mujeres y de 64 años en los hombres. La clasificación y estadificación del melanoma maligno se basa actualmente en la octava edición de la clasificación AJCC (Tab. 1) [2]. Además del grosor del tumor según Breslow, la presencia de ulceraciones y la afectación de los ganglios linfáticos se consideran criterios pronósticos importantes en el diagnóstico inicial [1]. Hasta hace unos años, el tratamiento estándar del melanoma avanzado y metastásico era paliativo, con una mediana de supervivencia de 6 a 12 meses. La quimioterapia era el tratamiento estándar. El lanzamiento de opciones de tratamiento altamente eficaces procedentes del campo de los inhibidores de los puntos de control, así como de los inhibidores de las cinasas dirigidas, como los inhibidores de BRAF y MEK, ha mejorado significativamente la esperanza de vida de los pacientes con melanoma completamente resecado.
Los inhibidores de los puntos de control fueron los pioneros, ¿y hoy?
Desde el lanzamiento del ipilimumab en 2011, se han logrado nuevos avances en el campo de la inmunoterapia para pacientes con melanoma. Con respecto al tratamiento adyuvante, esto está documentado, entre otros, por el ensayo KEYNOTE-054 [3], en el que el nivolumab mostró una ventaja significativa para la supervivencia libre de recidiva en comparación con el ipilimumab. Y en el ensayo Checkmate-238, el pembrolizumab demostró ser superior al placebo en términos de supervivencia libre de recaída [4]. La reducción del riesgo fue del 35% para nivolumab frente a ipilimumab y del 43% para pembrolizumab frente a placebo, respectivamente. El ensayo aleatorizado de nivolumab frente a ipilimumab también mostró una mejora significativa de la supervivencia libre de metástasis a distancia (CRI 0,73; IC del 95%: 0,55-0,95]. En cuanto al perfil riesgo-beneficio, la evaluación de la directriz actual de la AWMF es que, a pesar de un riesgo latente de efectos secundarios potencialmente graves, el beneficio de una reducción del riesgo habla a favor del uso de esta opción terapéutica. [5].
Los inhibidores de BRAF y MEK amplían el espectro de sustancias altamente eficaces
Para la terapia adyuvante con inhibidores de BRAF y MEK , la actual directriz S3 menciona, entre otras cosas, un ensayo de fase III aleatorizado, controlado y doble ciego de dabrafenib/trametinib llamada. Pacientes en estadios IIIA (diámetro mínimo en el ganglio linfático afectado >1 mm) a IIIC con un BRAFV600E o mutación V600K recibieron dabrafenib 150 mg 2× al día y trametinib 2 mg 1× al día, o un tratamiento placebo comparable, durante un total de 12 meses [6]. Tras una mediana de seguimiento de 2,8 años, la probabilidad de supervivencia libre de recaída a 3 años fue del 58% para el brazo de tratamiento y del 39% para el brazo de placebo (HR para recaída o muerte 0,47; IC 95%: 0,39-0,58; p<0,001). Según la evaluación de la actual directriz S3, se debe abogar por el uso de estas opciones terapéuticas a pesar de una tasa de interrupción relacionada con efectos secundarios relativamente alta en vista del beneficio demostrado: reducción del riesgo del 53% para la supervivencia libre de recidiva y del 43% para la muerte relacionada con el melanoma.
Resultados provisionales de un conjunto de datos interregionales de la región DACH
En la Reunión Anual de la ADF de este año, se presentaron datos de un análisis provisional de un estudio retrospectivo en el que pacientes con melanoma de Alemania, Austria y Suiza (DACH) recibieron pembrolizumab y nivolumab (anti PD-1) o dabrafenib/trametinib (inhibición de BRAF/MEK) como terapia adyuvante entre el 1/2017 y el 2/2020 [7]. En septiembre de 2020 se analizaron los datos de 524 pacientes de un total de 1039 participantes en el estudio. Se compararon las dos opciones de tratamiento adyuvante en términos de SLP a los 12 meses y otros parámetros de resultado relevantes.
Las características de los pacientes de las subpoblaciones tratadas con inhibición de BRAF/MEK frente a la terapia anti PD1 fueron comparables en cuanto a variables demográficas y características tumorales. La mayoría de los pacientes recibieron terapia adyuvante PD1 (n=439; 83,8%; Nivo=69,2%; Pembro=30,8%). El periodo medio de seguimiento fue de 13,1 meses. El intervalo de tiempo desde la resección completa hasta el inicio del tratamiento adyuvante fue de 2,5 meses (DE=1,55) para la inhibición de BRAF/MEK y de 2,7 meses (DE=2,62) para la terapia anti-PD1. La duración media de la terapia fue de 7,4 meses (DE=4,4) para ambos regímenes de tratamiento. Los análisis estadísticos mostraron una SLP a 12 meses del 81,2% para el subgrupo anti-PD1 y del 90,4% para los tratados con inhibición de BRAF/MEK (OR 2,001; IC 95%: 1,045-3,830; p=0,036). No hubo diferencias en la SLP entre los pacientes que recibieron nivolumab frente a pembrolizumab.
Tanto en el grupo de inhibición de BRAF/MEK como en el grupo de tratamiento anti-PD1, la ulceración, el mayor grosor del tumor y la mayor afectación de los ganglios linfáticos metastásicos fueron predictores negativos de la SLP. Los predictores positivos de una SLP más favorable fueron un mayor IMC (25-30) y el sexo masculino en pacientes que recibían tratamiento con inhibidores de BRAF/MEK. La SLP no difirió en función de la disección completa del ganglio linfático frente a la biopsia del ganglio linfático centinela.

El perfil de seguridad de todas las sustancias activas investigadas resultó ser comparable al de estudios anteriores. La tasa de acontecimientos adversos asociados al fármaco (AAFdr) y de acontecimientos adversos relacionados con el sistema inmunitario fue similar con nivolumab en comparación con pembrolizumab (64,2-63,7% y 33,3-33,8%, respectivamente). Entre los pacientes tratados con inhibición de BRAF/MEK, la proporción de drAE fue del 87% en este estudio. Los autores no proporcionan más información sobre el tipo de efectos secundarios. Está previsto realizar más análisis para averiguar más sobre las características de los pacientes y las características del tumor que se correlacionan con una respuesta favorable a la inhibición anti-PD1 frente a la inhibición BRAF/MEK como regímenes terapéuticos adyuvantes.
Congreso: Grupo de Trabajo sobre Investigación Dermatológica 2021
Literatura:
- Lamos C, Hunger RE: Inhibidores de puntos de control – indicación y uso en pacientes con melanoma [Checkpoint inhibitors-indications and application in melanoma patients]. Z Reumatol 2020;79(8): 818-825.
- Gershenwald JE, et al; para los miembros del Panel de Expertos en Melanoma del Comité Conjunto Americano sobre el Cáncer y la Plataforma Internacional de Bases de Datos y Descubrimiento del Melanoma. Estadificación del melanoma: cambios basados en la evidencia en el manual de estadificación del cáncer de la octava edición del Comité Conjunto Americano sobre el Cáncer. CA Cancer J Clin 2017; 67(6): 472-492.
- Weber J, et al: Nivolumab adyuvante frente a ipilimumab en melanoma resecado en estadio III o IV. N Engl J Med 2017; 377(19): 1824-1835.
- Eggermont AMM, et al: Pembrolizumab adyuvante frente a placebo en melanoma resecado en estadio III. N Engl J Med 2018; 378(19): 1789-1801.
- AWMF: Directriz S3 sobre el diagnóstico, tratamiento y seguimiento del melanoma Versión 3.3 – Julio 2020 Número de registro AWMF: 032/024OL
- Long GV, et al: Dabrafenib adyuvante más trametinib en el melanoma con mutación BRAF en estadio III. N Engl J Med 2017; 377(19): 1813-1823.
- Schumann K, et al.: P048 Tratamiento adyuvante del melanoma: datos reales de la región DACH, 47ª Reunión Anual de la Arbeitsgemeinschaft Dermatologische Forschung (ADF) Virtual, 04.03.-06.03.2021
- Schadendorf D, et al: Melanoma. Lancet 2018; 392: 971-984.
- Arozarena I, Wellbrock C: Superación de la resistencia a los inhibidores de BRAF. Ann Transl Med 2017; 5: 387
DERMATOLOGIE PRAXIS 2021; 31(4): 44-45 (publicado el 18.8.21; antes de impresión).