En Medidays, el programa de formación continua en medicina interna del Hospital Universitario de Zúrich (USZ), también se presentaron ponencias sobre diversos temas hematológicos. ¿Cómo se aclara la anemia de forma significativa? ¿Qué pacientes deben ser cambiados a nuevos anticoagulantes en la práctica? ¿Y de qué medidas terapéuticas se benefician los pacientes con leucemia linfocítica crónica?
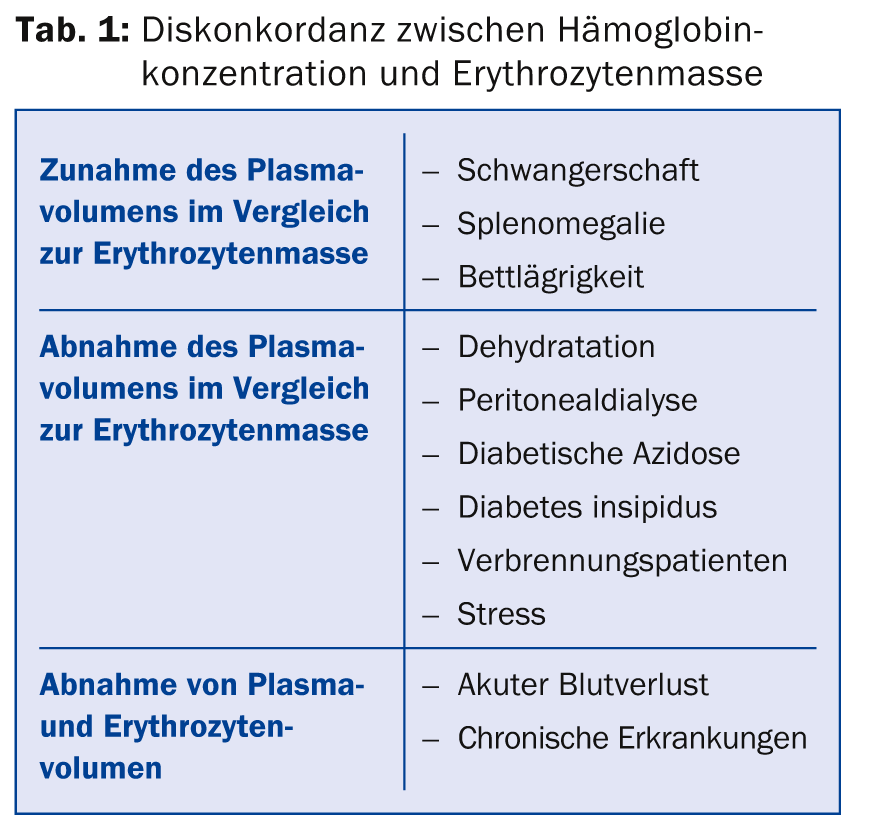
(ee) El Dr. med. Jeroen Goede, Médico Jefe a.i. de la Clínica de Hematología del Hospital Universitario de Zúrich, proporcionó información sobre el diagnóstico y el tratamiento de la anemia. Existen varias causas de discrepancia entre la concentración de hemoglobina y la masa eritrocitaria (Tab. 1). En principio, la concentración de hemoglobina depende de varios factores como la edad, el sexo, la raza y la altitud de residencia. Los valores de referencia para la anemia son <120 g/l en las mujeres, <110 g/l en el embarazo y <130 g/l en los hombres. El valor más bajo en las mujeres no se debe a la menstruación, sino a unos niveles más bajos de testosterona; cuando los niveles de testosterona disminuyen en los hombres a medida que envejecen, la concentración de hemoglobina también disminuye.
El diagnóstico diferencial de la anemia es muy diverso. Básicamente, se distingue entre la producción inadecuada de eritrocitos (por ejemplo, en la carencia de hierro o la alteración de la eritropoyesis normal en neoplasias malignas), el aumento de la degradación (por ejemplo, en prótesis de válvulas cardiacas, anemia hemolítica autoinmune, defectos de membrana, etc.), la pérdida de eritrocitos (hemorragia aguda o crónica) y la “pseudo” anemia (por ejemplo, en el embarazo). Unas pocas pruebas de laboratorio suelen bastar para el esclarecimiento inicial de la anemia (Tabla 2). Esto permite realizar el diagnóstico en aproximadamente dos tercios de todas las anemias.

El metabolismo del hierro es muy complejo. En el 99% de los casos, sin embargo, la determinación de la ferritina es suficiente para el diagnóstico de la anemia ferropénica; un estado completo del hierro suele ser innecesario. En caso de carencia de hierro, debe recomendarse a los pacientes una dieta rica en hierro (carne, yema de huevo, cereales con cáscara, soja, frutos secos, pan integral). La sustitución del hierro por vía oral con 200 mg/día de sulfato de hierro (durante 3 – 6 meses) sólo tiene sentido si el hierro también puede absorberse – por eso, por ejemplo, la sustitución del hierro debe realizarse por vía i.v. en caso de enfermedad celíaca. Sin embargo, los comprimidos de hierro suelen provocar molestias gastrointestinales.
La sustitución intravenosa por hierro puede realizarse hoy en día con mucha seguridad; los nuevos preparados con carboximaltosa de hierro (Ferinject®) resp. La sacarosa de hierro (Venofer®) ya no contiene dextrano y ya no provoca anafilaxia grave. No obstante, es obligatoria una indicación clara para la administración de hierro por vía intravenosa. Entre ellos se incluyen la intolerancia documentada a la administración oral de hierro, la malabsorción o el incumplimiento en el que no se puede influir. La trombocitosis leve (hasta 700 G/l) es frecuente con la carencia de hierro, pero suele desaparecer tras la sustitución.
Nuevos anticoagulantes orales
Desde hace unos años se dispone de nuevos anticoagulantes orales: el antagonista directo de la trombina dabigatrán (Pradaxa®) y los antagonistas directos del factor Xa rivaroxabán (Xarelto®), apixabán (Eliquis®) y -no disponible en Suiza- edoxabán (Lixiana®). El doctor Jan-Dirk Studt, médico jefe de la Clínica de Hematología del Hospital Universitario de Zúrich, presentó las posibles aplicaciones, así como sus ventajas e inconvenientes.
Todos los nuevos anticoagulantes orales (NOAK) están aprobados en Suiza para la profilaxis embólica en la fibrilación auricular. El rivaroxabán y el apixabán están aprobados además para la profilaxis del tromboembolismo venoso (TEV) en cirugía ortopédica mayor de cadera y rodilla, y el rivaroxabán puede utilizarse además para el tratamiento agudo del TEV y la profilaxis secundaria (sin administración previa de heparina de bajo peso molecular).
En pacientes con fibrilación auricular, los NOAK son ligeramente mejores que los antagonistas de la vitamina K en términos de eficacia y seguridad según los estudios actuales; en pacientes con TEV, ambas clases se consideran actualmente más o menos equivalentes. La tabla 3 enumera las indicaciones para la conversión. En principio, los NOAK tienen una seguridad y eficacia equivalentes a las de los “antiguos” anticoagulantes orales, y una ventaja significativa es el rápido inicio de su acción.

El Dr. Studt informó sobre el manejo de los NOAK en situaciones clínicas especiales:
- Procedimientos e intervenciones: Para la mayoría de los procedimientos, NOAK debe suspenderse al menos 24 horas antes de la intervención, para los procedimientos de alto riesgo (por ejemplo, procedimientos del SNC) 48 horas antes o más. En caso de insuficiencia renal, es necesario un plazo más largo.
- Anulación de los efectos: Aún no se dispone de antídotos específicos, por lo que la vida media comparativamente corta de las nuevas sustancias resulta ventajosa. En el caso del dabigatrán, la diálisis es aconsejable en el mejor de los casos; en el caso del rivaroxabán y el apixabán, la diálisis no es prometedora debido a la alta unión a proteínas.
- Hemorragia: En caso de hemorragia leve, el tratamiento sintomático es adecuado (terapia local, posiblemente posponiendo la siguiente dosis). En caso de hemorragia de moderada a grave, se interrumpe la ingesta y se ingresa al paciente en el hospital. La administración de protamina o vitamina K es ineficaz. Si es necesario, puede administrarse concentrado de complejo de protrombina o concentrado de complejo de protrombina activado.
- Válvulas cardíacas mecánicas: Para los pacientes con válvulas cardiacas protésicas mecánicas, los antagonistas de la vitamina K (AVK) siguen siendo la terapia estándar. Los resultados de los estudios que compararon el dabigatrán con los AVK fueron desfavorables para el dabigatrán. Actualmente, todos los NOAK están contraindicados en pacientes con válvulas protésicas mecánicas.
- Embarazo y lactancia: Los datos sobre el uso de los NOAK en el embarazo y la lactancia son muy limitados, por lo que actualmente todos los NOAK están contraindicados en mujeres embarazadas y lactantes. La heparina de bajo peso molecular sigue siendo la terapia estándar.
- Insuficiencia renal: Ninguno de los NOAK puede prescribirse en pacientes con insuficiencia renal grave (aclaramiento de creatinina <30 ml/min.) o necesidad de diálisis. En caso de insuficiencia renal leve, pueden ajustarse las dosis.
- La cuantificación del efecto NOAK es de interés en determinadas situaciones clínicas, por ejemplo antes de intervenciones -especialmente imprevistas-, en caso de traumatismo, hemorragia, insuficiencia renal, pacientes muy ligeros o muy pesados, sospecha de sobredosis o aparición de trombos bajo una terapia adecuada. No existe un intervalo objetivo como con los AVK o la heparina, y se dispone de pruebas específicas para la cuantificación de cada agente.
Leucemia linfocítica crónica
El Prof. Dr. med. Markus G. Manz, Director de la Clínica de Hematología del Hospital Universitario de Zúrich, habló sobre la leucemia linfocítica crónica (LLC). Esta leucemia, la más frecuente de todas, se da sobre todo en personas de edad avanzada (edad media en el momento del primer diagnóstico: 70 años). Debido al envejecimiento de la población, la incidencia de la LLC aumentará en el futuro. El 7% de todos los donantes de sangre sanos mayores de 45 años presentan linfocitosis monoclonal de células B (MBL) en su sangre periférica, pero cuando la MBL está presente, sólo alrededor del 1-2% al año evoluciona a LLC.
La dinámica de la LLC varía mucho de un paciente a otro: la enfermedad puede progresar rápidamente, pero también puede ser asintomática (hallazgo incidental). Los síntomas típicos son un descenso del rendimiento debido a la anemia, infecciones, estigmas hemorrágicos, síntomas B (fiebre, sudores nocturnos, pérdida de peso), inflamación de los ganglios linfáticos e hinchazón del hígado y/o el bazo. El diagnóstico se realiza a partir de la sangre periférica (linfocitos B monoclonales >5000/µl); normalmente no es necesaria una punción de médula ósea, pero puede ser útil en casos individuales, especialmente antes de iniciar la terapia. Siempre debe realizarse un esclarecimiento citogenético para diagnosticar las aberraciones cromosómicas de pronóstico desfavorable.
La LLC se clasifica según Binet (Tab. 4) o Rai, lo que es importante para estimar el pronóstico. En una fecha tan reciente como 1974, sólo el 5% de los pacientes con LLC sobrevivían al diagnóstico más de cinco años; esta situación ha cambiado significativamente al disponer de diversas opciones de tratamiento. Sin embargo, la LLC no puede curarse con terapias sistémicas. En la LLC asintomática, el paciente no recibe tratamiento porque actualmente no hay pruebas de que la terapia en la fase asintomática sea beneficiosa. Existe una indicación general de terapia en el estadio C de Binet o si existen síntomas angustiosos como inflamación de los ganglios linfáticos, el hígado y el bazo, síntomas B, anemia, etc.

La terapia estándar actual es la quimioterapia con fludarabina, ciclofosfamida y rituximab (FCR). Sin embargo, este esquema se desvía en función de la edad y el estado general del paciente, las comorbilidades (especialmente la insuficiencia renal) y las aberraciones cromosómicas. La combinación de bendamustina y rituximab ha demostrado ser menos tóxica pero también ligeramente menos eficaz que el régimen FCR. Por lo tanto, es más probable que esta combinación se utilice en pacientes mayores de 65 años. Para los pacientes con LLC refractaria o recidivante, también es posible el trasplante alogénico de células madre.
En julio de 2014, la Agencia Europea del Medicamento (EMA) recomendó los inhibidores de la tirosina quinasa ibrutinib e idelalisib (Zydelig®), así como el anticuerpo monoclonal anti-CD20 obinutuzumab (Gazyvaro®) para su aprobación en la indicación LLC. El ibrutinib puede prolongar significativamente la supervivencia, pero también se desarrollan resistencias.
El ponente llamó la atención sobre el hecho de que los elevados costes de los nuevos fármacos para el tratamiento de las leucemias crónicas suponen un reto para la sociedad: “El tratamiento de la hipertensión con enalapril cuesta unos 500 francos al año, el tratamiento de la LMC con imatinib 40.000 francos. A medida que la gente envejece y las leucemias crónicas se hacen más comunes, se plantea la cuestión de quién asumirá los costes de las costosas terapias.”
Fuente: Medidays, 3 de septiembre de 2014, Hospital Universitario de Zúrich
PRÁCTICA GP 2014; 9(11): 52-56