Los pacientes con embolia pulmonar necesitan anticoagulación durante al menos tres meses. Antes de iniciar la terapia, hay que tener en cuenta varias consideraciones: ¿Qué anticoagulante es el más adecuado para este paciente, cuál debe ser la duración de la anticoagulación? ¿Y cuál es la relación riesgo-beneficio?
La embolia pulmonar aguda se considera la manifestación más grave de la tromboembolia venosa (TEV). En la fase aguda y de mantenimiento, el objetivo de la terapia antitrombótica es evitar la progresión de la trombosis y disolver el material trombótico. En la fase inicial, la rutina clínica suele realizarse por vía parenteral utilizando heparina no fraccionada (HNF), heparinas de bajo peso molecular (HBPM) y fondaparinux.
Fase inicial
Las heparinas de bajo peso molecular y el fondaparinux son la terapia de elección para la anticoagulación parenteral inicial en pacientes que no están clasificados como de alto riesgo. En comparación con la HNF, la HNM y el fondaparinux ofrecen ventajas en términos de eficacia, seguridad y viabilidad, por ejemplo, un nivel de fármaco más estable y, por tanto, un efecto anticoagulante, una mayor eficacia, un menor riesgo de hemorragias graves o de trombocitopenia inducida por la heparina (TIH) y una vía de administración más sencilla mediante inyección subcutánea 1-2 veces al día. Estas ventajas compensan la desventaja de un inicio de acción ligeramente más lento. Como alternativa a la anticoagulación parenteral, la terapia con los inhibidores orales del factor Xa apixabán y rivaroxabán también puede considerarse para los pacientes que no sean de alto riesgo.
La situación es diferente para los pacientes hemodinámicamente inestables y con un riesgo muy alto de embolia. En estos casos, la anticoagulación terapéutica con HNF debe iniciarse inmediatamente, es decir, en cuanto se sospeche el diagnóstico, escriben el Dr. Matthias Ebner y la Dra. Mareike Lankeit de la Charité – Universitätsmedizin Berlin (D) [1]. Según el estudio, los pacientes con embolia pulmonar hemodinámicamente inestables corren el riesgo de sufrir una elevada tasa de mortalidad, sobre todo en las primeras horas. Según los científicos, la administración intravenosa en bolo de HNF (normalmente 5000 UI) es superior a las alternativas NMH y Fondaparinux administradas por vía subcutánea. Especialmente si hay centralización con perfusión tisular reducida en el shock obstructivo. Como infusión continua posterior, recomiendan una dosis inicial de 1000 UI por hora con el objetivo de prolongar entre 1,5 y 2,5 veces el tiempo parcial de tromboplastina (aPTT).
Fase aguda y de mantenimiento
Los antagonistas de la vitamina K (AVK) han sido durante mucho tiempo los preparados más utilizados para la anticoagulación terapéutica. Sin embargo, están limitados por factores como su estrecha ventana terapéutica, las interacciones medicamentosas y alimentarias y la necesidad de ajustar la dosis, incluida la monitorización (medición del INR). Una alternativa a los AVK son los anticoagulantes orales no dependientes de la vitamina K (NOAK), que incluyen el dabigatrán, el apixabán, el edoxabán y el rivaroxabán. En 2019, la Sociedad Europea de Cardiología (ESC), en colaboración con la Sociedad Respiratoria Europea (ERS), publicó su nueva directriz, según la cual los NOAK deben preferirse a los VKA para la anticoagulación oral de pacientes con embolia pulmonar (en ausencia de contraindicaciones). Entre las contraindicaciones de los NOAK se incluyen la insuficiencia renal grave, el deterioro de la función hepática, el embarazo o la lactancia y el síndrome antifosfolípido.
Actualmente, se dispone de diferentes estrategias para la terapia de anticoagulación oral de pacientes con embolia pulmonar, escriben los doctores Ebner y Lankeit: El régimen “tradicional” consiste en la anticoagulación dual solapada con NMH y el cambio solapado a un AVK (objetivo INR 2,0-3,0). Además, existe una terapia dual secuencial con NMH inicial durante al menos 5 días y cambio posterior a terapia con dabigatrán o edoxabán (en dosis de mantenimiento), así como monoterapia con rivaroxabán o apixabán (en cada caso en dosis inicial más alta). Según los expertos, una reducción de la dosis de NOAK sólo debe realizarse tras un examen crítico y de forma restrictiva en los primeros 6 meses tras una embolia pulmonar. En los pacientes con embolia pulmonar que también padecen cáncer, la anticoagulación debe continuar hasta que el cáncer se considere curado.
Profilaxis secundaria
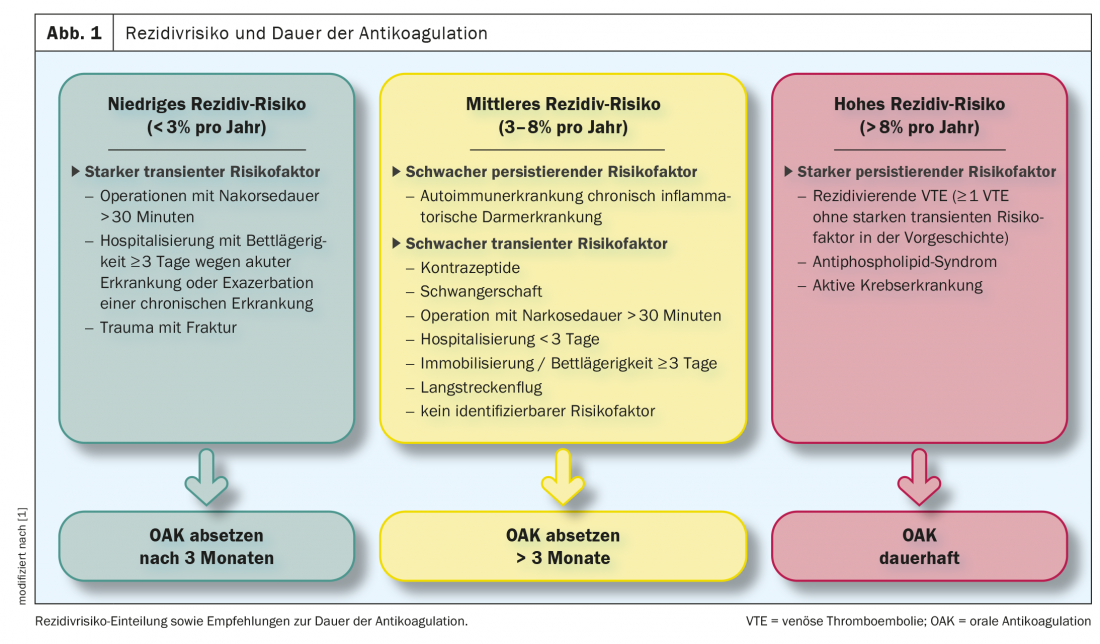
La profilaxis secundaria se utiliza para prevenir un nuevo tromboembolismo. En la directriz de la ESC de 2019 [2], los pacientes con embolia pulmonar se dividen en 3 grupos en función del riesgo de recurrencia. Grupos divididos (Fig.1). Por consiguiente, en los pacientes que presentaban un factor de riesgo transitorio/reversible importante en el momento de la aparición de la EP (por ejemplo, una operación de prótesis de cadera o rodilla o un traumatismo con fractura), el riesgo de recurrencia puede considerarse bajo y la anticoagulación puede suspenderse al cabo de 3 meses. Un riesgo medio de recurrencia con la consideración de continuar la anticoagulación indefinidamente (con evaluación periódica del riesgo-beneficio) se asocia a pacientes que tienen un factor de riesgo transitorio/reversible débil (por ejemplo, cirugía menor, vuelo de larga distancia), un factor de riesgo persistente débil (por ejemplo, enfermedades autoinmunes activas, enfermedad inflamatoria intestinal crónica) o para los que no puede identificarse ningún factor desencadenante. Los pacientes con alto riesgo de recurrencia y a los que se recomienda anticoagulación permanente tienen un factor de riesgo persistente fuerte (por ejemplo, cáncer activo, síndrome antifosfolípido o episodios recurrentes de TEV no explicados por factores de riesgo transitorios fuertes).
Literatura:
- Ebner M, Lankeit M: Terapia antitrombótica en la embolia pulmonar. DMW – Deutsche Medizinische Wochenschrift 2020; 145(14): 970-977; doi: 10.1055/a-0955-3379.
- Konstantinides SV, Meyer G, Becattini C, et al: 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS). Eur Heart J 2019; doi: 10.1093/eurheartj/ehz405.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2021; 3(1): 39-40