La Oficina Federal de Salud Pública (OFSP) y la Comisión Federal para Asuntos de Vacunación (ECIF) recomiendan la vacunación contra el herpes zóster con la nueva vacuna inactivada recombinante que consta de los dos componentes activos, la glicoproteína E (subinito del virus) y el AS01B (adyuvante), para las personas sanas a partir de los 65 años y para los pacientes con inmunodeficiencia a partir de los 50 años o con inmunodeficiencia grave a partir de los 18 años. Ahora está aprobado para su uso por las compañías de seguros médicos y está disponible en Suiza.
Con el aumento de la edad, el número y la funcionalidad de las células inmunitarias que impiden la reactivación del virus de la varicela-zóster (VVZ) disminuyen [2,6,7,9,10]. Esto provoca un aumento de la incidencia y la gravedad del herpes zóster. Cada año se producen en Suiza entre 17.000 y 30.000 casos de herpes zóster [2]. Alrededor del 99% de los adultos mayores de 50 años están infectados por el virus que causa el herpes zóster, y en una de cada tres personas el VVZ latente se reactiva y causa herpes zóster [2,3]. Ciertas afecciones preexistentes como la artritis reumatoide, la enfermedad intestinal inflamatoria crónica, la diabetes, la EPOC, el asma, el lupus eritematoso sistémico o la depresión también conllevan un mayor riesgo de herpes zóster. El riesgo de herpes zóster es mayor en las enfermedades que provocan una inmunodeficiencia grave, como el linfoma o el mieloma, y el riesgo es incluso 13 veces mayor durante la quimioterapia [2,5,6,11,12].
El herpes zóster y las complicaciones potencialmente graves
El herpes zóster es una enfermedad dolorosa que puede asociarse a complicaciones graves y duraderas, entre las que se incluyen la neuralgia posherpética (NPH) y el zóster oftálmico [2]. La NPH afecta hasta al 30% de los pacientes con herpes zóster y se caracteriza por dolor nervioso, que a veces dura años [2,4]. El zóster oftálmico afecta a alrededor del 20% de los pacientes con herpes zóster. Esto puede provocar complicaciones oftalmológicas y, en casos raros, ceguera [2,13]. La tasa de recurrencia del herpes zóster después de ocho años se estima en un 6,2% según Yawn et al. Las recidivas fueron más frecuentes en los individuos con dolor que duró >30 d y en los inmunodeprimidos. Debido a las tasas de recurrencia relativamente elevadas, también debe ofrecerse la vacunación a los pacientes que ya hayan padecido herpes zóster [14].
Prevención mediante una nueva vacuna recombinante inactivada
SHINGRIX® es la primera y única vacuna contra el herpes zóster que induce una respuesta inmunitaria fuerte y sostenida con una combinación de un antígeno recombinante y un sistema adyuvante [1,15–19]. El antígeno (glicoproteína E [gE]) desencadena una respuesta inmunitaria específica contra el VVZ. La gE se expresa en la superficie de las células infectadas por el VVZ y es crucial para la replicación del virus. El sistema adyuvante (AS01B) provoca un aumento de la respuesta inmunitaria al antígeno de la vacuna. Induce una respuesta inmunitaria antigE fuerte y sostenida. La combinación única de MPL y QS-21 potencia las respuestas inmunitarias tanto humorales como celulares contra gE* [1,17–22]. Esta propiedad también lo hace adecuado para pacientes inmunodeficientes o inmunodeprimidos [1].
* VZV = Virus varicela-zóster; MPL: 3-O-desacil-4′-monofosporil lípido A de Salmonella minnesota; QS-21: Fracción de saponina QS-21 del árbol de la corteza de jabón.
Perfil de eficacia y seguridad
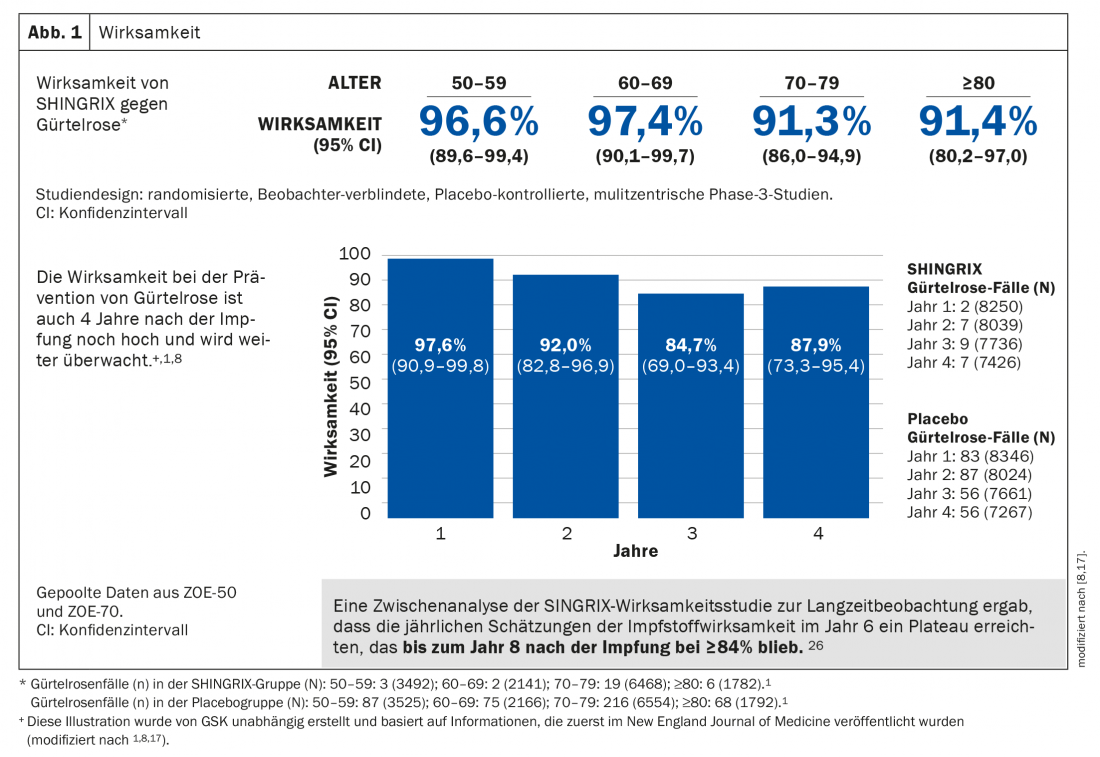
La vacuna de subunidades adyuvada mostró una eficacia superior al 90% en la prevención del herpes zóster en todos los grupos de edad a partir de los 50 años, manteniéndose en un nivel muy alto incluso después de más de siete años. Asimismo, el riesgo de desarrollar NPH se reduce significativamente (Fig. 1 ) [1]. La seguridad se ha investigado exhaustivamente en dos ensayos clínicos de fase 3 a gran escala. La mayoría de los acontecimientos adversos fueron de gravedad leve a moderada e incluyeron dolor, enrojecimiento e hinchazón en el lugar de la inyección. Los pacientes también pueden sufrir dolor muscular, fatiga, dolor de cabeza, escalofríos, fiebre o malestar estomacal. En los ensayos clínicos, estos efectos adversos duraron una mediana de 2 a 3 días [1,8,17].
Recomendación de vacunación BAG y EKIF
La vacunación contra el herpes zóster con dos dosis y un intervalo mínimo de 1-2 meses se da en dos categorías de recomendación [25]: A Recomendación suplementaria de vacunación: Se recomienda la vacunación a todas las personas inmunocompetentes de ≥65 años, independientemente de sus antecedentes individuales de varicela y herpes zóster. Se recomiendan dos dosis con un intervalo mínimo de dos meses.
B Recomendación de vacunación para dos grupos de riesgo definidos:
B1: Se recomienda la vacunación a todos los pacientes de edad ≥50 años con inmunodeficiencia actual o futura (especialmente celular) asociada a un mayor riesgo de herpes zóster. Se recomiendan dos dosis con un intervalo mínimo de dos meses.
B2: Se recomienda la vacunación a los pacientes de edad ≥18 años que padezcan actualmente una inmunodeficiencia grave o que estén recibiendo tratamiento inmunosupresor o vayan a recibirlo en un futuro próximo. La primera dosis debe administrarse idealmente ≥4 semanas antes de un inicio supuesto, esperado o planificado de inmunosupresión grave. La segunda dosis con un intervalo mínimo de uno a dos meses después de la primera dosis o tan pronto como sea posible en un momento posterior médicamente favorable durante o después de la terapia.
SHINGRIX® está destinado exclusivamente a la inyección intramuscular y sólo para uso profiláctico y no para el tratamiento de enfermedades clínicas confirmadas. La vacuna puede administrarse al mismo tiempo que una vacuna antigripal estacional no adyuvada, una vacuna antineumocócica polisacárida 23-valente (PPV23) o una vacuna antidiftérica-tétanos-tos ferina acelular con contenido reducido de antígeno (dTpa) (lugar de inyección diferente). La respuesta inmunitaria (2 dosis) no se vio afectada por la vacunación previa con una vacuna viva atenuada contra el HZ [1]. No se requiere un intervalo mínimo entre la vacunación con ARNm COVID y la administración de otras vacunas, como ocurre con todas las demás vacunas no vivas [24].
Fuente: GlaxoSmithKline AG
Literatura:
- Prospecto de Shingrix. www.swissmedicinfo.ch, consultado en octubre de 2021.
- Comisión Federal para Cuestiones de Inmunización (EKIF). Evaluación de la vacunación contra el herpes zóster según los criterios de análisis para las recomendaciones nacionales de vacunación en Suiza. 14 de diciembre de 2015; 1-34.
- Hillebrand K, Bricout H, Schulze-Rath R, et al: Incidencia del herpes zóster y sus complicaciones en Alemania 2005-2009. Journal of Infection 2015 Feb; Vol 70: 178-186.
- Kawai K, Gebremeskel BG, Acosta CJ: Revisión sistemática de la incidencia y las complicaciones del herpes zóster: hacia una perspectiva global. BMJ Open 2014 jun;4(6): e004833.
- Mahalingam R, Wellish M, Wolf W, et al: ADN viral de la varicela-zóster latente en los ganglios trigémino y torácicos humanos. N Engl J Med 1990 Sep; 323(10): 627-631.
- Weinberg A, Lazar AA, Zerbe GO, et al: Influencia de la edad y la naturaleza de la infección primaria en las respuestas inmunitarias mediadas por células específicas del virus de la varicela-zóster. J Infect Dis. 2010; 201(7): 1024-1030.
- Kimberlin DW, Whitley RJ: Vacuna varicela-zóster para la prevención del herpes zóster. N Engl J Med. 2007 Mar;356(13): 1338-1343.
- Cunningham AL, Lal H, Kovac M, et al: Eficacia de la vacuna de subunidades contra el herpes zóster en adultos de 70 años o más. N Engl J Med 2016 Sep; 375(11): 1019-1032.
- Levin MJ: Senescencia inmunitaria y vacunas para prevenir el herpes zóster en personas mayores. Curr Opin Immunol 2012 Ago; 24(4): 494-500.
- Patterson-Bartlett J, Levin MJ, Lang N, et al: Caracterización fenotípica y funcional de las respuestas ex vivo de las células T a la vacuna viva atenuada contra el herpes zóster. Vaccine 2007 oct; 25(41): 7087-7093.
- Lungu O, Annunziato PW, Gershon A, et al: Virus varicela-zóster reactivado y latente en los ganglios de la raíz dorsal humana. Proc Natl Acad Sci USA 1995 Nov; 92(24): 10980-10984.
- Furuta Y, Takasu T, Fukuda S, et al: Detección del ADN del virus de la varicela-zóster en los ganglios geniculados humanos mediante la reacción en cadena de la polimerasa. J Infect Dis 1992 Nov; 166(5): 1157-1159.
- Volpi A: Complicaciones graves del herpes zóster. Herpes 2007 Sep; 14 Suppl 2: 35-39.
- Yawn BP, Wollan P, Kurland MJ, et al: Las recurrencias del herpes zóster son más frecuentes de lo que se había informado anteriormente. Mayo Clin Proc. febrero 2011;86(2): 88-93.
- Chlibek R, Smetana J, Pauksens K, et al: Safety and immunogenicity of three different formulations of an adjuvanted varicella-zoster virus subunit candidate vaccine in older adults: a phase II, randomized, controlled study. Vaccine 2014 Mar; 32(15): 1745-1753.
- Bharucha T, Ming D, Breuer J: Una valoración crítica de “Shingrix”, una nueva vacuna de subunidad del herpes zóster (HZ/Su o GSK1437173A) para el virus de la varicela zóster. Hum Vaccin Immunother. 2017 Ago;13(8): 1789-1797.
- Lal H, Cunningham AL, Godeaux O, et al: Eficacia de una vacuna adyuvada de subunidades del herpes zóster en adultos mayores. N Engl J Med 2015 mayo; 372(22): 2087-2096.
- Schwarz TF, Volpe S, Catteau G, et al: Persistencia de la respuesta inmunitaria a una vacuna adyuvada de subunidades del virus de la varicela-zóster hasta el noveno año en adultos mayores. Hum Vaccin Immunother 2018 Jun; 14(6): 1370-1377.
- Merck Sharp & Dohme. Informe público europeo de evaluación de Zostavax, Anexo I: Resumen de las características del producto: EMA; [actualizado en enero de 2019; consultado en diciembre de 2020]. Disponible en: www.ema.europa.eu/en/documents/product-information/zostavaxepar-product-information_en.pdf.
- Lecrenier N, Beukelaers P, Colindres R, et al: Desarrollo de la vacuna recombinante adyuvada contra el zóster y sus implicaciones para la prevención del herpes zóster. Revisión experta de vacunas 2018; 17(7): 619-634.
- Dendouga N, Fochesato M, Lockman L, et al.: Respuestas inmunitarias mediadas por células a una vacuna de glicoproteína E contra el virus de la varicela-zóster utilizando un agonista TLR y QS21 en ratones. Vaccine. 2012 abr;30(20): 3126-3135.
- Leroux-Roels G, Marchant A, Levy J, et al: Impacto de los adyuvantes en las respuestas de las células T CD4(+) y las células B a una vacuna de antígenos proteicos: resultados de un ensayo de fase II, aleatorizado y multicéntrico. Clin Immunol 2016 ago; 169: 16-27.
- Administración de Alimentos y Medicamentos de EE.UU.; Comité Asesor de Vacunas y Productos Biológicos Relacionados. Documento informativo: Shingrix (Vacuna Zoster Recombinante, Adyuvada). 2017 [accessed December 2020]. Disponible en: www.fda.gov/media/107553/download.
- BAG: Vaccination recommendation for mRNA vaccines against Covid-19 (as of 14.09.2021), consultado en%20gegen%en Sept. 2021.
- FOPH: Nuevas recomendaciones para la vacunación contra el herpes zóster: vacuna SHINGRIX. Boletín BAG 47/2021;22: 9-15.
- Boutry C, et al.: The adjuvanted recombinant zoster vaccine confers long-term protection against herpes zoster: Interim results of an extension study of the pivotal phase III clinical trials (ZOE-50 and ZOE-70). Clin Inf Dis 2021: 1-30.
PRÁCTICA GP 2022; 17(3): 32-33