En los procesos inflamatorios de las enfermedades dermatológicas, pro-Las citoquinas inflamatorias desempeñan un papel central. Por lo tanto, están en el punto de mira enfoques terapéuticos cuando se trata de romper vías de señalización críticas. Además de los anticuerpos monoclonales, cada vez se utilizan más fármacos de moléculas pequeñas dirigidos contra las Janus quinasas (JAK). Los primeros inhibidores de JAK ya han sido aprobados para la dermatitis atópica y la psoriasis, pero los datos hasta la fecha también son prometedores para otras enfermedades inflamatorias de la piel como el vitíligo y la alopecia areata.
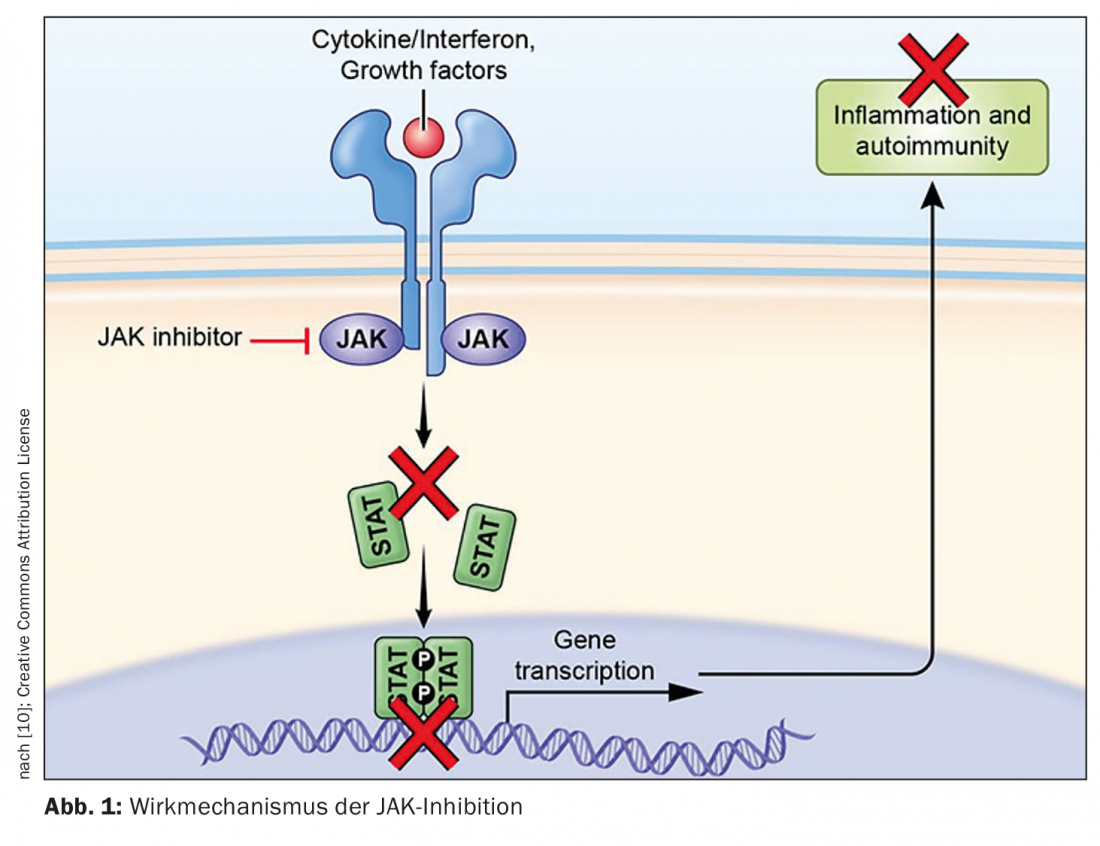
Los inhibidores de JAK son una valiosa adición a las estrategias de tratamiento sistémico de las enfermedades inflamatorias de la piel. “La vía de señalización JAK-STAT es una clave esencial en el tratamiento de las enfermedades inmunológicas e inflamatorias crónicas. Si conseguimos detener las cascadas de citoquinas proinflamatorias, esto tiene un efecto inmediato sobre la respuesta inflamatoria”, explica el Prof. Dr. med. Michael Hertl, presidente en funciones de la Sociedad Dermatológica Alemana (DDG) y director de la Clínica de Dermatología y Alergología de la Universidad Philipps y el Hospital Universitario de Marburgo [1]. Al ocupar los sitios de acoplamiento STAT, los inhibidores JAK inhiben la vía de señalización JAK-STAT y, por tanto, la cascada de señalización proinflamatoria (Fig. 1).
Se modulan vías específicas de señalización intracelular
La vía desregulada y activada de la Janus quinasa (JAK)-transductor de señales y activador de la transcripción (STAT) desempeña un papel clave en la patogénesis de muchas dermatosis inflamatorias. En las células humanas existen cuatro subunidades de las Janus quinasas (JAK): JAK1, JAK2, JAK3 y TYK2. La transducción de señales intracelulares de numerosas citoquinas proinflamatorias está mediada por las quinasas Janus. Tras la dimerización y la autofosforilación, se reclutan y fosforilan las proteínas STAT, que controlan la transcripción de los genes diana en el núcleo. Las Janus quinasas forman homo- o heterodímeros, por lo que la JAK2 también se presenta como homodímero [2]. La inhibición farmacológica de las JAK puede regular a la baja la actividad de la vía de señalización JAK-STAT, impidiendo la señalización intracelular de varias citoquinas proinflamatorias [1,2].
Los inhibidores JAK conquistan diversas áreas de indicación dermatológica
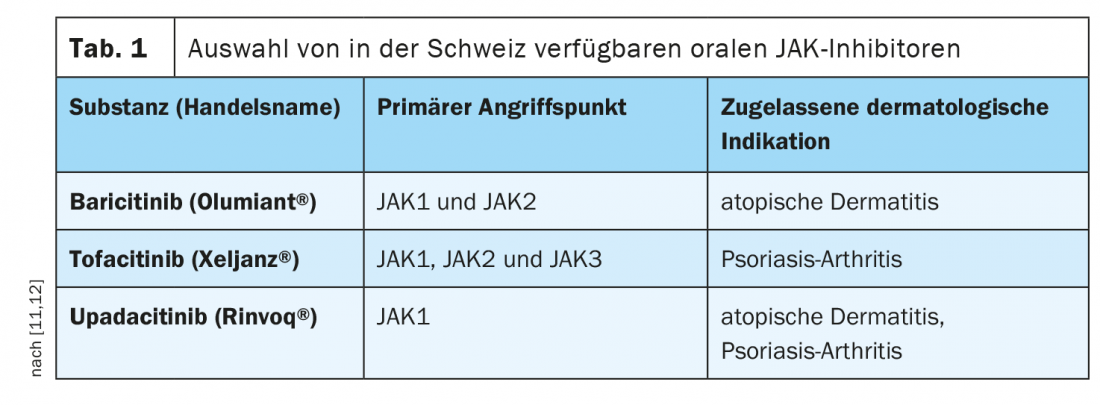
Para el tratamiento de pacientes adultos con dermatitis atópica de moderada a grave, el baricitinib (Olumiant®) fue aprobado en Suiza en el primer trimestre del año pasado como primer representante del grupo de inhibidores orales de JAK, y en noviembre el upadacitinib (Rinvoq®) también superó el obstáculo de la aprobación [4]. El baricitinib, en particular, muestra una gran potencia y selectividad para los subtipos JAK1 y JAK2, mientras que con el upadacitinib la JAK1 es la diana principal (Tabla 1) . Con el abrocitinib, un tercer representante de los inhibidores de la cinasa Janus ya ha sido aprobado en la UE para esta indicación [5]. El tofacitinib (Xeljanz®) en combinación con un DMARD sintético convencional está aprobado en Suiza para el tratamiento de adultos con artritis psoriásica activa. Además, en un estudio de fase II se demostró la eficacia de la inhibición de TYK2 con deucravacitinib-BMS986165 en comparación con placebo [6].
Los datos de los inhibidores JAK también parecen prometedores en lo que respecta a su uso en la alopecia areata. En un metaanálisis de 30 ensayos pequeños de inhibidores de JAK en la alopecia areata, el 72,4% de los pacientes respondieron a la terapia, de los cuales el 45,7% tuvo una buena respuesta (50-100% de crecimiento del cabello) y el 21,4% tuvo una respuesta parcial (5-50% de crecimiento del cabello) [7]. El ensayo ALLEGRO, doble ciego, aleatorizado y controlado, también investigó la eficacia de los inhibidores de JAK en mujeres y hombres con alopecia areata. Todos los participantes tenían más de un 50% de pérdida de cabello en el cuero cabelludo al principio. El tratamiento durante 24 semanas fue eficaz y bien tolerado: en comparación con el grupo placebo, los participantes en el grupo verum tuvieron una pérdida de cabello del 20% o menos [8]. El perfil de efectos secundarios de los inhibidores JAK es claro, explica el Prof. Hertl. Las infecciones pueden producirse con más frecuencia, por ejemplo en la zona de la nariz y la garganta o en las vías respiratorias. También se han observado infecciones del tracto urinario, molestias gastrointestinales y acné. “Si una infección es aguda, la terapia con inhibidores de JAK debe, por supuesto, pausarse”, afirma el presidente del DDG. Sin embargo, esto funciona muy bien debido a la aplicación oral y a la corta vida media de los fármacos, añade el experto [1]. Los últimos avances incluyen inhibidores de JAK de aplicación tópica. Un inhibidor de JAK 1/2 administrado en crema mejoró la piel facial enferma (repigmentación de las lesiones de vitíligo) en aproximadamente el 50% de los pacientes frente al 3% con placebo en el tratamiento del vitíligo autoinmune [9]. “Se trata de resultados prometedores que sugieren que esta crema podría ser una opción terapéutica eficaz para los pacientes con vitíligo”, subraya el Prof. Hertl y añade: “No se observaron los efectos secundarios conocidos de las pomadas de cortisona” [1].
Congreso: Dermatología compacta y práctica
Literatura:
- “Pequeñas moléculas contra la neurodermatitis, la psoriasis, el vitíligo y la caída circular del cabello: los inhibidores de JAK en las enfermedades inflamatorias de la piel amplían el espectro de tratamiento”, Deutsche Dermatologische Gesellschaft e. V. (DDG), 31.01.2022
- Schwartz DM, et al: La inhibición de JAK como estrategia terapéutica para las enfermedades inmunitarias e inflamatorias. Nat Rev Drug Discov 2017; 16: 843-862.
- Damsky W, et al: El papel emergente de los inhibidores de la cinasa Janus en el tratamiento de las enfermedades autoinmunes e inflamatorias. J Allergy Clin Immunol 2021; 147: 814-826.
- Información sobre medicamentos, www.swissmedicinfo.ch, (último acceso 07.03.2022)
- Klein B, Treudler R, Simon JC: Inhibidores JAK en dermatología: ¿pequeñas moléculas, gran efecto? Visión general del mecanismo de acción, resultados de estudios y posibles efectos adversos. J Dtsch Dermatol Ges 2022; 20(1): 19-25.
- Papp K, et al: Ensayo de fase 2 de la inhibición selectiva de la tirosina cinasa 2 en la psoriasis. N Engl J Med 2018; 379: 1313-1321.
- Phan K, Sebaratnam DF: Inhibidores JAK para la alopecia areata: una revisión sistemática y metaanálisis. J Eur Acad Dermatol Venereol 2019; 33: 850-856.
- King B, et al: Estudio de fase 2a aleatorizado y controlado con placebo para evaluar la eficacia y la seguridad de los inhibidores orales de la Janus quinasa ritlecitinib y brepocitinib en la alopecia areata: resultados a las 24 semanas. J Am Acad Dermatol 2021; 85(2): 379-387.
- Rosmarin D, et al: Crema de ruxolitinib para el tratamiento del vitíligo: un ensayo aleatorizado, controlado, de fase 2. Lancet 2020; 396: 110-120.
- Alexander M, et al: Jakinibs of All Trades: Inhibiting Cytokine Signaling in Immune-Mediated Pathologies. Farmacéutica 2022; 15(1): 48.
- Bonnekoh H, Butze M, Metz M: Caracterización de los efectos de las nuevas terapias para el tratamiento de la dermatitis atópica sobre el prurito. J Dtsch Dermatol Ges 2022; 20(2): 150-156,
- Karonitsch T: Importancia de los inhibidores JAK (“lo pequeño es hermoso”). J Miner Metabolism Musculoskeletal Diseases 2021; 28: 78-83.
DERMATOLOGIE PRAXIS 2022; 32(2): 30-31 (publicado el 20.4.22, antes de impresión).