El 21 de agosto de 2014 se celebró en el Inselspital de Berna un simposio sobre el ictus organizado por el Departamento Universitario de Neurología. Las primeras ponencias versaron sobre la estructura y la certificación de las unidades de ictus. Tras la pausa, los expertos informaron sobre diversos aspectos de la terapia del ictus. Informamos sobre seis de las nueve conferencias.
(ee) La unidad de urgencias neurológicas del Hospital Central Universitario de Helsinki atiende a un área de captación de 1,6 millones de habitantes (toda Finlandia: unos 5,5 millones de personas). El Prof. Dr. med. Turgut Tatlisumak, médico jefe del Centro de Accidentes Cerebrovasculares de Helsinki, mostró cómo pudo mejorar en su hospital el tiempo medio transcurrido desde el inicio de los síntomas hasta la trombólisis en pacientes con ictus. El objetivo de las medidas era lograr la recanalización en el mayor número posible de pacientes.
Las cadenas de rescate fuertes son importantes
La trombolisis debe realizarse en las primeras 4,5 horas tras el inicio de los síntomas, cuanto antes mejor. Este tiempo se divide en el tiempo “de inicio a puerta” (reconocimiento de los síntomas, llamada de urgencia, llegada al ambulatorio, evaluación del paciente, traslado al servicio de urgencias) y el tiempo “de puerta a aguja” (admisión del paciente, anamnesis y exploración, laboratorio, diagnóstico por imagen, evaluación de la indicación de trombolisis, obtención del consentimiento, inicio del tratamiento). Todos los eslabones de esta cadena deben optimizarse.
El profesor Tatlisumak subrayó que es muy importante que el tiempo puerta-aguja sea corto, aunque el paciente llegue rápidamente al hospital y teóricamente disponga de más tiempo para aclaraciones intrahospitalarias. En el Hospital Central Universitario de Helsinki, alrededor del 30% de los pacientes con ictus reciben trombólisis, y el tiempo puerta-aguja ha disminuido de tres horas en 1998 a una media de 20 minutos en la actualidad. Un neurólogo está presente en el hospital en todo momento para recibir al paciente con ictus y tomar posteriormente todas las decisiones hasta la trombolisis. Estos médicos asisten a cursos de formación especiales.
También deben tomarse medidas para el tiempo que pase fuera del hospital: información constante a la población sobre los síntomas y el procedimiento correcto en caso de sospecha de ictus, mayor formación de los paramédicos, organización de la cadena de rescate, etc. “Los pacientes con ictus sólo deben ser ingresados en hospitales que tengan acceso a una unidad de ictus las 24 horas del día”, exigió el ponente. Durante el transporte del paciente al hospital ya se realiza un valioso trabajo (establecer el acceso, realizar exámenes de laboratorio, controlar los parámetros vitales, averiguar los números de teléfono de los familiares, avisar al hospital, etc.).
En Alemania se están realizando ensayos en dos ciudades con unidades móviles de ictus, es decir, ambulatorios especiales equipados con TAC, laboratorio y personal formado. El objetivo es acercar la unidad de ictus -y, por tanto, la posibilidad de trombolisis- al paciente, en lugar del paciente a la unidad de ictus. Actualmente no está claro si esto reducirá a la mitad el tiempo hasta la trombólisis y mejorará el resultado de los pacientes.
Opciones de terapia endovascular para el ictus
El Prof. Jan Gralla, MD, Neurorradiología, Inselspital Bern, habló de las diferentes terapias endovasculares. En todos ellos, el objetivo es restaurar la perfusión cerebral, preservar las funciones cerebrales de la penumbra y conseguir así un déficit neurológico menor para el paciente. Dependiendo del procedimiento, se abren diferentes ventanas temporales: 4,5 horas para la lisis i.v., seis horas para la lisis intraarterial y ocho horas para la trombectomía mecánica. Un problema de la lisis i.v. es que no se disuelven los trombos grandes (>8 mm) en vasos grandes. Estos trombos son susceptibles de trombectomía mecánica, que, sin embargo, tampoco es fácil de realizar porque los vasos cerebrales son estrechos y discurren de forma muy tortuosa.
En los procedimientos de trombectomía, se distingue entre la trombectomía distal (la cesta se despliega detrás del trombo) y el procedimiento más moderno con stent retriever (el stent se coloca paralelo al trombo y se despliega, retirándose posteriormente con el trombo). Con el procedimiento de recuperación del stent, las tasas de recanalización son elevadas (hasta el 80%) con buenos resultados para los pacientes. El procedimiento también es rápido: por término medio, se tarda entre 25 y 45 minutos desde la sutura inguinal hasta la recanalización. En la actualidad existen en el mercado muchos recuperadores de endoprótesis diferentes. Sin embargo, su eficacia aún no ha sido demostrada mediante ensayos controlados aleatorios.
La cuestión sigue abierta en cuanto a qué procedimiento debe utilizarse para tratar a los pacientes que pueden ser tratados en las 4,5 horas siguientes al inicio de los síntomas. Las tres opciones disponibles se presentaron en tres estudios en el NEJM en febrero de 2013, y no hubo diferencias en términos de eficacia. Sin embargo, estos estudios tenían varios puntos débiles, señaló el ponente. En estos momentos está en marcha el ensayo SWIFT-PRIME, en el que los pacientes son tratados con lisis i.v. o con lisis i.v. seguida de recanalización mecánica. Sin embargo, las condiciones iniciales también son decisivas para el resultado. El profesor Gralla lo expresó de la siguiente manera: “Sólo se puede salvar lo que aún está ahí” y así subrayó una vez más la importancia de una cadena de rescate optimizada.
Fibrilación auricular, anticoagulación e ictus
El Prof. Dr. med. Heinrich Mattle, del Inselspital de Berna, proporcionó información sobre la correlación entre la fibrilación auricular (FA) y el ictus. La mayoría de los pacientes con FVC son atendidos por primera vez por el internista, por ejemplo debido a hipertensión o insuficiencia cardiaca. “Sólo” alrededor del 10% sufre un ictus o un accidente isquémico transitorio (AIT) como primer síntoma. Los pacientes con ictus y FHV son de media más mayores que los pacientes con ictus sin FHV y presentan infartos territoriales con mayor frecuencia. La anticoagulación reduce el riesgo de ictus en dos tercios. La indicación de anticoagulación se evalúa mediante la puntuación CHA2DS2-VASc. Los nuevos anticoagulantes (dabigatrán, rivaroxabán, apixabán) funcionan mejor que la warfarina para la prevención de los ictus hemorrágicos. El dabigatrán reduce el riesgo de ictus mejor que el marcoumar® y provoca menos efectos secundarios hemorrágicos.
El profesor Mattle respondió a algunas preguntas prácticas sobre la anticoagulación para el ictus:
- ¿Cuándo iniciar la anticoagulación tras un AIT o un ictus? Los pacientes reciben aspirina (no heparina) durante las dos primeras semanas. Después, se aplica la regla “1-3-6-12”: En el caso de un AIT, la anticoagulación comienza inmediatamente (día 1), en el caso de un infarto leve a los tres días, en el caso de un infarto moderado a los seis días y en el caso de un infarto grave a los 12-21 días.
- ¿Deben combinarse la anticoagulación y los antiagregantes plaquetarios? No se recomienda la terapia triple debido al riesgo relativamente alto de hemorragia. Sin embargo, la anticoagulación más los antiagregantes plaquetarios (el clopidogrel es el que mejor funciona en los estudios) es útil, incluso para los pacientes coronarios con stents.
- ¿Debe reanudarse la anticoagulación tras una hemorragia cerebral? En principio, hay que conocer la causa de la hemorragia para tomar una decisión al respecto. Si hay una hemorragia profunda en el cerebro, la anticoagulación puede iniciarse de nuevo al cabo de 10-14 días. Para evitar nuevas hemorragias, mantenga el INR <3, baje la tensión arterial y no combine antiagregantes plaquetarios. Para las hemorragias superficiales, el riesgo de hemorragia con anticoagulación puede ser demasiado grande, pero faltan pruebas.
- ¿Deben anticoagularse los pacientes con cavernomas? Si el paciente no ha sangrado, se puede anticoagular, ya que el riesgo de hemorragia es pequeño. Sin embargo, si el cavernoma ha sangrado, existe un riesgo significativo de nuevas hemorragias; en estos pacientes, el cavernoma debe extirparse quirúrgicamente antes de la anticoagulación.
- ¿Deben anticoagularse los pacientes neuroquirúrgicos? Diez semanas después de un hematoma subdural o una craneotomía, estos pacientes reciben uno de los nuevos anticoagulantes. En el periodo anterior, los pacientes son tratados con heparina.
- ¿Se puede anticoagular a los pacientes con alto riesgo de caídas? El riesgo de caídas suele sobrestimarse y, por lo general, el beneficio de la anticoagulación es mayor que el riesgo de hemorragia tras una caída. Un estudio suizo descubrió que las hemorragias graves y potencialmente mortales no son más frecuentes en los pacientes con caídas que en otras personas. Un estudio reciente muestra que en pacientes con una puntuación de 0-3 en la puntuación CHADS, el riesgo de la anticoagulación es mayor que el beneficio; sin embargo, la anticoagulación debe administrarse a partir de una puntuación de cuatro en la puntuación CHADS.
- ¿Qué deben hacer los pacientes con contraindicaciones para la anticoagulación? Deben ser aclaradas por un cardiólogo, ya que el cierre de la orejuela auricular puede ser posible y útil.
¿Existe el ictus criptogénico?
Si las investigaciones estándar para encontrar la causa de un ictus (ECG, ECG de 24 horas, eco, diagnóstico por imagen, laboratorio, etc.) son negativas, se postula un ictus criptogénico (en aproximadamente el 20-40% de los pacientes con ictus). PD Dr. med. Simon Jung, Berna, recomendó que sería mejor utilizar el término “ictus embólico de causa indeterminada”, ya que con aclaraciones prolongadas se podría detectar una causa en la mayoría de estos pacientes (Fig. 1).
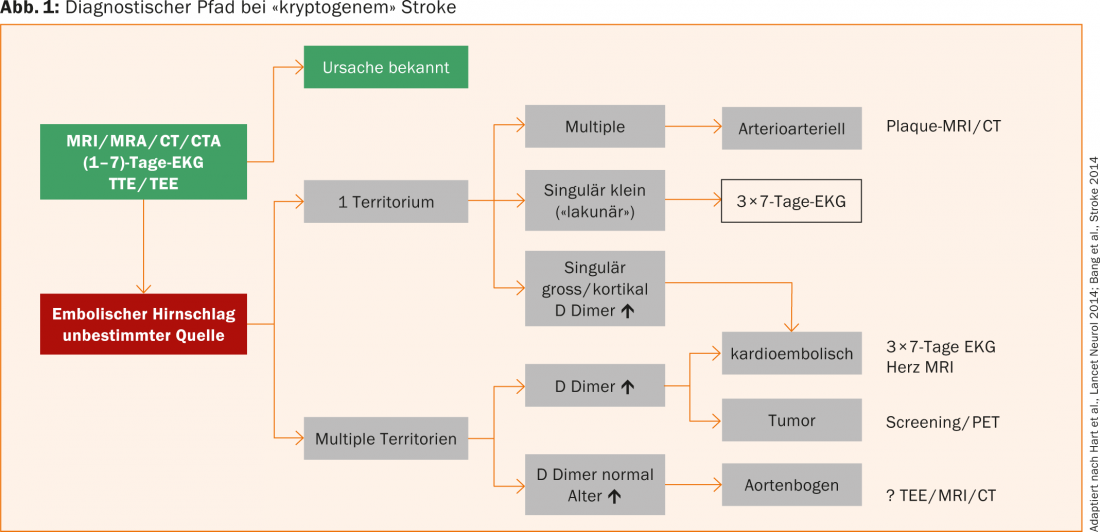
En primer lugar, se distingue si la lesión o lesiones isquémicas afectan a uno o varios territorios. Las isquemias múltiples en un territorio son sospechosas de un evento arterioarterial, incluso en presencia de placas estenosantes hemodinámicamente no significativas. En estos pacientes, resulta útil la búsqueda de la placa inestable con RM/TC. En caso de infartos singularmente grandes o de localización cortical o en caso de distribución sobre varios territorios y en caso de D-dímeros marcadamente elevados, una génesis cardioembólica es probable y debe buscarse con insistencia. Estudios recientes demuestran que la detección de VHF intermitente aumenta con el tiempo de grabación. Por lo tanto, se recomienda realizar un ECG de 7 días y repetirlo dos veces si es negativo.
Si varios territorios están afectados por lesiones isquémicas y los dímeros D están elevados, debe considerarse un trastorno de la coagulación asociado al tumor además de una etiología cardioembólica. Con lesiones en múltiples territorios y dímeros D normales, puede haber placas en el arco aórtico, normalmente en pacientes que tienden a ser mayores. El diagnóstico se realiza mediante ecocardiografía transesofágica, resonancia magnética o tomografía computarizada.
La ampliación de los diagnósticos puede reducir significativamente la proporción de pacientes con una causa desconocida de ictus, lo que también se traduce en un cambio relevante de la terapia para la mayoría de estos pacientes (por ejemplo, anticoagulación o terapia tumoral).
Gestión de la presión arterial en el ictus agudo
“Tras un ictus isquémico, la tensión arterial está elevada en la mayoría de los pacientes”, afirma el PD Dr med Urs Fischer, del Inselspital de Berna. “El 81% de los pacientes tienen una presión sistólica >140 mmHg. El mecanismo que subyace al aumento de la presión arterial no está claro”. Entre las causas que se sospechan están la alteración de la autorregulación cerebral, los factores neuroendocrinos, la desregulación debida a la muerte del tejido cerebral, el estrés psicológico, etc. En algunos casos, el aumento de la tensión arterial es también la causa del ictus. La presión arterial tras un ictus tiene un componente pronóstico: cuanto más baja o más alta sea la presión, peor será la suerte del paciente (curva en forma de U).
La cuestión de si se debe bajar la tensión arterial y en qué medida es controvertida. Según el estudio SCAST, no hay diferencias en los resultados si se reduce o no la presión arterial. Sin embargo, en este estudio se evaluaron conjuntamente las hemorragias y las isquemias, lo que resulta problemático. En el estudio CATIS de 2013, solo se examinaron pacientes con ictus isquémicos. Una vez más, no hubo diferencias globales en los resultados. Sin embargo, el tiempo de seguimiento fue sólo de 14 días, por lo que no puede hacerse ninguna afirmación sobre los efectos a largo plazo de la reducción de la presión arterial en la fase aguda. En la fase subaguda, sin embargo, es probable que se pueda bajar la tensión arterial sin dañar al paciente.
El estudio COSSACS intentó responder a la pregunta de si los antihipertensivos deben pausarse en el ictus agudo. También en este caso, el destino de los pacientes no dependía de parar o detenerse. de continuar con el tratamiento de la hipertensión, pero el estudio tenía muy poca potencia para hacer una afirmación definitiva. Al menos los resultados sugieren que se puede continuar con la medicación para la tensión arterial en el ictus agudo, lo que tiene sentido ya que los pacientes a menudo sufren también una enfermedad cardiaca. En principio, las directrices de la AHA se aplican a la reducción de la tensión arterial tras un ictus isquémico: reducción de la tensión arterial en un 15% como máximo y sólo para valores sistólicos >220 mmHg o diastólicos >120 mmHg.
En caso de hemorragia cerebral, a menudo se teme que el hematoma aumente con la hipertensión. En el estudio INTERACT, la presión arterial se redujo por debajo de 140 mmHg en caso de hemorragia intracraneal. Esta medida fue segura, pero no hubo mucha diferencia en el destino en comparación con el grupo de pacientes sin reducción de la presión arterial. El ponente interpretó los resultados con cautela: “Reducir la presión arterial probablemente no sea perjudicial y posiblemente conduzca a una mejora de la suerte clínica – sin embargo, esto sólo se aplica a las hemorragias cerebrales con un volumen de hematoma pequeño.”
Hasta ahora, muchos ensayos aleatorios sobre la presión arterial y el ictus presentan importantes deficiencias metodológicas. En futuros estudios que investiguen el potencial de la reducción de la presión arterial en el ictus cerebral, deberán tenerse en cuenta otros factores como la penumbra, la presión arterial premórbida, el lugar de oclusión del vaso, etc., y sólo deberán incluirse pacientes con un cuadro clínico coherente (isquemia o hemorragia).
Tratamiento de la hemorragia intracerebral
“Desgraciadamente, apenas hay pruebas de nada en el tratamiento de la hemorragia intracerebral”. Así introdujo su conferencia el Dr. Jürgen Beck, del Inselspital de Berna. Las hemorragias intracerebrales son más frecuentes en las personas mayores. Se recomienda reducir la presión arterial de los pacientes a 160 mmHg (180 mmHg para la presión intracraneal). Sin embargo, el estudio INTERACT demostró que no había diferencias en el resultado o la incidencia de nuevas hemorragias entre los pacientes con una reducción agresiva de la presión arterial (<140 mmHg) y los pacientes sin reducción de la presión arterial.
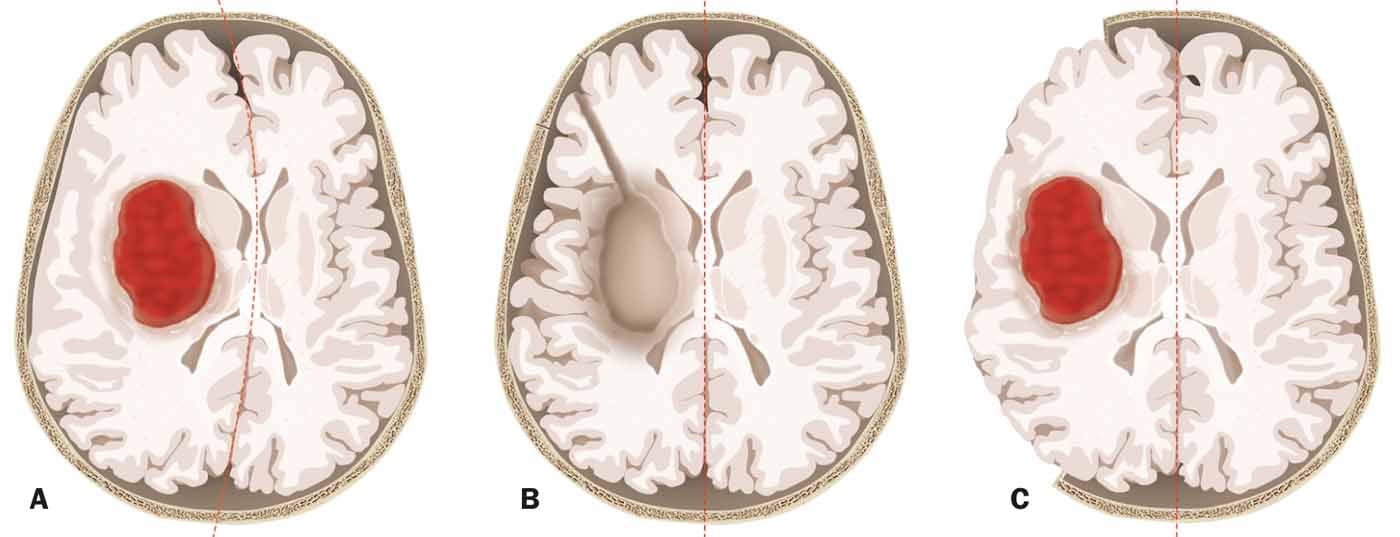
Tampoco hay pruebas para la extirpación quirúrgica de la hemorragia. En el estudio STICH, la extirpación del hematoma no tuvo ningún efecto positivo en todos los pacientes. En el subgrupo de pacientes en coma profundo, ¡la cirugía incluso aumentó el riesgo de un mal resultado! Existe una tendencia a que la cirugía mejore el resultado sólo en hemorragias superficiales y lobares y en pacientes con una puntuación de 9-13 en la escala de Glasgow (es decir, pacientes que no están totalmente despiertos pero no en coma profundo). La extensión de la hemorragia también influye: en el caso de hemorragias profundas con un volumen de >30 ml, los pacientes apenas tienen posibilidades de sobrevivir.
El ponente hizo hincapié en que, al extirpar una hemorragia, el propio procedimiento también suele poner en peligro al paciente. A diferencia de las operaciones de tumores, por ejemplo, también es probable que se dañe el parénquima cerebral funcional durante la extracción de una hemorragia en una situación de emergencia. Una alternativa es la craniectomía descompresiva, que preserva el parénquima (Fig. 2) . Existen pruebas de que las craniectomías para la hemorragia cerebral pueden reducir la mortalidad. Un nuevo estudio suizo (SWITCH) tiene previsto investigar si una craniectomía puede no sólo reducir la mortalidad sino también mejorar los resultados. Es de esperar que el reclutamiento de los primeros pacientes pueda comenzar este año.

Fuente: Simposio sobre la apoplejía, 21 de agosto de 2014, Berna