Los nuevos descubrimientos en biología e inmunología tumoral, así como en patología molecular, han impulsado rápidamente el desarrollo de anticuerpos inmunomoduladores y de las llamadas terapias “dirigidas” [1]. Esto convierte la terapia del melanoma avanzado en un reto interdisciplinar. Por ello, el tratamiento moderno del melanoma avanzado es cada vez más personalizado y se basa también en el estado de mutación del tumor.
La resección quirúrgica sigue siendo una opción válida para las metástasis en órganos solitarios y, al igual que la perfusión de las extremidades con citostáticos e interferón-α, puede proporcionar una supervivencia sin recaídas a largo plazo. Diversas quimioterapias, especialmente para melanomas sin una mutación a la que dirigirse terapéuticamente, incluyen por ejemplo la dacarbacina, la vinblastina, el cisplatino, el taxol y la bleomicina, ocasionalmente también el tamoxifeno como terapia hormonal. Las tasas de respuesta moderadas se producen a expensas de la toxicidad, sin afectar significativamente a la supervivencia global. La temozolomida, un alquilano con una tasa de respuesta comparable a la de la dacarbazina, puede utilizarse a menudo para las metástasis cerebrales debido a su penetrabilidad en el líquido cefalorraquídeo (LCR), aunque menos del 10% de los pacientes presentan una respuesta objetivable a esta terapia.
Inmunoterapias
Debido a la naturaleza antigénica e inmunogénica del melanoma maligno, se han realizado durante mucho tiempo diversos intentos terapéuticos con sustancias inmunomoduladoras. Además de las vacunas peptídicas (a menudo con adyuvante de oligonucleótidos CpG), se están probando citocinas (por ejemplo, IL-2 recombinante) y se están desarrollando procedimientos de inmunoterapia como la transferencia adoptiva de células T con TIL (linfocitos infiltrantes de tumores) y linfocitos de sangre periférica (PBL) o células T “de ingeniería” modificadas genéticamente (“receptor de antígeno quimérico” y TCR). Las altas dosis de IL-2 (y la combinación de IL-2 con gp100) produjeron remisiones duraderas en un pequeño número de pacientes, pero se han establecido principalmente en EE.UU. [2]. En la actualidad, se están llevando a cabo diversos estudios sobre la transferencia adoptiva de células T y células modificadas con TCR, así como sobre el bloqueo de los puntos de control.
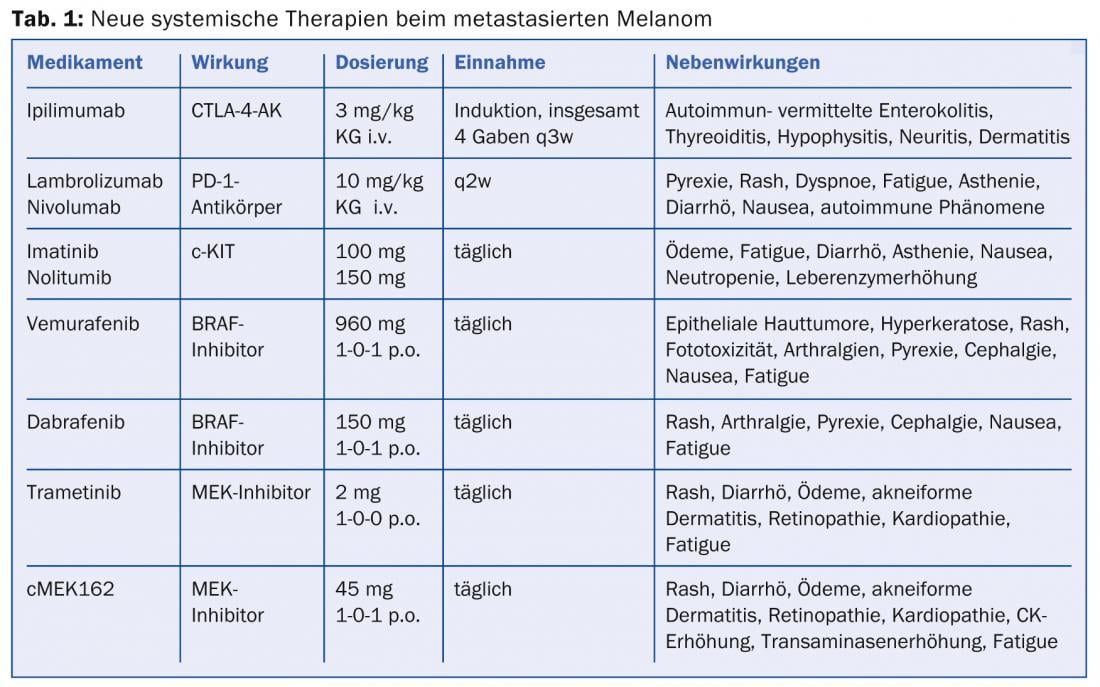
Anticuerpos CTLA-4: El método de bloqueo de los puntos de control (por ejemplo, el bloqueo CTLA-4) ha permitido desarrollar con éxito nuevas dianas para la terapia inmunomoduladora. El antígeno 4 asociado a los linfocitos T citotóxicos (CTLA-4) compite con el CD28 por la unión a las células presentadoras de antígenos, lo que provoca la inhibición de las señales costimuladoras para la activación de las células T. Sin embargo, cuando se bloquea el CTLA-4 mediante un anticuerpo monoclonal IgG1 humano específico como el ipilimumab, se libera un “freno” de las células de defensa del propio organismo y se potencia la respuesta tumoral mediada por células T. Ipilimumab (Yervoy®) fue el primer anticuerpo dirigido contra CTLA-4 que demostró una supervivencia significativamente prolongada en combinación con una vacuna peptídica gp100 (mediana de supervivencia 10,1 frente a 6,4 monte del control de la vacuna) y está aprobado por la EMA para el tratamiento del melanoma metastásico desde 2011 [3]. Asimismo, la combinación de dacarbacina con el bloqueo de CTLA-4 dio lugar a remisiones completas duraderas (tasa de supervivencia a 3 años de aprox. el 20%) y, a pesar de una tasa de respuesta baja (aprox. el 15%), ofrece por primera vez la perspectiva de una supervivencia a largo plazo. Dado que la respuesta al ipilimumab sólo puede producirse doce semanas después del inicio de la terapia y que el fármaco induce a veces efectos secundarios inmunomediados graves, es un inconveniente que ningún marcador pronóstico haya hecho posible aún la selección de pacientes. Por lo tanto, es importante el diagnóstico precoz y el tratamiento rápido de los efectos secundarios de la enterocolitis, la hepatitis, la tiroiditis, la hipofisitis, la neuritis y la dermatitis autoinmunes comunes (tab. 1).
Anticuerpos PD-1 y PD-L1 (PD-1 y PD-L1-AK): Con el objetivo de optimizar aún más la respuesta inmunitaria endógena contra las células tumorales, recientemente se han desarrollado anticuerpos que inhiben el receptor inhibidor de la “muerte programada 1” (PD-1) en la superficie de las células T activadas. Si la proliferación de las células T se ve inhibida por la unión del ligando PD-1 al receptor PD-1 de la célula T, los anticuerpos anti-PD-1 lambrolizumab y nivolumab, en fase de ensayo desde 2013, pueden revertir esta restricción de la “fase efectora”. Los resultados de los estudios iniciales con nivolumab mostraron una respuesta notable en el 31% de los pacientes con melanoma pretratados [4]. De forma similar al bloqueo CTLA-4, los anticuerpos anti-PD-1 también inducen remisiones estables con un número significativamente menor de efectos secundarios relacionados con la autoinmunidad. Además, suele observarse una respuesta pocas semanas después del inicio de la terapia, y se sospecha que la expresión del ligando PD-1 en la superficie de las células tumorales es un posible biomarcador predictivo. El lambrolizumab, así como los anticuerpos directos contra el ligando PD-1 (PD-L1-AK) se encuentran actualmente en fase de pruebas clínicas. El uso simultáneo de anticuerpos bloqueantes de CTLA-4 y PD-1 también muestra efectos sinérgicos.
Terapia dirigida basada en el estado de la mutación
Los métodos moleculares y los análisis mutacionales han revelado varias interfaces para el tratamiento innovador del melanoma metastásico en la última década. La mutación más común (aproximadamente el 50%) en las células del melanoma es una mutación puntual en el gen codificador de la quinasa BRAF. El BRAF es una quinasa importante en la vía de señalización MAPK (“proteína quinasa activada por mitógenos”) y es en parte responsable de la proliferación y el crecimiento de las células tumorales. Las mutaciones activadoras del gen BRAF V600 conducen a la sobreactivación de esta vía de señalización, lo que provoca un crecimiento celular excesivo. Las mutaciones de NRAS, una quinasa situada por debajo de BRAF, también están presentes en hasta el 20% de los pacientes con melanoma y, al igual que BRAF, provocan un empeoramiento del pronóstico. Otra mutación bastante rara con consecuencias terapéuticas se refiere a la tirosina quinasa c-KIT, que se da predominantemente en los melanomas mucosos y acrales. Los pacientes con una mutación c-KIT en el exón 11 o 13 responden mejor al tratamiento con un inhibidor de la cinasa c-KIT como el imatinib o el nilotinib (ensayo TEAM). Los efectos secundarios habituales de la terapia son edema, fatiga, diarrea, pérdida de apetito, náuseas, neutropenia y elevaciones de las enzimas hepáticas.
Inhibidores BRAF
La denominada mutación V600 BRAF también se identificó como terapéuticamente predictiva en el 40-50% de los tumores. El primer inhibidor de BRAF probado clínicamente, el vemurafenib (Zelboraf®), dio lugar a elevadas tasas de respuesta de 5,6 respondedores completos en pacientes sin tratamiento con una mutación V600E confirmada. 51,3% de remisiones parciales y una mediana de supervivencia global de 13,2 meses (actualización del estudio BRIM-3) [5]. La respuesta clínica suele presentarse como una rápida reducción del tumor, aunque meses más tarde suelen aparecer resistencias debido a la reactivación de la vía MAPK o a la regulación al alza de vías alternativas.
Otro inhibidor de BRAF es el dabrafenib (Tafinlar®), que ya ha sido aprobado (ensayo BREAK-3) para el tratamiento de primera línea en el melanoma no resecable o metastásico BRAF V600E-positivo [6,7]. El hecho de que se observe una respuesta tumoral eficaz bajo dabrafenib en una gran proporción de pacientes afectados durante una media de ocho meses mejora tanto la calidad de vida como significativamente el tiempo de supervivencia esperado y representa una nueva experiencia en el tratamiento del melanoma avanzado. El estudio BREAK-MB también demostró que los pacientes con metástasis cerebrales experimentan al menos una duplicación del tiempo de supervivencia, por lo demás muy corto, mediante el tratamiento con dabrafenib. Entre los riesgos derivados del uso de los inhibidores de BRAF se incluye en ocasiones la reaparición de tumores cutáneos, por lo que los pacientes deben someterse a un seguimiento periódico para detectar la aparición de dichos tumores. Otros efectos secundarios como las toxicidades cutáneas y de las mucosas, las infecciones, los cambios en el ECG y los electrolitos y los cambios en la glucemia pueden hacer necesaria la interrupción del tratamiento. También está indicada la precaución en combinación con fármacos que afecten a la actividad de las enzimas CYP3A4 o CYP2C8 y al pH gástrico, así como la administración concomitante de warfarina o digoxina.
Inhibidores de MEK
Como uno de los sitios centrales de conmutación en la cadena de señalización MAPK, y situada corriente abajo de RAS-RAF, la quinasa MEK (isoformas MEK1/2) puede activarse tanto por mutaciones como por factores de crecimiento autocrinos. Se ha demostrado que el inhibidor altamente selectivo de MEK1/2 trametinib mejora significativamente la supervivencia libre de progresión (SLP: 4,8 frente a 1,5 meses) y la supervivencia global en pacientes con una mutación BRAF V600E o V600K en comparación con la quimioterapia (estudio METRIC) [8]. Hasta ahora, no se han observado carcinomas de células escamosas con trametinib, como suele ocurrir con los inhibidores de BRAF. En otro estudio, el trametinib también mostró un efecto eficaz en melanomas con mutaciones raras de BRAF [9]. Otro inhibidor potente y selectivo de MEK1/2, el cMEK162, se encuentra actualmente en un ensayo de fase II. Los resultados iniciales del cMEK162 en pacientes de melanoma no tratados con melanoma con mutación BRAF o NRAS mostraron unos resultados comparativamente buenos para ambos grupos (SLP de 3,7 frente a 3,6 meses), por lo que por primera vez parece posible un enfoque terapéutico también para los pacientes cuyos tumores presentan una mutación NRAS [10].
Combinación de inhibidores de BRAF y MEK
Debido al desarrollo observado de resistencia, ahora también se ha probado la combinación de un inhibidor de BRAF con un inhibidor de MEK en un ensayo de fase I/II. Tras un estudio inicial de determinación de dosis, a los pacientes con una mutación V600 se les administró dabrafenib 150 mg 2× diarios. más trametinib 1 mg o 2 mg al día. o, a modo de comparación, dabrafenib como monoterapia (150 mg 2× diarios) [11]. La combinación con la dosis más alta de trametinib mostró una SLP significativamente prolongada de 3,6 meses en comparación con la monoterapia con dabrafenib, con un 41% de pacientes en el brazo de combinación aún libres de progresión después de 12 meses. Los efectos secundarios más frecuentes (71%) fueron pirexia (38,5°) y escalofríos con la combinación de dosis altas (tabla 1) . Estos efectos secundarios se produjeron con un 66% menos de frecuencia con la monoterapia con dabrafenib. Como se esperaba, también se formaron menos tumores cutáneos secundarios con la terapia combinada.
PD Dr. med. Andreas Trojan
Literatura:
- Dummer R, et al: Melanoma cutáneo: directrices de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimiento; Grupo de trabajo de directrices de la ESMO. Ann Oncol 2012 Oct; 23 Suppl 7.
- Smith FO, et al: Tratamiento del melanoma metastásico con interleucina-2 sola o junto con vacunas. Clin Cancer Res 2008; 14(17): 5610-5618.
- Hodi FS, et al: Mejora de la supervivencia con ipilimumab en pacientes con melanoma metastásico. N Engl J Med 2010; 363(8): 711-723.
- Topalian SL, et al: Supervivencia, remisión tumoral duradera y seguridad a largo plazo en pacientes con melanoma avanzado que reciben nivolumab. J Clin Oncol 2014 abr 1; 32(10): 1020-1030.
- McArthur GA, et al: Seguridad y eficacia del vemurafenib en el melanoma con mutación BRAF(V600E) y BRAF(V600K) positiva (BRIM-3): seguimiento ampliado de un estudio de fase 3, aleatorizado y abierto. Lancet Oncol 2014 Mar; 15(3): 323-332.
- Ascierto PA, et al: Ensayo de fase II (BREAK-2) del inhibidor de BRAF dabrafenib (GSK2118436) en pacientes con melanoma metastásico. J Clin Oncol 2013 Sep 10; 31(26): 3205-3211.
- Hauschild A, et al: Dabrafenib in BRAF-mutated metastatic melanoma: a multicentre, open-label, phase 3 randomised controlled trial. Lancet 2012 Jul 28; 380(9839): 358-365.
- Flaherty KT, et al: Mejora de la supervivencia con la inhibición de MEK en el melanoma con mutación de BRAF. N Engl J Med 2012; 367(2): 107-114.
- Kim KB, et al: Estudio de fase II del inhibidor de MEK1/MEK2 trametinib en pacientes con melanoma cutáneo metastásico mutante de BRAF tratados previamente con o sin un inhibidor de BRAF. J Clin Oncol 2013; 31(4): 482-489.
- Ascierto PA, et al: MEK162 for patients with advanced melanoma harbouring NRAS or Val600 BRAF mutations: a non-randomised, open-label phase 2 study. Lancet Oncol 2013; 14(3): 249-256.
- Flaherty KT, et al: Inhibición combinada de BRAF y MEK en el melanoma con mutaciones BRAF V600. N Engl J Med 2012; 367(18): 1694-1703.
CONCLUSIÓN PARA LA PRÁCTICA
- Con la aprobación del ipilimumab (Yervoy®) y el vemurafenib (Zelboraf®), la investigación inmunológica y molecular se trasladó con éxito a la clínica.
- El ipilimumab suele dar lugar a remisiones duraderas con una tasa de respuesta significativamente menor.
- Prometedores en el campo de las sustancias inmunomoduladoras, los anticuerpos anti-PD-1, así como las combinaciones de anticuerpos anti-CTLA-4 y anti-PD-1, están siendo probados clínicamente.
- A pesar del rápido inicio de acción y las elevadas tasas de respuesta, los inhibidores de BRAF suelen desarrollar resistencias, contra las que podrían utilizarse con éxito en el futuro combinaciones con, por ejemplo, inhibidores de MEK.
A RETENIR
- Con la autorización para comercializar ipilimumab (Yervoy®) y vémurafénib (Zelboraf®), la investigación inmunológica y molecular se ha aplicado con éxito a la clínica.
- L’ipilimumab permet des rémissions souvent prolongées avec un taux de réponse nettement plus faible.
- En el campo de las sustancias inmunomoduladoras, los anticuerpos anti-PD-1 y las combinaciones de anticuerpos anti-CTLA-4 y anti-PD-1 se están probando clínicamente con gran éxito.
- A pesar de la rápida aparición del efecto y de las elevadas tasas de respuesta, la resistencia se desarrolla con frecuencia con los inhibidores de BRAF, por lo que las combinaciones con inhibidores de MEK, por ejemplo, podrían utilizarse eficazmente en el futuro.
PRÁCTICA DERMATOLÓGICA 2014; 24(3): 16-20