El uso de pruebas multigénicas se limita actualmente a la situación adyuvante en el carcinoma luminal de mama HER2 negativo y permite realizar predicciones reproducibles del riesgo de recidiva. Las pruebas conducirán a un menor número de quimioterapias en un futuro próximo. Sin embargo, las quimioterapias adyuvantes innecesarias ya pueden evitarse con la aplicación coherente de los criterios actuales de St. Gallen o las directrices de la ESMO. Los estudios prospectivos con OncotypeDX y MammaPrint estarán disponibles en los próximos años, pero no ponen a prueba estos métodos frente a las herramientas anteriores como sería deseable. Deben utilizarse métodos de ensayo moleculares para la aprobación o la asunción de costes se someta a los mismos criterios y reclamaciones que los medicamentos. La cobertura de los costes por parte de las aseguradoras sanitarias obliga a una aplicación crítica sin extrapolaciones a situaciones no probadas: En mujeres de bajo riesgo o con contraindicaciones claras para la quimioterapia, debe prescindirse de ella.
Un metaanálisis basado en datos de 6.200 pacientes con cáncer de mama no pudo demostrar ningún beneficio para la supervivencia de la quimioterapia adyuvante de dosis alta con trasplante autólogo de células madre [1]. En el Inselspital, once pacientes fueron tratados de este modo entre 1997 y 1999 como parte del estudio IBCSG-15-95. En el editorial del metaanálisis se hace referencia a los descubrimientos actuales sobre biología que conducirían a tratamientos eficaces y menos arriesgados. La frase final “Recordamos con gratitud a las mujeres que se inscribieron voluntariamente en los ensayos clínicos que nos proporcionaron estos logros” demuestra que se sobrestimó la eficacia de la quimioterapia y que desde entonces se ha producido un cambio de actitud. En el metaanálisis sorprende el año de publicación: 2011. Esto se debe a que los datos de unas 100.000 mujeres con cáncer de mama muestran que la quimioterapia adyuvante reduce las recidivas en un 8% en diez años, la mortalidad por cáncer de mama en un 6,5% y la mortalidad global en un 5% [2]. En la comparación directa permitida aquí, el tamoxifeno es más eficaz: el riesgo de recaída se reduce en un 13,2% a lo largo de 15 años, la mortalidad por cáncer de mama en un 9,2% y la mortalidad global en un 9,5%. Sin embargo, el mayor efecto se reserva para las pacientes con tumores sensibles a las hormonas [3].
Tipos intrínsecos de cáncer de mama y marcadores sustitutos
Los perfiles de expresión génica identificaron hace más de diez años cuatro grupos de carcinoma de mama con diferente evolución clínica y respuesta terapéutica (“subtipos intrínsecos”):
- Tumores con receptores hormonales (RH) positivos con baja agresividad (Luminal A)
- Tumores con RH positivo y mayor agresividad (Luminal B)
- Tumores HER2 positivos (HER2+)
- Carcinomas HR- y HER2-negativos con o sin características de células basales (basal- y normal-like, triple-negativo) [4].
Los análisis posteriores mostraron que los cuatro grupos simplifican la realidad. El grupo más heterogéneo es el tipo Luminal A con una resistencia relativa a la quimioterapia [5,6]. Hay que aclarar de inmediato que estos métodos utilizaban varios miles de genes y no deben confundirse con las pruebas multigénicas que se discuten aquí. Dado que las primeras no están disponibles en la rutina, se buscaron definiciones sustitutivas (Tab. 1).

Los subtipos intrínsecos de carcinoma de mama, basados en la determinación de los receptores de estrógeno (RE) y progesterona (RP), la proliferación (Ki67) y HER2 (inmunohistoquímica o FISH), se incluyeron en el Consenso de St Gallen de 2011 [7]. Debido a la importancia predictiva de la respuesta a las terapias disponibles (hormonoterapia y quimioterapia, así como terapias dirigidas a HER2), estos subtipos han constituido desde entonces la base de las recomendaciones para la terapia adyuvante; anteriormente, estas recomendaciones se habían basado principalmente en la evaluación del pronóstico con factores no biológicos (tamaño del tumor, número de ganglios linfáticos afectados).
El quid de la definición sustitutiva: carcinomas luminales A y luminales B
Una paciente de cáncer de mama quiere saber si se beneficiará o no de una determinada terapia. A diferencia de los carcinomas triple negativos y de la mayoría de los HER2+, la cuestión con respecto a la quimioterapia en el cáncer de mama luminal es cómo identificar a las afectadas que se beneficiarán de esta terapia, además de la hormonoterapia. La proliferación es un factor predictivo y se utiliza para distinguir entre carcinomas de tipo luminal A y carcinomas de tipo luminal B (Tab. 1) . Sin embargo, la proliferación es una variable continua, que requiere un valor umbral para su aplicación clínica. Después de que este valor para definir el tipo Luminal B-like fuera del 14% en el Consenso de St Gallen de 2011 (es decir, Ki67 >14% = Luminal B-like), se elevó al 20% en 2013 y al 20-30% en 2015 con el 36% de los votos [6]. En la votación de 2015, el 20% de los presentes se abstuvo, y la misma proporción del panel de expertos negó a Ki67 la justificación de esta distinción [6].
A pesar de los esfuerzos internacionales, la determinación de Ki67 aún no se ha estandarizado. La reproducibilidad no pudo mejorarse ni siquiera tras las discusiones entre 15 patólogos suizos [8]. Sin embargo, se logró una concordancia muy buena en el rango bajo (<10%) y alto (>30%). El Ki67 tiñe las células en las fases G1, S, G2 y M del ciclo celular, lo que además de aspectos técnicos (definición de positividad, selección de fracciones tumorales) puede explicar los resultados discrepantes. A pesar de la intensa promoción de las pruebas multigénicas comerciales y del atractivo de las técnicas modernas, es deseable realizar más estudios en este campo.
Las pruebas multigénicas no son comparables
Varias pruebas saltaron a este vacío con un gran potencial de mercado. Se mencionan en el Consenso de San Gall desde 2011 y ya se han incluido en varias directrices. Para una visión general, consulte el artículo de la doctora Patrizia Sager (InFo ONKOLOGIE & HÄMATOLOGIE 2/2015). En los modelos multivariantes, las pruebas cuantifican la positividad del RH y la proliferación.
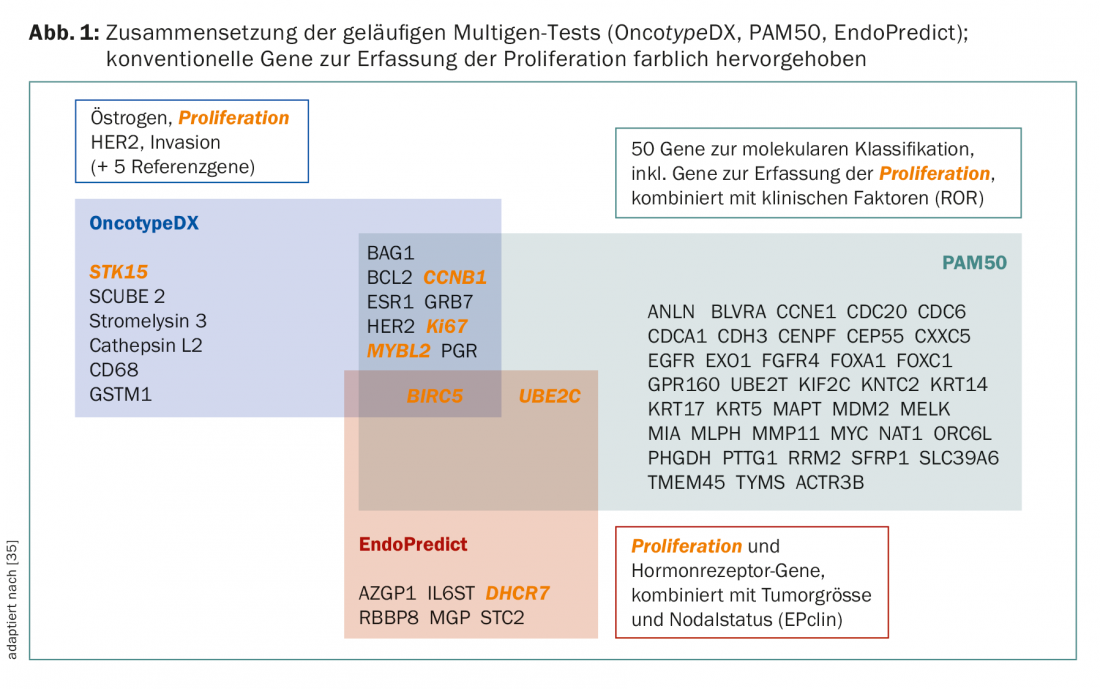
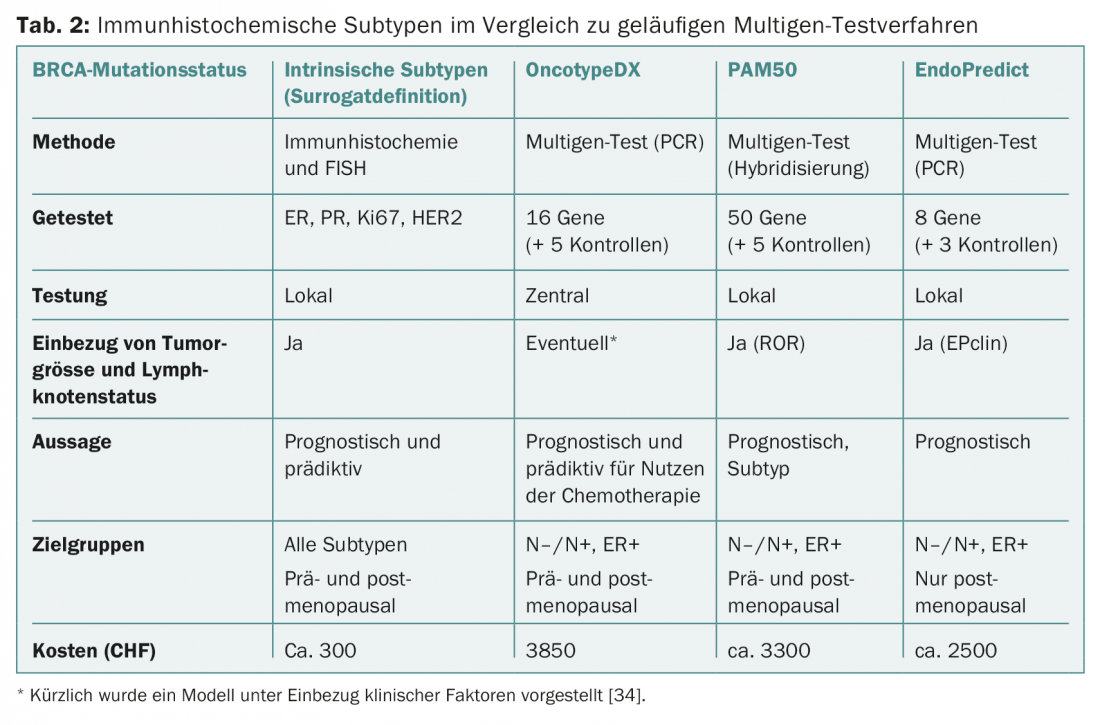
Aunque las pruebas persigan en principio el mismo objetivo, siguen sin ser conceptualmente comparables. Existen diferencias en los conjuntos de genes y los casos primarios para el desarrollo y la validación (Fig. 1 y Tab. 2) . Por ejemplo, el PAM50 incluye genes para los cánceres ER+/- y refleja los tipos intrínsecos [9], mientras que el OncotypeDX se compiló para predecir el beneficio de la quimioterapia en los cánceres ER+ [10]. MammaPrint mide el riesgo de recurrencia en pacientes no tratadas [11,12]. Los factores clínicos influyen en el resultado final de PAM50 (como PAM50 ROR) y EndoPredict (como EPclin), diluyendo el valor de la “biología”.
En consecuencia, los diferentes resultados en las comparaciones directas (¡académicas!) de las pruebas no son inesperados [13–15]. El riesgo detectado por una prueba también es una variable continua, lo que ha demostrado ser un escollo en la inmunohistoquímica.
Pruebas multigénicas: pronóstico y/o predicción
Los marcadores pronósticos predicen la evolución de la enfermedad, independientemente del tratamiento. Los marcadores predictivos indican si un tratamiento tendrá éxito o no. Algunos factores son pronósticos y predictivos; en el caso del HER2, la disponibilidad de fármacos específicos hizo desaparecer posteriormente su valor pronóstico [16]. En general, se acepta que los procedimientos para el carcinoma de mama ER+/HER2- utilizan información adicional como el tamaño del tumor y el grado de diferenciación para obtener la probabilidad de recidiva. Las pruebas de primera generación (OncotypeDX, Mammaprint, Índice de Grado Genómico) pueden predecir las recaídas en los primeros cinco años. Los métodos más recientes (PAM50, EndoPredict, Breast Cancer Index) funcionan mejor para predecir la recidiva después de cinco años, lo que es relevante debido a la mayor duración de las terapias hormonales [17–19]. Otros posibles usos de las pruebas, aparte de las de tipo intrínseco, son la predicción de la tasa de respuesta en la terapia neoadyuvante [20–22] y, con alternativas limitadas, la evaluación del riesgo en lesiones precancerosas [23].
El OncotypeDX conduce -en estudios no controlados en su mayoría- a un menor número de quimioterapias y hace que los médicos, actualmente asustados, se sientan más seguros en sus decisiones [24,25]. La “psicología” de la posibilidad de utilizar el OncotypeDX en la elección de terapias adyuvantes formó parte del estudio SAKK 26/10; previsiblemente, mostrará la gran influencia del OncotypeDX en las decisiones [25]. Recientemente se ha demostrado que la prueba PAM50 puede identificar a las pacientes con ganglios positivos que no se benefician de la quimioterapia [26].
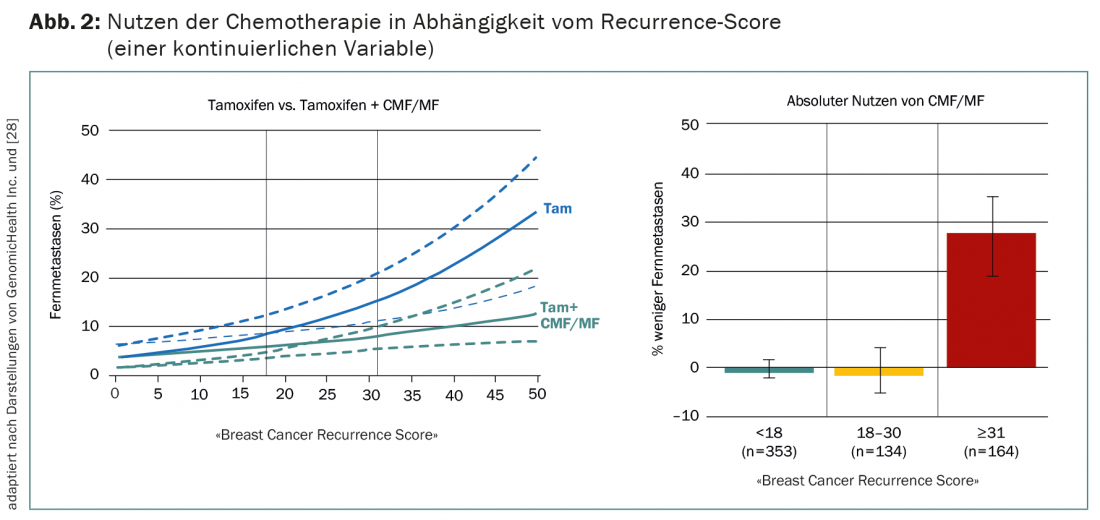
En la actualidad, las pruebas más convincentes de las pruebas multigénicas en el cáncer de mama proceden de un análisis en pacientes RE+ con ganglios negativos. En el ensayo NSABP B20, se las aleatorizó para que recibieran tamoxifeno con o sin quimioterapia CMF/MF, que rara vez se utiliza hoy en día [27]. El OncotypeDX posterior en 651 de las 2299 pacientes muestra que la quimioterapia sólo es beneficiosa para aquellas con una alta probabilidad de recurrencia (puntuación de recurrencia >30) (Fig. 2) [28]. Sensu stricto, no se trata por tanto de una validación prospectiva, como a menudo se afirma.
¿Valor añadido de las pruebas multigénicas?
“¿Necesito quimioterapia?” Con esta pregunta retórica, las pruebas comerciales se anuncian, por ejemplo, con el siguiente caso práctico en la página web: carcinoma ductal invasivo de 1,8 cm en una mujer posmenopáusica, N0, G2, RE 90%, RP 40%, Ki67 15%. La probabilidad de recaída, expresada como puntuación de recurrencia, es baja, de 13, y el beneficio adicional de la quimioterapia es mínimo [28]. Utilizando los criterios actuales de St. Gallen [6] o las directrices de la ESMO [29], esta mujer no necesita quimioterapia adyuvante además de un inhibidor de la aromatasa.
Actualmente se están llevando a cabo tres grandes estudios prospectivos (Mindact, TailorX, RxPONDER) que prueban aleatoriamente la terapia hormonal frente a la combinación con quimioterapia en función del resultado del OncotypeDX o del MammaPrint (Fig. 3) .
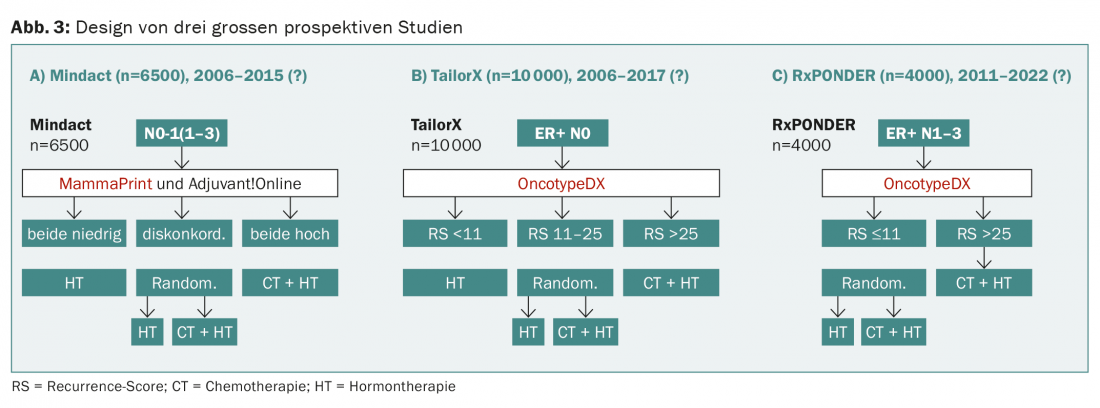
En el estudio prospectivo WSG-planB, se comparan dos quimioterapias para una puntuación de recurrencia de >11, entre otras. El diseño de WSG-ADAPT es interesante: en el postoperatorio se sigue un enfoque similar al de TailorX, pero también se tiene en cuenta la respuesta a tres semanas de terapia hormonal. Sin embargo, en ninguno de estos estudios se “prueba” una de las pruebas, como exigiría el diseño ideal del estudio y es habitual en el caso de los fármacos (Fig. 4).
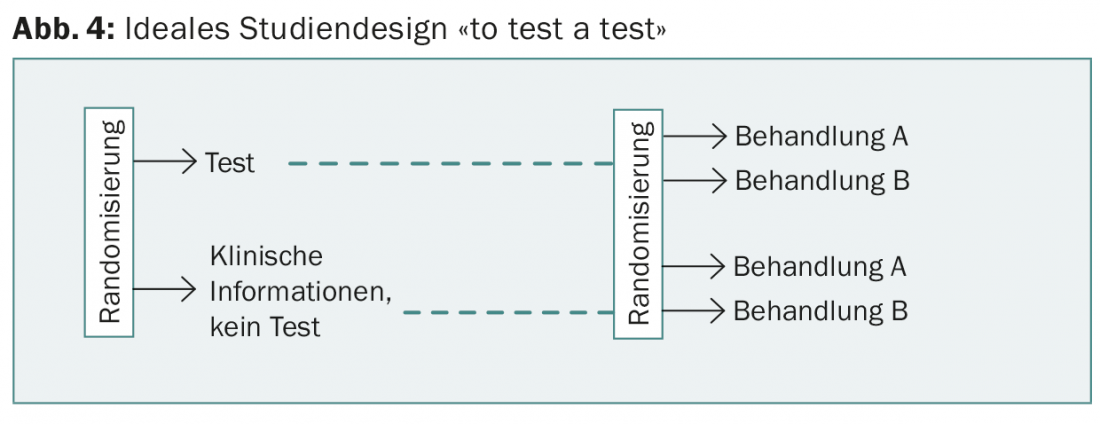
Sin embargo, esto sería necesario para demostrar el valor añadido de las nuevas pruebas en comparación con la información anterior (incluida la mejor determinación posible del Ki67) y para justificar los costes adicionales. Estos últimos están cubiertos por el seguro de enfermedad desde principios de 2015 y varían (Tab. 2). Ninguna prueba permite hasta ahora predecir la elección de una quimioterapia específica.
Es comprensible que los proveedores competidores se pongan en el mejor lugar y luchen duro. Aunque no está confirmado, el sitio web del fabricante de OncotypeDX, por ejemplo, afirma que la prueba también puede ayudar en caso de estado HER2 poco claro [30,31]. Esto explica por qué los costes de Herceptin® se han incluido en los cálculos que certifican de forma concluyente la rentabilidad de esta prueba [32]. Como demuestra la experiencia con otros productos competidores en oncología, sin comparaciones pioneras en Suiza, los distintos productos se establecerán en la vida cotidiana y conducirán a un rompecabezas federal también aquí.
Siempre que la reproducibilidad no se vea comprometida, las pruebas locales son ventajosas porque es posible la consulta entre los clínicos y los patólogos. Así lo demuestra el caso de una paciente con carcinoma de mama multifocal que fue incluida en el estudio SAKK 26/10 del Inselspital. La proliferación de los carcinomas de tres a 1 cm, determinada con Ki67, fue del 19%, 27% y 53%. La puntuación de recurrencia de OncotypeDX determinada en la lejana California se dio en un 13%, lo que no pudo cuestionarse en términos de representatividad. Además, en el espíritu de la medicina basada en pruebas, las extrapolaciones a poblaciones no probadas, por ejemplo el uso del EndoPredict en mujeres premenopáusicas, no son permisibles.
Apéndice: Los primeros resultados del estudio TailorX [33], publicados después de la presentación de este manuscrito, no influyen conceptualmente en las afirmaciones realizadas.
Literatura:
- Berry DA, et al: Quimioterapia de dosis alta con apoyo autólogo de células madre como terapia adyuvante en el cáncer de mama: resumen de 15 ensayos aleatorizados. J Clin Oncol 2011; 29: 3214-3223.
- Peto R, et al: Comparaciones entre distintos regímenes de poliquimioterapia para el cáncer de mama precoz: metaanálisis de los resultados a largo plazo entre 100.000 mujeres en 123 ensayos aleatorizados. Lancet 2012; 379: 432-444.
- Davies C, et al: Relevancia de los receptores hormonales del cáncer de mama y otros factores en la eficacia del tamoxifeno adyuvante: metaanálisis a nivel de pacientes de ensayos aleatorizados. Lancet 2011; 378: 771-784.
- Sotiriou C, et al: Clasificación y pronóstico del cáncer de mama a partir de los perfiles de expresión génica de un estudio poblacional. Proc Natl Acad Sci USA 2003; 100: 10393-10398.
- Ciriello G, et al: La diversidad molecular de los tumores de mama Luminal A. Breast Cancer Res Treat 2013; 141: 409-420.
- Coates AS, et al: Tailoring therapies-improving the management of early breast cancer: St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol 2015; 26: 1533-1546.
- Goldhirsch A, et al: Strategies for subtypes – dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011; 22: 1736-1747.
- Varga Z, et al: ¿Cuál es la fiabilidad de la inmunohistoquímica Ki-67 en los carcinomas de mama de grado 2? Un estudio de control de calidad del Grupo de trabajo suizo de ginecopatólogos y especialistas en mama. PLoS One 2012; 7: e37379.
- Parker JS, et al: Predictor supervisado del riesgo de cáncer de mama basado en subtipos intrínsecos. J Clin Oncol 2009; 27: 1160-1167.
- Paik S, et al: Un ensayo multigénico para predecir la recidiva del cáncer de mama con ganglios negativos tratado con tamoxifeno. N Engl J Med 2004; 351: 2817-2826.
- van de Vijver MJ, et al: Una firma de expresión génica como predictor de la supervivencia en el cáncer de mama. N Engl J Med 2002; 347: 1999-2009.
- van ‘t Veer LJ, et al: Los perfiles de expresión génica predicen el resultado clínico del cáncer de mama. Naturaleza 2002; 415: 530-536.
- Dowsett M, et al: Comparación de la puntuación de riesgo de recurrencia PAM50 con el oncotipo DX y la IHC4 para predecir el riesgo de recurrencia a distancia tras la terapia endocrina. J Clin Oncol 2013; 31: 2783-2790.
- Fan C, et al: Concordancia entre los predictores del cáncer de mama basados en la expresión génica. N Engl J Med 2006; 355: 560-569.
- Varga Z, et al: Comparación de los resultados de las pruebas EndoPredict y Oncotype DX en el cáncer de mama invasivo con receptores hormonales positivos. PLoS One 2013; 8: e58483.
- Buyse M, et al: Integración de biomarcadores en ensayos clínicos. Expert Rev Mol Diagn 2011; 11: 171-182.
- Goss PE, et al: Un ensayo aleatorizado de letrozol en mujeres posmenopáusicas tras cinco años de terapia con tamoxifeno para el cáncer de mama en estadio inicial. N Engl J Med 2003; 349: 1793-1802.
- Davies C, et al: Efectos a largo plazo de continuar con el tamoxifeno adyuvante hasta los 10 años frente a suspenderlo a los 5 años tras el diagnóstico de cáncer de mama con receptores de estrógeno positivos: ATLAS, un ensayo aleatorizado. Lancet 2013; 381: 805-816.
- Bianchini G, et al: La proliferación y la señalización del estrógeno pueden distinguir a las pacientes con riesgo de recaída precoz frente a las tardías entre los cánceres de mama con receptores de estrógeno positivos. Breast Cancer Res 2013; 15: R86.
- Pivot X, et al: En la era de la genómica, ¿debería reconsiderarse el tamaño del tumor como criterio para la quimioterapia neoadyuvante? Oncologist 2015; 20: 344-350.
- Gluck S, et al: La subtipificación molecular del cáncer de mama en estadio inicial identifica a un grupo de pacientes que no se benefician de la quimioterapia neoadyuvante. Breast Cancer Res Treat 2013; 139: 759-767.
- Esserman LJ, et al: La respuesta a la quimioterapia y la supervivencia sin recidiva en el cáncer de mama neoadyuvante dependen de los perfiles de biomarcadores: resultados del ENSAYO I-SPY 1 (CALGB 150007/150012; ACRIN 6657). Breast Cancer Res Treat 2012; 132: 1049-1062.
- Rakovitch E, et al: Un estudio de validación basado en la población de la puntuación de CDIS que predice el riesgo de recidiva en personas tratadas únicamente con cirugía conservadora de la mama. Breast Cancer Res Treat 2015; 152: 389-398.
- Eiermann W, et al: El ensayo de puntuación de recurrencia de 21 genes influye en las recomendaciones de terapia adyuvante para el cáncer de mama precoz con RE positivo, ganglios negativos y ganglios positivos, lo que da lugar a un cambio adaptado al riesgo en el uso de la quimioterapia. Ann Oncol 2013; 24: 618-624.
- Augustovski F, et al: Impacto de la toma de decisiones en la asignación de quimioterapia adyuvante en el cáncer de mama precoz con ganglios negativos mediante un ensayo de 21 genes: revisión sistemática y metaanálisis. Breast Cancer Res Treat 2015; 152: 611-625.
- Gnant M, et al: Identificación de subgrupos pronósticos clínicamente relevantes de mujeres posmenopáusicas con cáncer de mama en estadio inicial con receptores hormonales nodo-positivos tratadas con terapia endocrina: un análisis combinado de ABCSG-8 y ATAC utilizando la puntuación de riesgo de recurrencia PAM50 y el subtipo intrínseco. Ann Oncol 2015; 26: 1685-1691.
- Fisher B, et al: Tamoxifeno y quimioterapia para el cáncer de mama con ganglios linfáticos negativos y receptores de estrógeno positivos. J Natl Cancer Inst 1997; 89: 1673-1682.
- Paik S, et al: Expresión génica y beneficio de la quimioterapia en mujeres con cáncer de mama con ganglios negativos y receptores de estrógeno positivos. J Clin Oncol 2006; 24: 3726-3734.
- Senkus E, et al: Cáncer de mama primario: Guía de práctica clínica de la ESMO para el diagnóstico, tratamiento y seguimientodagger. Ann Oncol 2015; 26 Suppl 5: v8-v30.
- Dabbs DJ, et al: Alta tasa de falsos negativos de la reacción en cadena de la polimerasa de transcripción inversa cuantitativa de HER2 de la prueba Oncotype DX: un estudio independiente de garantía de calidad. J Clin Oncol 2011; 29: 4279-4285.
- Bhargava R, Dabbs DJ: Prueba Oncotype DX en casos inequívocamente positivos para HER2: potencial de daño. J Clin Oncol 2012; 30: 570-571.
- Holt S, et al: A decision impact, decision conflict and economic assessment of routine Oncotype DX testing of 146 women with node-negative or pNImi, ER-positive breast cancer in the U.K.. Br J Cancer 2013; 108: 2250-2258.
- Sparano JA, et al: Validación prospectiva de un ensayo de expresión de 21 genes en el cáncer de mama. N Engl J Med 2015 Nov 19; 373(21): 2005-2014.
- Klein ME, et al: Predicción de la puntuación de recurrencia Oncotype DX: uso de ecuaciones generadas por patología derivadas mediante análisis de regresión lineal. Mod Pathol 2013; 26: 658-664.
- Denkert C, et al.: [Patología molecular del cáncer de mama: Importancia del perfil de expresión génica]. Patólogo 2015; 36: 145-153.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(1): 10-14