La toxina botulínica (BTX) ha pasado de ser un antiguo fármaco oftálmico con un espectro terapéutico limitado a un medicamento de distribución mundial. Tiene un efecto inhibidor presináptico sobre la liberación de ACh en la placa terminal neuromuscular, por un lado, y en la placa terminal neurovegetativa, por otro. En la aplicación terapéutica médica en humanos, se utiliza prácticamente de forma exclusiva el BTX A, del que existen tres preparados que han sido probados en un gran número de estudios científicos: Onabotulinum, Abobotulinum, Incobotulinum. ¿Cómo se utilizan y qué material se necesita para el tratamiento botulínico?
El primer caso registrado de envenenamiento por toxina botulínica con la bacteria productora de neurotoxinas Clostridium botulinum se remonta a 1735, cuando la banda que tocaba en una fiesta de boda fue alimentada con jamón y salchichas ahumadas en mal estado. Cuatro de los diez músicos murieron de botulismo [1]. Dr. Justinus Christian Kerner (1786-1862), poeta y médico de Baden-Württemberg (Fig. 1), publicó en el “Tübinger Blättern für Naturwissenschaften und Arzneykunde” meticulosamente los síntomas de los pacientes que sufrían botulismo y ya entonces señaló que “esta toxina podría ser probablemente un medicamento formidable para el tratamiento de los calambres posteriores, así como para la reducción de la salivación excesiva, el lagrimeo o la transpiración” [2]. Dado que la bacteria aún no se había descubierto en aquella época, Kerner creyó en la teoría de los ácidos grasos después de que se hubieran discutido extensamente otros numerosos mecanismos (piensos insalubres para cerdos, energía eléctrica procedente de la caída de rayos, castigos de Dios debidos a estilos de vida deshonestos, etc.). Durante esta época, el botulismo también se denominaba enfermedad de Kerner.

Fue Friedrich Gustav Jakob Henle (1809-1885), profesor de anatomía de Gotinga (“bucle de Henle”), quien describió por primera vez los organismos parásitos en 1840 (Contagium vivum) y los describió como posibles causantes de enfermedades. 20 años más tarde, el químico Louis Pasteur (1822-1895) demostró la fermentación microbiana del vino. En 1882, Robert Koch (1843-1910), alumno de Henle, descubrió el bacilo tuberculoso y recibió por ello el Premio Nobel en 1905. Las consecuencias que se derivaron del descubrimiento de las bacterias fueron enormes. Por primera vez en la historia de la medicina, se conocieron las causas de numerosas enfermedades, lo que hizo posible por primera vez -al menos hasta cierto punto al principio- una terapia causal. En 1897, Pierre Marie van Ermengem (1851-1932), alumno de Robert Koch, consiguió aislar el patógeno responsable del botulismo, refutando así la teoría de los ácidos grasos de Kerner. Llamó a esta bacteria Bacillus botulinus, que ahora se conoce como Clostridium botulinum [3]. 1905 Tchitchikane identifica la neurotoxina. Por encargo del ejército estadounidense, Eduard J. Schantz llevaba trabajando en la estructura de la proteína desde la Segunda Guerra Mundial, cuando se supo que varios países tenían capacidades y planes para el uso de armas químicas y biológicas. Sus investigaciones sobre la estructura de la proteína y su mecanismo de acción sentaron las bases para el uso actual de la toxina como fármaco. En 1949, los estudios de Burgen iban a demostrar que el efecto de la toxina se debía a una inhibición presináptica de la acetilcolina (quimiodenervación) y no -como se suponía hasta entonces- a un bloqueo nervioso postsináptico [4]. Este hallazgo fue pionero para los posteriores fundamentos teóricos de la aplicación clínica de la toxina (véase más adelante).
En 1973, el Dr. Alan Scott fue pionero en el uso clínico de la toxina botulínica (BTX) al utilizarla por primera vez en primates para tratar el estrabismo. Trabajó en estrecha colaboración con E. J. Schantz, responsable de la producción de la toxina. Sin embargo, si se quería utilizar la toxina terapéuticamente como fármaco en humanos, primero había que purificarla de otras proteínas para evitar la formación de anticuerpos de la forma más eficaz posible y garantizar su estabilidad a altas diluciones. Los problemas se resolvieron y ocho años después del primer experimento animal en monos, Scott pudo publicar la primera aplicación de BTX en humanos bajo el título “Inyección de toxina botulínica en los músculos oculares para corregir el estrabismo” [5].
20 años después del desarrollo clínico del fármaco, el preparado BTX fue aprobado por la FDA estadounidense para el tratamiento del estrabismo, el blefaroespasmo y el espasmo hemifacial. De forma bastante accidental, Jean Carruthers, residente con el Dr. Scott, descubrió que las arrugas del lado tratado de los pacientes con blefaroespasmo hemifacial se alisaban de forma significativa [6]. Casi al mismo tiempo, Bushara descubrió una reducción significativa de la sudoración en la mitad tratada de la cara y publicó por primera vez un posible tratamiento de la hiperhidrosis axilar con BTX [7]. Estos dos hallazgos fueron el comienzo de una historia de éxito de un antiguo medicamento oftálmico de uso terapéutico limitado, que se convirtió en un fármaco de distribución mundial. En Suiza, el BTX se utilizó por primera vez para el tratamiento de la hiperhidrosis focal en 1997. La primera consulta de hiperhidrosis en Suiza se estableció en el Hospital Universitario de Zúrich [8]. Con el paso de los años, las indicaciones de los tratamientos estéticos han cobrado cada vez más importancia. Según las estadísticas de la Sociedad Americana de Cirugía Plástica Estética, sólo en EE.UU. se realizaron 3.766.148 tratamientos botulínicos estéticos en 2013, sin incluir el tratamiento de la hiperhidrosis. ¡Esto representa un aumento del 5680% en comparación con 1997!
¿Todo Botox® o qué?
Hasta la fecha, se conocen siete tipos inmunológicamente diferentes de BTX (A-G), según los cuales las toxinas A, B, E y F muestran eficacia en humanos, mientras que las toxinas C y D sólo causan enfermedad en animales y aún no se ha descrito que la toxina G cause enfermedad en humanos o animales [9]. En las aplicaciones terapéuticas médicas, el BTX A se utiliza casi exclusivamente. El complejo de toxina botulínica B, comercializado con la marca Myobloc® en Europa y Neurobloc® en EE.UU. (Elan Pharmaceuticals, EE.UU.), sólo desempeña un papel marginal en dermatología debido a la duración limitada de su acción y al dolor urente de la inyección.
Existen tres productos principales de BTX A que han sido probados en diversos estudios científicos preclínicos y clínicos:
- Toxina onabotulínica A: Botox®/Vistabel® (Actavis/Allergan, EE.UU.)
- Toxina abobotulínica A: Dysport®/Azzalure® (Ipsen, UK resp. Galderma, CH)
- Toxina incobotulínica A: Xeomin®/Bocouture® (Merz Aesthetics, D)
Botox®, Dysport® y Xeomin® se utilizan para indicaciones médicas (cuadros clínicos neurológicos/hiperhidrosis), Vistabel® (o también Botox aesthetics® en EE.UU.), Azzalure® y Bocouture® están disponibles para indicaciones estéticas, por lo que los respectivos preparados hermanos son farmacológicamente absolutamente idénticos y sólo difieren en el nombre comercial para una mejor identificación (requisito de la FDA). No todos los preparados mencionados tienen autorización de comercialización para todas las indicaciones. Sin embargo, esta circunstancia es específica de cada país y, por lo tanto, no se analiza aquí en detalle.
Las toxinas individuales (Onabotulinum, Abobotulinum, Incobotulinum) difieren en cuanto a su forma de dosificación (unidades/envase), sus condiciones de transporte y su actividad biológica, que se muestra en la tabla 1.
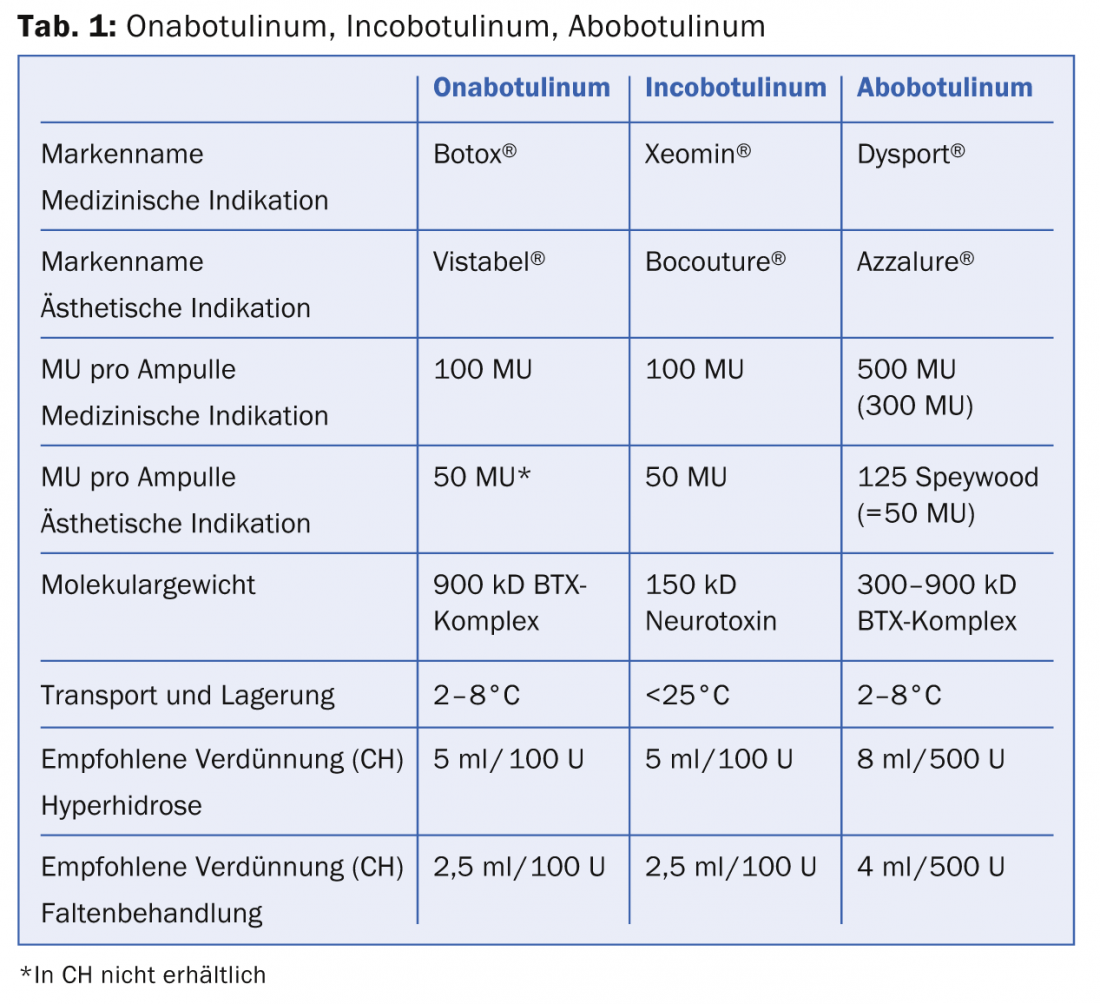
Los tres productos se presentan en una sustancia seca cristalina y deben reconstituirse con NaCl al 0,9%. Mientras que el ona- y el abobotulinum deben transportarse y almacenarse refrigerados, esta cadena de frío no se aplica al incobotulinum. No obstante, tras la reconstitución, todos los productos deben conservarse en un lugar fresco. La actividad biológica de los tres productos se expresa en las denominadas unidades de ratón (UM). 1 MU corresponde a 0,2X10-12 mol (picomol) de toxina y se define como la cantidad de toxina que resulta letal para la mitad de la población de ratones Swiss Webster hembra (18-22 g) tras una inyección intraperitoneal (dosis letal LD50). Desde junio de 2011, Allergan ha sido el único competidor que ha realizado un ensayo de potencia celular in vitro (CBPA) para determinar la estabilidad y eficacia del fármaco. El onabotulinum y el incobotulinum son comparables en términos de eficacia, duración de la acción y comienzo de la misma. El incobotulinum es el único preparado complejo sin proteínas, del que se dice que destaca por una reacción reducida de anticuerpos neutralizantes (prevención del fracaso secundario de la terapia). Es importante señalar que la dosis equivalente para el abobotulinum (Dysport® resp. Azzalure®) no es la misma que la dosis de los otros dos BTX (tab. 1). Esto se debe a que se utilizan diferentes cepas bacterianas para producir el fármaco y a que los procesos de fabricación son distintos. El factor de conversión de dosis entre onabotulinum/incobotulinum y abobotulinum es de 1:3 (o 1:2,5 según la publicación). Esto es de suma importancia cuando se reconstituye la toxina en uso clínico para evitar la sobredosificación o la infradosificación. Más en aras de la exhaustividad, cabe mencionar que en la World Wide Web se ofrece un gran número de productos BTX con diferentes marcas de origen incierto. Huelga decir que estos productos deben evitarse.
¿Cómo funciona la botulina?
La BTX, como ya se ha mencionado, tiene un efecto inhibidor presináptico sobre la liberación de ACh tanto en las placas terminales neuromusculares como en las neurovegetativas. En otras palabras, tanto el músculo como el sistema nervioso autónomo (SNV) están servidos por la misma sustancia transmisora (ACh). Por eso el BTX es eficaz tanto en el músculo como en otros procesos controlados vegetativamente (hiperhidrosis, hipersalivación, indicaciones urológicas, etc.) (Fig. 2). Y este mecanismo de acción extremadamente específico del BTX es también la razón por la que el BTX no tiene efectos secundarios en su uso clínico. La ACh se utiliza como transmisor exclusivamente en los sistemas mencionados.
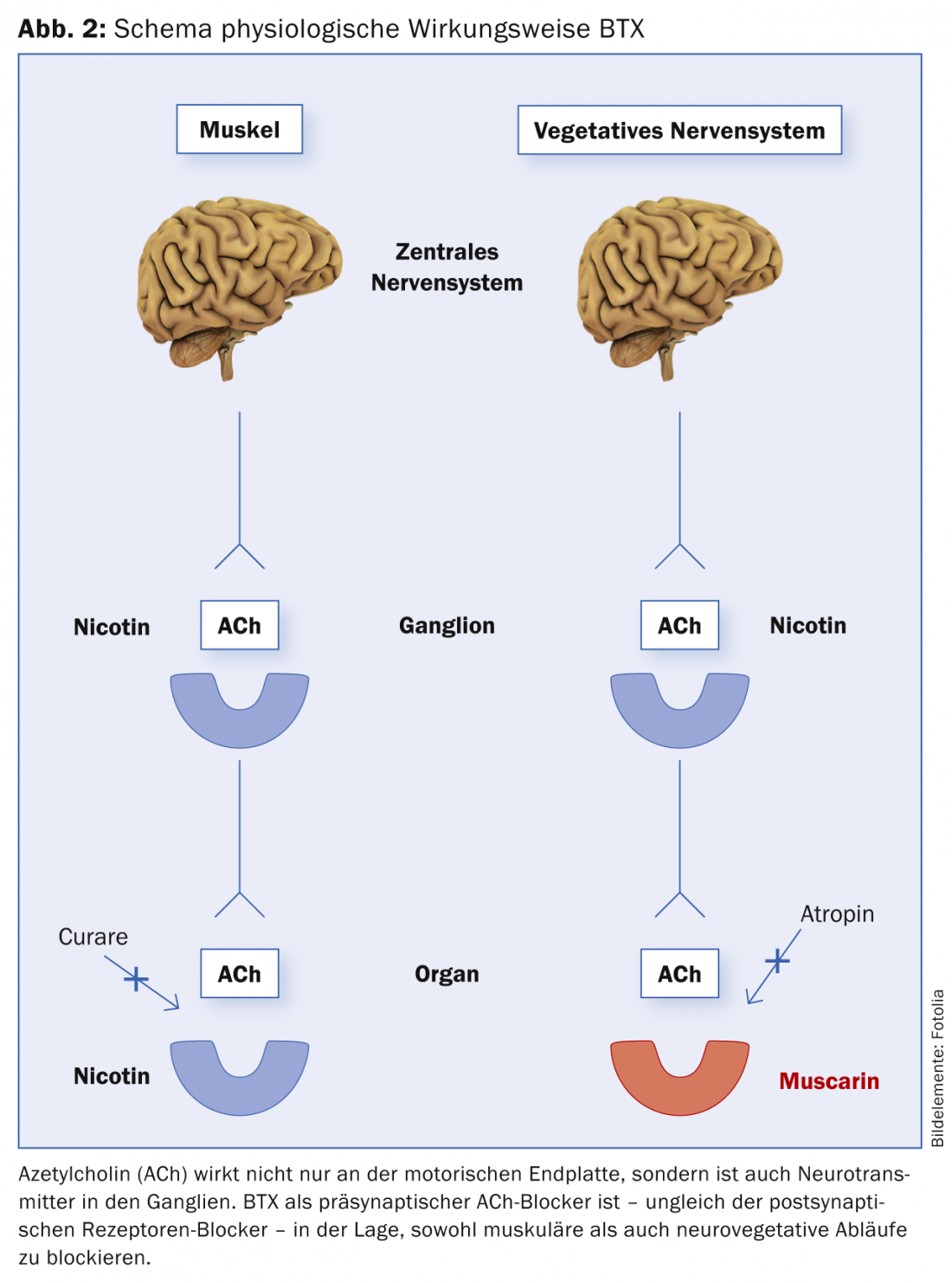
La molécula de toxina consta de una cadena ligera (cadena L) con un peso molecular de 50 kD (kilo Dalton) y una cadena pesada (cadena H) con un peso molecular de 100 kD. Las cadenas están unidas entre sí por un puente disulfuro. La cadena H es responsable de la llamada internalización: la captación de la toxina en la terminal nerviosa en la zona de la placa terminal presináptica. Tras la endocitosis, la cadena L se separa de la cadena H. La cadena L escinde la proteína SNAP-25, un componente del llamado complejo de fusión SNARE (Receptor Soluble de Fijación del Factor N-etilmaleimida-Sensible, SNARE) en varios sitios. Como resultado, ya no es posible la fusión de la vesícula que contiene ACh con la membrana y, por tanto, no es posible la liberación de ACh de la terminal nerviosa colinérgica [10,11]. Así, se impide la descarga de la sustancia transmisora ACh y no hay efecto postsináptico. Sin embargo, el efecto terapéutico sólo tiene una duración limitada, ya que más tarde vuelven a brotar nuevos nervios y se establecen nuevas conexiones sinápticas.
La preparación de la solución botulínica para el tratamiento
Existen diferentes formas de disolver la sustancia seca BTX. Muchos autores optan por una dilución de 1 ml a 100 U Ona- e Incobotulinum resp. 500 U de Abobotulinum para el tratamiento de las arrugas mímicas con el objetivo de lograr el resultado más preciso posible de la inyección de la toxina con la mínima difusión posible en los músculos no deseados. Sin embargo, este esquema de disolución altamente concentrada y de bajo volumen tiene la gran desventaja de que es difícil conseguir gradaciones finas en la dosificación y, por tanto, un cierto “modelado” con la dosis de BTX. Si se disuelven 100 U de BTX en 1 ml, entonces 0,1 ml corresponden a 10 U de BTX. La dosis de un punto de inyección para el tratamiento de las arrugas mímicas suele oscilar entre 2 U y 6 U. Por lo tanto, se requiere un alto nivel de experiencia y una mano segura a la hora de inyectar pequeñas dosis. Por lo tanto, se ha establecido una dilución de BTX para las diferentes indicaciones como se muestra en las tablas 2 y 3.
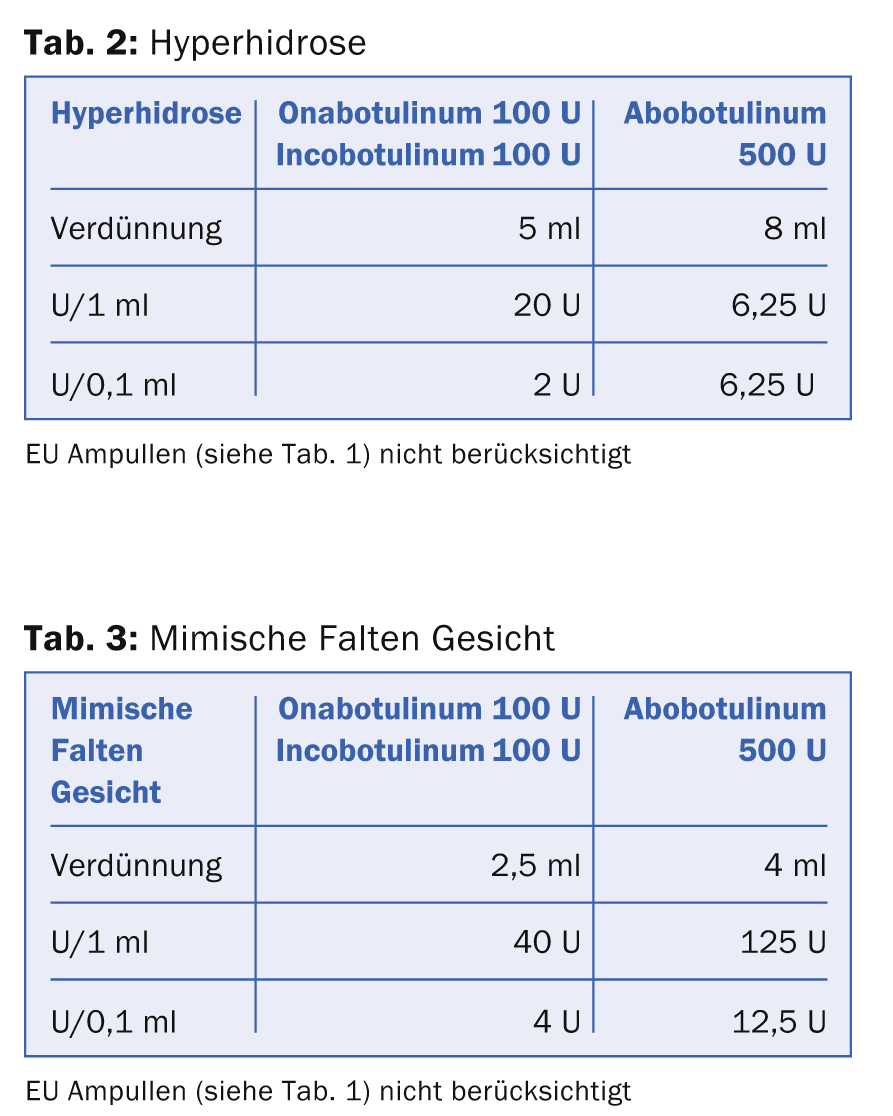
Las tablas muestran que la dosis equivalente de Ona- resp. Incobotulinum y Abobotulinum se calcula con 1:3. Lo especial de la reconstitución del Incobotulinum es que la empresa recomienda encarecidamente inclinar el vial varias veces después de dispararlo para conseguir el máximo efecto de la solución del fármaco.
¿Qué material necesito para un tratamiento BTX?
El material necesario para el tratamiento con BTX es relativamente manejable. Una preparación correcta y bien planificada conduce a la seguridad y a una mayor calidad. O dicho al revés: si el médico tiene que reunir esto y aquello antes de la intervención prevista o incluso interrumpir el tratamiento por falta de preparación, existen peligros per se para los tratamientos incorrectos. No hay que olvidar que se trata de una droga muy potente. La instrucción de los ayudantes es de suma importancia.
Para un correcto tratamiento BTX necesita:
- 1 envase original de BTX (Ona-, Inco o Abobotulinum) 100 U
- NaCl 0,9% 5 ml (hiperhidrosis) resp. 2,5 ml (indicación estética) Ona- e Incobotulinum, 8 ml resp. 4 ml de Abobotulinum (Cueva: en la UE, 50 U resp. 125 U Frasco disponible, lo que reduce a la mitad la cantidad de volumen)
- Jeringa de 5 ml con aguja 18 G (rosa) para reconstitución
- Jeringas de insulina (1 ml) sin aguja acoplada con escala en ml
- Aguja 32G acoplable para inyección
- Desinfección tanto en spray, por ejemplo Kodan® para el tratamiento de la hiperhidrosis, como en líquido, por ejemplo Octenisept® para el tratamiento del rostro.
- Cinta en la zona de la cara
- Utensilios para la prueba del sudor de Minor para el tratamiento de la hiperhidrosis axilar:
- Solución de Lugol (farmacia)
- Fécula de patata (farmacia)
- Tamiz doble para aplicar la fécula de patata lo más fina posible (grandes almacenes’)
- Lápiz Kajal (¡blando!) para marcar los puntos de inyección
- Opción de emulsión desmaquillante y lavado tras el tratamiento (especialmente tras la hiperhidrosis axilar).
Por supuesto, esta lista puede adaptarse a las preferencias personales. ¡Las jeringuillas, agujas y viales vacíos usados deben desecharse por separado! ¡Este es un punto que no debe omitirse! El BTX y sus residuos no deben eliminarse con la basura general.
Continuará…

Literatura:
- Dickson EC: Botulismo: Un estudio clínico y experimental. Instituto Rockefeller de Investigación Médica 1918; 1-117.
- Kerner JC: Envenenamiento por salchichas contaminadas. Tübinger Blätter für Naturwissenschaften und Arzneykunde 1817; 3: 1-45.
- Kreyden OP, Geiges ML, Burg G: Toxina botulínica: del veneno al fármaco. Una revisión histórica. Dermatologist 2000; 51: 733-737.
- Burgen A, Dickens F, Zatman LJ: La acción de la toxina botulínica en la unión neuromuscular. J Physiol 1949; 109: 10-24.
- Scott AB: Inyección de toxina botulínica en los músculos oculares para corregir el estrabismo. Trans Am Ophthalmol Soc 1981; 79: 734-770.
- Carruthers JD, Carruthers JA: Tratamiento de las arrugas glabelares del entrecejo con exotoxina de C. botulinum-A. J Dermatol Surg Oncol 1992 Ene; 18(1): 17-21.
- Bushara KO, et al: Toxina botulínica: un posible nuevo tratamiento para la hiperhidrosis axilar. Clin Exp Dermatol 1996 Jul; 21(4): 276-278.
- Kreyden OP, Böni R, Burg G: Hiperhidrosis y toxina botulínica en dermatología. Problemas actuales en dermatología Karger 2002. ISBN 0070-2064.
- Barker WH: Botulismo. La Historia Mundial de las Enfermedades Humanas de Cambridge. Kiple, KF y Graham 1993; 623-625.
- Kao I, Drachman DB, Price DL: Toxina botulínica: Mecanismo de bloqueo presináptico. Science 1976; 193: 1256-1258.
- Philipp-Dormston WG: Toxina botulínica en dermatología. Der Hautarzt 2014; 65: 133-145.
PRÁCTICA DERMATOLÓGICA 2015; 25(1): 29-34