La displasia broncopulmonar (DBP), la enfermedad pulmonar crónica más frecuente en los lactantes, se asocia a consecuencias a largo plazo que se prolongan hasta la edad adulta. A pesar de las importantes mejoras en los cuidados perinatales, la incidencia de DBP entre los lactantes más inmaduros se ha mantenido sin cambios o incluso ha aumentado. La diferente incidencia del TLP en los distintos centros perinatales refleja tanto las diferencias en la población de pacientes como en los métodos de tratamiento.
La displasia broncopulmonar (DBP), la enfermedad pulmonar crónica más frecuente en los lactantes, se asocia a consecuencias a largo plazo que se extienden hasta la edad adulta [1,2]. A pesar de las importantes mejoras en los cuidados perinatales, como el tratamiento prenatal con esteroides para lograr un “estirón” madurativo de los pulmones, la terapia con surfactantes y el desarrollo de estrategias de ventilación adaptadas, la incidencia de DBP en los recién nacidos más inmaduros ha permanecido inalterada o incluso ha aumentado [3]. Esto se debe probablemente a una reducción significativa de las tasas de mortalidad junto con un aumento del número total de niños tratados nacidos significativamente prematuros. La diferente incidencia del TLP en los distintos centros perinatales refleja tanto las diferencias en la población de pacientes como en los métodos de tratamiento [4–7]. Las publicaciones informan de una incidencia de DBP de hasta el 68% en bebés de muy bajo peso al nacer (401-1500 g) con una edad gestacional inferior a las 29 semanas de gestación, o de hasta el 77% en bebés nacidos con menos de 32 semanas de gestación o con un peso al nacer inferior a 1 kg [5,8,9]. Estas cifras proceden principalmente de países con un elevado producto interior bruto. Con aproximadamente 15 millones de niños nacidos prematuramente cada año en todo el mundo, las cifras anteriores demuestran el importante reto clínico y socioeconómico [10].
La enfermedad pulmonar neonatal crónica se clasifica en tres niveles de gravedad según la definición de Jobe y Bancalari: leve (suplemento de oxígeno durante al menos 28 días postnatales), moderada (suplemento de oxígeno <30% a las 36 semanas de edad postmenstrual) y grave (suplemento de oxígeno 30% y/o soporte ventilatorio a las 36 semanas de edad postmenstrual) [1].
Grandes estudios clínicos han identificado numerosos factores de riesgo para el desarrollo de DBP, entre ellos las infecciones congénitas y nosocomiales, la ventilación mecánica y la toxicidad del oxígeno [11–16]. El impacto de estos retos pre y postnatales viene determinado además por la presencia de una carencia calórica o una deficiencia de vitaminas y oligoelementos, así como una secreción insuficiente de hormonas suprarrenales y tiroideas, que aumentan aún más el riesgo de desarrollar morbilidad pulmonar [17–19]. La vulnerabilidad del pulmón en desarrollo a la aparición de daños crónicos también se multiplica de 3 a 4 veces por la presencia de un retraso del crecimiento intrauterino [20–24], por lo que el desarrollo alveolar y vascular se ve decisivamente perjudicado por la alteración subyacente de la transducción de señales [25]. También se ha demostrado que la exposición al humo del tabaco prenatal -ampliamente subestimada clínicamente debido a la falta de información anamnésica y de marcadores clínicos- contribuye significativamente al desarrollo de la enfermedad, posiblemente más allá de un impacto en el crecimiento somático [26,27].
El papel de las terapias establecidas también debe revisarse constantemente con respecto a una posible contribución al desarrollo de complicaciones crónicas. Los efectos del tratamiento con esteroides y antibióticos maternos se discuten a continuación en este contexto.
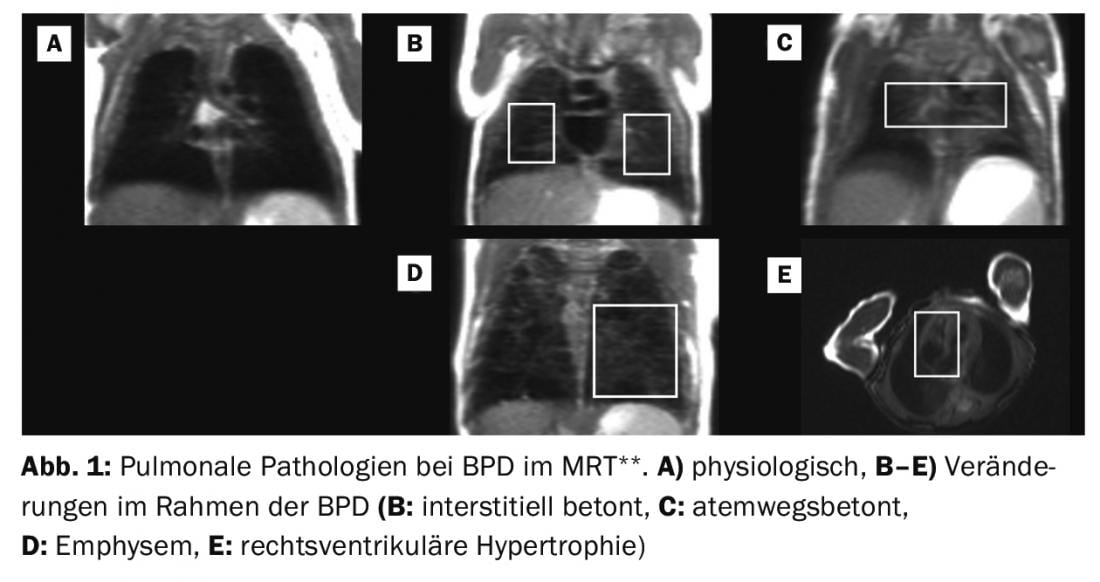
** Adaptado de: Puntuación basada en resonancia magnética del pulmón enfermo en el recién nacido prematuro con DBP. Kai Förster, Hannah Busen, Sophia Stöcklein, Olaf Dietrich, Harald Ehrhardt, Mark O. Wielpütz, Andreas W. Flemmer, Benjamin Schubert, Marcus A. Mall, Birgit Ertl-Wagner, Anne Hilgendorff. Este manuscrito se encuentra en fase de presentación en Tórax.
El debate sobre la importancia de los diversos factores de riesgo debe realizarse, en última instancia, en el contexto de nuestros conocimientos actuales, en constante evolución, sobre la importancia de los polimorfismos genéticos, y los estudios informan de que hasta el 53% de la varianza en el TLP puede deberse a esto [28]. Las anomalías genéticas identificadas incluyen mutaciones en genes relacionados con la síntesis de surfactante, la respuesta inmunitaria innata [29,30] y la superóxido dismutasa [31]. El mayor riesgo de desarrollar DBP e hipertensión arterial pulmonar (HAP) en los niños prematuros de sexo masculino [32] se ha relacionado con diferencias en la regulación hormonal [33]. Por el contrario, más adelante, las mujeres con antecedentes de TLP se ven más afectadas a largo plazo [34].
Las dificultades para identificar factores de riesgo genéticos clínicamente relevantes surgen tanto al diferenciar entre las variables que influyen en el riesgo de parto prematuro per se [35] como al considerar las complicaciones agudas [36] y crónicas en relación con las demás. Sin embargo, el hecho de que los grandes estudios de asociación genética [37] aún no hayan sido capaces de dar continuidad a los éxitos en otras áreas de enfermedades como la fibrosis quística [38] o la HAP [39,40] en cuanto a resultados que marquen tendencias con relevancia clínica puede ser, además de las razones mencionadas, un indicio de la heterogeneidad del diagnóstico de la DBP. En el futuro, la identificación de las (sub)entidades de enfermedad subyacentes puede permitir una asignación más clara de determinados factores de riesgo y polimorfismos genéticos. Del mismo modo, el conocimiento de los lugares clave en la transducción de señales que controlan la interacción de las diferentes poblaciones de células pulmonares permitirá clasificar los genes candidatos. En las siguientes secciones se abordan diversos aspectos al respecto.
De la causa a la consecuencia: inflamación y respuesta al estrés oxidativo
Las influencias exógenas descritas que actúan pre y postnatalmente sobre un pulmón estructural y funcionalmente inmaduro provocan una respuesta inflamatoria persistente, la remodelación de la matriz extracelular (MEC) y cambios fibróticos difusos que incluyen la hipertrofia del músculo liso en las pequeñas arterias pulmonares y las vías respiratorias [41]. Los cambios histopatológicos característicos con el cuadro de alveolarización y vasculogénesis alteradas [1] dan lugar a una hipoventilación alveolar, que se expresa en el cuadro clínico de hipercapnia e hipoxemia y el desajuste ventilación-perfusión [42].
Los procesos inflamatorios agudos y crónicos que caracterizan a la DBP están causados por mecanismos tanto prenatales como postnatales. Las infecciones y la correspondiente capacidad para generar una respuesta inmunitaria competente desempeñan un papel importante en el desarrollo de la DBP [13,43–45]. Los procesos inflamatorios prenatales, que se resumen por ejemplo en el término “síndrome de respuesta inflamatoria fetal (FIRS)” o se producen en el contexto de acontecimientos infecciosos manifiestos como la corioamnionitis prenatal o postnatal en el contexto de infecciones congénitas y nosocomiales, provocan una afluencia de granulocitos neutrófilos al pulmón inmaduro. Como resultado, se produce la presencia de un mayor número de monocitos y macrófagos como parte de la denominada “segunda oleada” de la respuesta inmunitaria [24,46,47]. El papel de la inmunidad innata es de especial importancia en este caso, ya que la inmunidad adaptativa también puede expresarse de forma variable en función de la edad gestacional [48]. Los estudios en animales sugieren que la remodelación de la matriz extracelular y la disfunción epitelial alveolar precoz no sólo son consecuencia de la respuesta inflamatoria, sino que además la promueven [49,50] y provocan así cambios duraderos en la función inmunitaria pulmonar. Prenatalmente, el uso generalizado de tratamientos antibióticos maternos provoca un cambio duradero en la flora bacteriana del niño [51] y en la función inmunitaria de la descendencia en el modelo de ratón [52].
Postnatalmente, la inducción de lesiones baro y volutraumáticas durante la ventilación mecánica y las consecuencias de la hiperoxia moderada o grave son factores de riesgo importantes para el inicio y el mantenimiento de los procesos inflamatorios destacados anteriormente a nivel local e incluso sistémico [53–56]. La liberación de citocinas como el factor de crecimiento transformante (TGF)-β, el factor de necrosis tumoral (TNF)-alfa y las interleucinas, por ejemplo la IL-1beta, contribuye significativamente al desequilibrio de la transducción de señales de diversos (otros) factores de crecimiento y conduce a la activación de factores de transcripción que promueven la apoptosis en diferentes células [57–59]. El debate sobre el papel de las células inflamatorias reclutadas y residentes [60–64] aportará importantes conocimientos sobre las relaciones mecanísticas y para la identificación de opciones terapéuticas. Sin embargo, en este contexto, la presunta influencia de las células inflamatorias en el desarrollo pulmonar también generará nuevos enfoques de investigación [65].
Los procesos inflamatorios agudos y crónicos deben considerarse en el contexto de la capacidad celular para responder a desafíos postnatales persistentes o recurrentes. Aquí, la relativa falta de antioxidantes e inhibidores de las enzimas proteolíticas hace que el pulmón inmaduro sea especialmente vulnerable a los efectos de los metabolitos tóxicos del oxígeno y las proteasas liberadas por la matriz extracelular y los granulocitos neutrófilos y macrófagos residentes o reclutados [66-69]. Varios estudios han demostrado la existencia de un mayor estrés oxidativo en el recién nacido prematuro. Así, las concentraciones urinarias de malondialdehído se elevan en la primera semana de vida debido a la peroxidación de las membranas lipídicas tras un daño mediado por la oxidación y se ha demostrado que se correlacionan con el riesgo de enfermedades por radicales de oxígeno, incluida la DBP [70]. Se ha medido una disminución de las concentraciones de antioxidantes pulmonares en el lavado de los recién nacidos prematuros [71], y otros estudios indican que los pacientes adolescentes con DBP se caracterizan por signos de mayor estrés oxidativo en las vías respiratorias, un signo de cambios a largo plazo en el sistema respiratorio tras el nacimiento prematuro [72]. Las terapias establecidas también necesitan ser revisadas críticamente con respecto a su papel en el desarrollo pulmonar a la luz de las nuevas pruebas, como, por ejemplo, la administración prenatal de betametasona, a pesar de su uso prenatal más extendido para promover la maduración pulmonar y prevenir la dificultad respiratoria al tiempo que reduce las tasas de DBP. [73,74] han demostrado aumentar los indicadores de peroxidación de las membranas lipídicas [70].
Estos cambios a más largo plazo en la respuesta al estrés oxidativo y otros procesos se reflejan en respuestas alteradas a las infecciones víricas más adelante en la vida [75]. La respuesta del pulmón en desarrollo al daño precoz, también en lo que respecta a las consecuencias a largo plazo, es específica y diferente de la respuesta del organismo adulto. Mientras que la exposición crónica al oxígeno (60% durante 14 días) en pulmones de ratas neonatas aumenta la contracción de los vasos pulmonares y del músculo liso de las vías respiratorias y reduce la relajación por óxido nítrico, en animales adultos se produce el fenómeno contrario [76]. Los efectos a largo plazo tras la exposición a la hiperoxia en la primera semana de vida (100% durante 4 días) incluyen principalmente complicaciones cardiovasculares, en las que se desarrolla una distensión del ventrículo derecho en la HAP y un aumento consecutivo de la mortalidad como consecuencia de la enfermedad vascular pulmonar en modelos animales [77]. La alteración de la transducción de señales por parte de la proteína morfogénica ósea (BMP) ofrece una explicación patomecanística. Otro estudio sobre los efectos inducidos por la hiperoxia demuestra otros mecanismos que explican la mayor susceptibilidad al daño agudo y a largo plazo en el pulmón del recién nacido. En el ratón neonatal – a diferencia del animal adulto – las células progenitoras endoteliales derivadas de la médula ósea, circulantes y pulmonares se reducen significativamente aquí [78], lo que puede conducir a un agotamiento precoz de las capacidades de reparación y regeneración. La influencia en otros procesos centrales como la regulación del ciclo celular con una regulación al alza de P21 tras la hiperoxia y una actividad reducida de la histona deacetilasa [79] así como los efectos sobre la metilación del ADN [80] también apuntan al desarrollo temprano de efectos acumulativos relevantes a largo plazo en el contexto de mecanismos compensatorios reducidos en el pulmón inmaduro.
Características histopatológicas – generador de reloj y función “memoria
La interacción del compartimento de células epiteliales, mesenquimales y endoteliales en su interacción para el desarrollo de la zona de intercambio gaseoso está orquestada esencialmente por la regulación de diversos factores de crecimiento. Entre ellos se incluyen Notch y Wingless Int-1 (Wnt), factor de crecimiento derivado de fibroblastos y plaquetas (FGF y PDGF), BMP y factor de crecimiento endotelial vascular (VEGF) [81–87]. La interferencia temprana con estos factores de transcripción altera la morfogénesis pulmonar normal [88], lo que provoca una falta de diferenciación de las estructuras alveolares [89]. Asimismo, la regulación de factores de transcripción centrales como el factor nuclear kappa B (NF-kB) desempeña un papel y contribuye al mal desarrollo de la superficie de intercambio gaseoso [88,90,91]. La asociación característica de la alveolarización alterada con la presencia de capilares dismórficos está impulsada por la expresión alterada de factores de crecimiento angiogénicos, que incluyen la expresión pulmonar reducida del factor de crecimiento endotelial vascular (VEGF) y de los receptores del VEGF. [92–94] así como una reducción de la óxido nítrico sintasa endotelial (eNOS) y de la guanilato ciclasa soluble (sGC) en los vasos sanguíneos pulmonares y en las vías respiratorias incluyen [95,96]. Los cambios son similares a los del organismo que envejece y contribuyen -también debido a la menor plasticidad de los capilares y los pequeños vasos- al riesgo de HAP y al deterioro del desarrollo del sistema linfático en los pulmones a medida que avanza la enfermedad [97–100].
La alteración de la transducción de señales junto con los efectos directos, por ejemplo, del estímulo de estiramiento debido a la ventilación mecánica y la toxicidad del oxígeno contribuyen a que se produzcan cambios graves en el andamiaje pulmonar [101,102]. El aumento de la remodelación de la matriz extracelular está indicado, por ejemplo, por el aumento de la excreción urinaria de desmosina, precedida por un aumento de la actividad de la elastasa [103–105] y es similar a los hallazgos en pacientes con síndrome de dificultad respiratoria aguda (SDRA) [106]. Sin embargo, el desarrollo fisiológico del pulmón también depende de la presencia de elastasas y metaloproteinasas pulmonares, ya que la deficiencia completa de metaloproteinasas de matriz favorece la remodelación pulmonar de tipo DBP [107].
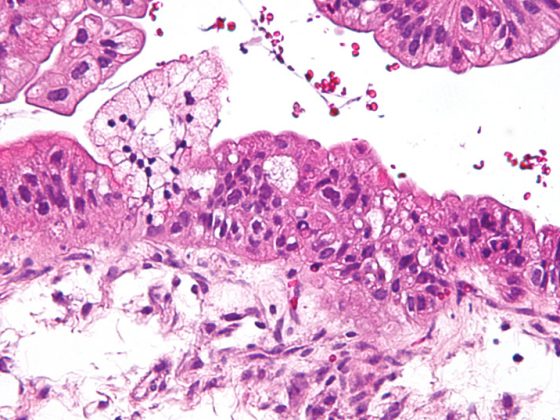
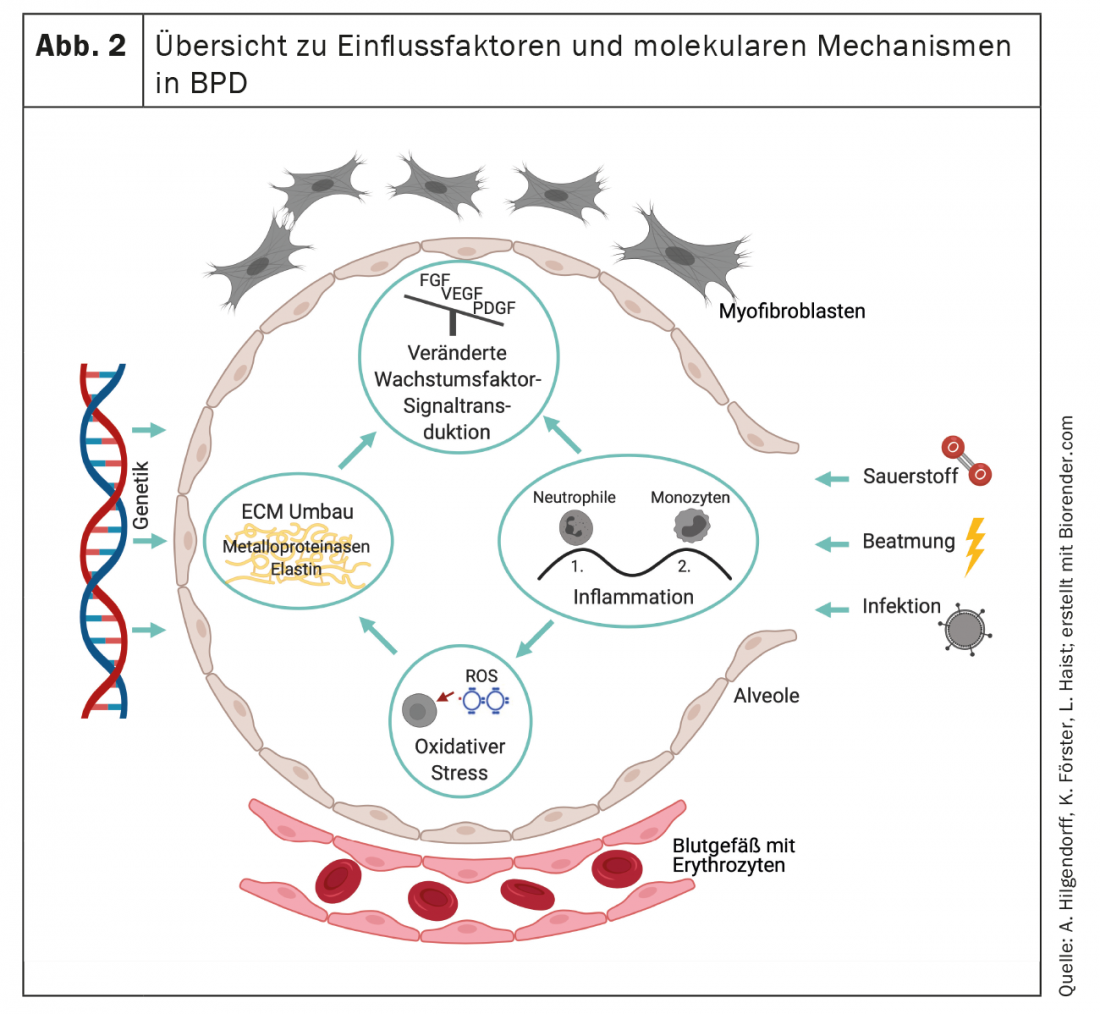
Como resultado de la remodelación, la DBP se caracteriza por una disposición patológica de la elastina y cambios cualitativos y cuantitativos en el entramado de colágeno. [108–110] Caracteriza la función estructurante de la matriz como andamiaje para la formación de nuevos alvéolos y capilares y define el destino de las células que pueblan el órgano en desarrollo. [111,112] (Fig. 2). La reorganización irreversible de la matriz extracelular provocará así cambios a largo plazo que se manifestarán a varios niveles.
Los cambios histopatológicos y el desarrollo y aspecto clínicamente heterogéneos de la DBP sugieren la existencia de (sub)entidades de la enfermedad o, al menos, una influencia individualmente diferente de los diversos cambios estructurales en el aspecto clínico y el curso a largo plazo. En este contexto, la presencia de procesos primarios enfisematosos o de remodelación intersticial, cambios vasculares y/o patologías del tracto respiratorio son “variables” presumiblemente indicativas de DBP, que en estudios iniciales también pueden representarse morfológicamente por imagen en los bebés prematuros mediante estrategias de imagen clínicamente factibles [113–117]. Mediante la reproducción de estudios realizados con éxito en otras áreas patológicas, el uso de otras estrategias de diagnóstico por imagen [118–121] podría mejorar aún más la estratificación de los pacientes en el futuro.
Función pulmonar en la DBP – Cambios tempranos y consecuencias a largo plazo
A pesar de los esfuerzos sostenidos en la atención perinatal para evitar complicaciones a largo plazo [122,123], la manifestación de síntomas respiratorios en la edad adulta es frecuente y a menudo se interpreta erróneamente como asma o EPOC, sobre todo si no se conocen los acontecimientos vitales tempranos o no se pregunta sobre ellos [124,125].
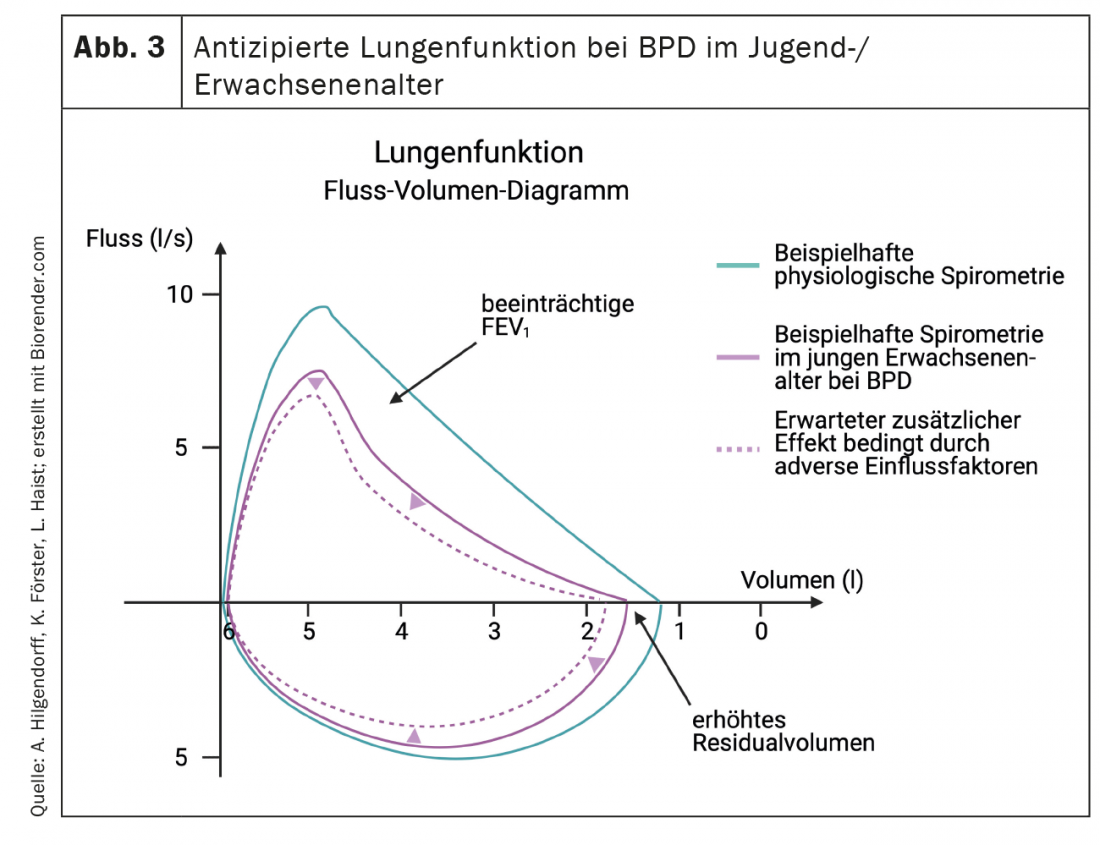
Clínicamente, la disfunción pulmonar se caracteriza por una disminución de la distensibilidad pulmonar, taquipnea y aumento de la ventilación minuto, lo que se refleja en un aumento del trabajo respiratorio con y sin dependencia del oxígeno. Este cuadro clínico puede ir acompañado de un aumento de la presión microvascular en los pulmones, lo que contribuye al desarrollo de un edema pulmonar intersticial. El aumento de la resistencia vascular pulmonar, típicamente asociado a una menor capacidad de respuesta al óxido nítrico inhalado y a otros vasodilatadores, puede progresar a una HAP reversible o persistente y a una insuficiencia cardiaca derecha [99,100]. El conocimiento de los cambios tempranos en la función pulmonar es crucial, ya que una enfermedad pulmonar más grave tras el nacimiento tiene más probabilidades de convertirse en DBP moderada/grave en la fecha prevista del parto [126] y la función pulmonar es un buen predictor de la morbilidad y mortalidad posteriores [127]. La DBP se caracteriza en la función pulmonar por una mayor resistencia de las vías respiratorias y unas vías respiratorias hiperreactivas [128]que se manifiesta clínicamente – junto con infecciones pulmonares o independientemente de ellas – por broncoconstricción episódica y cianosis (Fig. 3). La proporción de patología mediada vascularmente que desempeña un papel aquí más allá del efecto Euler-Liljestrand a menudo sigue sin estar clara porque faltan indicadores sensibles. Los bebés afectados pueden seguir siendo oxígeno-dependientes durante meses o años, y sólo una minoría depende realmente del oxígeno más allá de los dos años de edad [129,130]. La dependencia del oxígeno caracteriza la especial gravedad de la enfermedad pulmonar, y estos bebés ingresan de nuevo en el hospital con una frecuencia dos veces mayor que los no dependientes del oxígeno. Sin embargo, incluso tras el fin de la oxigenoterapia, los pacientes con una afectación moderada o grave en hasta un 70% requieren hospitalizaciones repetidas, sobre todo en los dos primeros años de vida [126,131,132]. Sin embargo, en general, las infecciones de las vías respiratorias inferiores causadas por el virus respiratorio sincitial (VRS) siguen siendo la principal causa de reingreso hospitalario en los recién nacidos prematuros, independientemente del estado de la DBP [133].
Más adelante en el curso de la enfermedad, la DBP es un factor de riesgo significativo de sibilancias persistentes y de necesidad de terapia inhalatoria (odds ratios de 2,7 y 2,4, respectivamente), que afecta a alrededor del 20-30% de los lactantes con DBP a los seis y 12 meses de edad [134,135]. Los síntomas respiratorios, especialmente en niños con antecedentes de sibilancias, suelen permanecer en [129,136] en la edad preescolar y escolar, y hasta el 80% de los niños prematuros muestran obstrucción sintomática frecuente de las vías respiratorias en la primera infancia y la adolescencia [137–139]. En el estudio EPICure [140] se obtuvieron datos importantes sobre los resultados a largo plazo tras un parto prematuro. Los recién nacidos prematuros con inmadurez extrema presentan un consumo máximo de oxígeno significativamente inferior en la edad escolar como evaluación directa de la aptitud cardiorrespiratoria, un volumen espiratorio forzado a un segundo (FEV1) inferior y una transferencia de gases deficiente. En este caso, las cargas máximas significativamente más bajas y las frecuencias respiratorias más altas combinadas con volúmenes corrientes más bajos durante la carga máxima y una mayor capacidad residual pueden reflejar el efecto de la hiperinsuflación en la obstrucción de las vías respiratorias y/o cambios en la función quimiorreceptora pulmonar e indicar la presencia de limitaciones persistentes en la función de las vías respiratorias y una reducción de la superficie alveolar. Los cambios no fisiológicos basados en el crecimiento pulmonar con deterioro del FEV1 y del FEV1/capacidad vital forzada en la DBP han sido confirmados por varios estudios en niños y adultos jóvenes [141–144].
El curso de la enfermedad en la edad adulta es variable. En algunos pacientes, sobre todo en los que padecen TLP grave, los síntomas persisten hasta la edad adulta [145]. Otros cursos indican una mejoría temporal (subjetiva) con una reaparición posterior de los síntomas de la enfermedad que son el resultado de una limitación (adicional) de la función pulmonar por debajo de un umbral clínico (o individual). Esta reducción puede deberse a procesos de envejecimiento o a un desajuste emergente de la relación pulmón-masa corporal y/o del gasto energético. Mientras que un grupo informó de un curso divergente del crecimiento pulmonar durante la adolescencia según las mediciones espirométricas [141], el estudio EPICure no mostró una recuperación del crecimiento pulmonar subóptimo de los 11 a los 19 años en adolescentes tras un parto prematuro extremo, independientemente del estado de la DBP, e incluso demostró un deterioro significativo de todos los parámetros de la función pulmonar en pacientes extremadamente prematuros de 19 años [144]. Mientras tanto, Vollsaeter y sus colegas informaron de cursos paralelos de la función pulmonar en la edad adulta temprana [146].
La mejor comprensión de las características y efectos del envejecimiento pulmonar prematuro tras el nacimiento pretérmino [147,148] y aclarar la caracterización del impacto de las lesiones secundarias, por ejemplo, del tabaquismo, de las exacerbaciones en el contexto de infecciones víricas y de influencias medioambientales más amplias en el curso de la función pulmonar. [149,150] también será crucial para el asesoramiento precoz de las familias con respecto a la evolución a largo plazo y el acuerdo sobre las estrategias de control.
Otro campo se define por la aparición de comorbilidades para las que el TLP representa un factor de riesgo por derecho propio [151]. Esto afecta a las enfermedades neurológicas y cardiovasculares e incluye la consideración de las complicaciones asociadas a la terapia. El tratamiento con dexametasona, en particular, desempeña aquí un papel especial, con efectos adversos sobre la función cardiaca, la esperanza de vida y el desarrollo neurológico [152,153].
Resumen
La respuesta del pulmón inmaduro a los mecanismos de daño pre y postnatal, manifestada por una respuesta inflamatoria sostenida, una respuesta de estrés oxidativo y una señalización alterada del factor de crecimiento, que conduce a graves alteraciones en el desarrollo alveolar y vascular, incluida la remodelación de la matriz extracelular, se asocia a importantes consecuencias a largo plazo. Las anomalías de la función pulmonar (y de la inmunidad) en la lactancia y la primera infancia predisponen a una función pulmonar reducida en los adultos supervivientes de partos prematuros y a la alteración del proceso de envejecimiento fisiológico a través de un “efecto memoria” pulmonar en respuesta a lesiones tempranas. Es necesario un intercambio iterativo de conocimientos entre pediatras, médicos de cabecera y neumólogos de adultos para generar una mejor comprensión de estos resultados a largo plazo, incluidas las características y los efectos del envejecimiento prematuro, y traducirlos en estrategias de tratamiento adaptadas y recomendaciones sobre el estilo de vida para este grupo de pacientes. La interpretación de los resultados de la función pulmonar también debe tener en cuenta la definición original subyacente de DBP y las normas aplicadas de atención perinatal en el contexto de la edad a la que se diagnosticó la DBP.
Mensajes para llevarse a casa
- La DBP es una enfermedad respiratoria crónica de la infancia caracterizada por la rarefacción alveolar, la afectación de las vías respiratorias pequeñas y los cambios vasculares pulmonares. Las observaciones de seguimiento de la función pulmonar pueden incluir una disminución de la capacidad de un segundo en niños y adultos con antecedentes de DBP.
- La asociación característica de una alveolarización alterada con la presencia de capilares dismórficos se debe a una expresión alterada de los factores de crecimiento angiogénicos. Algunos cambios son similares a los del organismo que envejece y contribuyen al riesgo de HAP y al deterioro del desarrollo del sistema linfático en los pulmones a medida que avanza.
- La DBP, como resultado de la remodelación, se caracteriza por una disposición patológica de la elastina y cambios cualitativos y cuantitativos en el andamiaje de colágeno, que afectan a la función estructurante de la matriz como andamiaje para la formación de nuevos alvéolos y capilares y definen el destino de las células que pueblan el órgano en desarrollo.
- El daño precoz del pulmón provoca una respuesta inflamatoria persistente, una respuesta de estrés oxidativo y una alteración de la transducción de señales de importantes factores de crecimiento.
- Es necesario un intercambio iterativo de conocimientos entre pediatras, médicos generalistas y neumólogos de adultos para lograr una mejor comprensión de los resultados a largo plazo, incluidas las características y los efectos del envejecimiento prematuro.
- El impacto de la enfermedad pulmonar crónica precoz en el desarrollo de comorbilidades debe tenerse en cuenta a la hora de diseñar estrategias de seguimiento y tratamiento y de hacer recomendaciones sobre el estilo de vida para este grupo de pacientes.
Literatura:
- Jobe AH, Bancalari E: Displasia broncopulmonar. Am J Respir Crit Care Med 2001; 163(7): 1723-1729.
- Duijts L, van Meel ER, Moschino L, et al: Directriz de la Sociedad Respiratoria Europea sobre el tratamiento a largo plazo de los niños con displasia broncopulmonar. Eur Respir J 2020; 55(1).
- Doyle LW: Evaluación de los cuidados intensivos neonatales para recién nacidos de peso extremadamente bajo. Semin Fetal Neonatal Med 2006; 11(2): 139-145.
- Gortner L, Misselwitz B, Milligan D, miembros del MRG, et al: Tasas de displasia broncopulmonar en neonatos muy prematuros en Europa: resultados de la cohorte MOSAIC. Neonatología 2011; 99(2): 112-117.
- Stoll BJ, Hansen NI, Bell EF, Eunice Kennedy Shriver National Institute of Child H, Human Development Neonatal Research N, et al: Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatría 2010; 126(3): 443-456.
- Vachon E, Bourbonnais Y, Bingle CD, et al.: Efecto antiinflamatorio de la preelafina en la inflamación pulmonar aguda inducida por lipopolisacáridos. Biol Chem 2002; 383(7-8): 1249-1256.
- Van Marter LJ, Pagano M, Allred EN, et al: Tasa de displasia broncopulmonar en función de las prácticas de cuidados intensivos neonatales. J Pediatr 1992; 120(6): 938-946.
- Ehrenkranz RA, Walsh MC, Vohr BR, National Institutes of Child H, Human Development Neonatal Research N, et al: Validation of the National Institutes of Health consensus definition of bronchopulmonary dysplasia. Pediatría 2005; 116(6): 1353-1360.
- Johnson AH, Peacock JL, Greenough A, United Kingdom Oscillation Study G, et al: Ventilación oscilatoria de alta frecuencia para la prevención de la enfermedad pulmonar crónica del prematuro. N Engl J Med 2002; 347(9): 633-642.
- Chawanpaiboon S, Vogel JP, Moller AB, et al: Estimaciones mundiales, regionales y nacionales de los niveles de nacimientos prematuros en 2014; una revisión sistemática y un análisis de modelos. Lancet Glob Health 2019; 7(1): e37-e46.
- Clyman R, Cassady G, Kirklin JK, et al: The role of patent ductus arteriosus ligation in bronchopulmonary dysplasia: reexamining a randomized controlled trial. J Pediatr 2009; 154(6): 873-876.
- Korhonen P, Tammela O, Koivisto AM, et al: Frecuencia y factores de riesgo en la displasia broncopulmonar en una cohorte de recién nacidos de muy bajo peso. Early Hum Dev 1999; 54(3): 245-258.
- Kramer BW: Inflamación prenatal y lesión pulmonar: origen prenatal de la enfermedad neonatal. J Perinatol 2008; 28 Suppl 1: S21-27.
- Mittendorf R, Covert R, Montag AG, et al: Relaciones especiales entre el síndrome de respuesta inflamatoria fetal y la displasia broncopulmonar en neonatos. J Perinat Med 2005; 33(5): 428-434.
- Oh W, Poindexter BB, Perritt R, Neonatal Research N, et al: Association between fluid intake and weight loss during the first ten days of life and risk of bronchopulmonary dysplasia in extremely low birth weight infants. J Pediatr 2005; 147(6): 786-790.
- Stevens TP, Harrington EW, Blennow M, Soll RF: Administración precoz de surfactante con ventilación breve frente a surfactante selectivo y ventilación mecánica continuada para recién nacidos prematuros con síndrome de dificultad respiratoria o en riesgo de padecerlo. Cochrane Database Syst Rev 2007(4); CD003063.
- Biniwale MA, Ehrenkranz RA: El papel de la nutrición en la prevención y el tratamiento de la displasia broncopulmonar. Semin Perinatol 2006; 30(4): 200-208.
- Shenai JP, Chytil F, Stahlman MT: Estado de la vitamina A en neonatos con displasia broncopulmonar. Pediatr Res 1985; 19(2): 185-188.
- Watterberg KL, Scott SM: Pruebas de insuficiencia suprarrenal precoz en bebés que desarrollan displasia broncopulmonar. Pediatría 1995; 95(1): 120-125.
- Bose C, Van Marter LJ, Laughon M, Extremely Low Gestational Age Newborn Study I, et al: Restricción del crecimiento fetal y enfermedad pulmonar crónica entre los lactantes nacidos antes de la semana 28 de gestación. Pediatría 2009; 124(3): e450-458.
- Regev RH, Lusky A, Dolfin T, Israel Neonatal N, et al: Exceso de mortalidad y morbilidad entre los prematuros pequeños para la edad gestacional: un estudio basado en la población. J Pediatr 2003; 143(2): 186-191.
- Reiss I, Landmann E, Heckmann M, et al: Mayor riesgo de displasia broncopulmonar y mayor mortalidad en los recién nacidos muy prematuros pequeños para la edad gestacional. Arch Gynecol Obstet 2003; 269(1): 40-44.
- Rieger-Fackeldey E, Schulze A, Pohlandt F, et al: Resultados a corto plazo en lactantes con un peso inferior a 501 gramos al nacer. Acta Pediatr 2005; 94(2): 211-216.
- Walsh MC, Yao Q, Horbar JD, et al: Cambios en el uso de esteroides postnatales para la displasia broncopulmonar en 3 grandes redes neonatales. Pediatría 2006; 118(5): e1328-1335.
- Rozance PJ, Seedorf GJ, Brown A, et al: La restricción del crecimiento intrauterino disminuye el crecimiento alveolar y vascular pulmonar y provoca una disfunción de las células endoteliales de la arteria pulmonar in vitro en ovejas fetales. Am J Physiol Lung Cell Mol Physiol 2011; 301(6): L860-871.
- Gilliland FD, Berhane K, McConnell R, et al: Tabaquismo materno durante el embarazo, exposición ambiental al humo del tabaco y función pulmonar infantil. Thorax 2000; 55(4): 271-276.
- Vogt Isaksen C: Tabaquismo materno, retraso del crecimiento intrauterino y apoptosis placentaria. Pediatr Dev Pathol 2004; 7(5): 433-442.
- Bhandari V, Bizzarro MJ, Shetty A, Neonatal Genetics Study G, et al: Susceptibilidad familiar y genética a las principales morbilidades neonatales en gemelos prematuros. Pediatría 2006; 117(6): 1901-1906.
- Hallman M, Haataja R: Influencias genéticas y enfermedad pulmonar neonatal. Semin Neonatol 2003; 8(1): 19-27.
- Hilgendorff A, Heidinger K, Pfeiffer A, et al.: Asociación de polimorfismos en el gen de la lectina de unión a manosa y morbilidad pulmonar en recién nacidos prematuros. Genes Immun 2007; 8(8): 671-677.
- Poggi C, Giusti B, Vestri A, et al: Polimorfismos genéticos de las enzimas antioxidantes en lactantes prematuros. J Matern Fetal Neonatal Med 2012; 25 Suppl 4: 131-134.
- Binet ME, Bujold E, Lefebvre F, Canadian Neonatal N, et al: Papel del género en la morbilidad y mortalidad de los neonatos extremadamente prematuros. Am J Perinatol 2012; 29(3): 159-166.
- Trotter A, Maier L, Kron M, Pohlandt F: Efecto del reemplazo de estradiol y progesterona sobre la displasia broncopulmonar en recién nacidos extremadamente prematuros. Arch Dis Child Fetal Neonatal Ed 2007; 92(2): F94-98.
- Vrijlandt EJ, Gerritsen J, Boezen HM, Duiverman EJ, Dutch P-CSG: Diferencias de género en los síntomas respiratorios en adultos de 19 años nacidos prematuros. Respir Res 2005; 6: 117.
- Wadon M, Modi N, Wong HS, et al: Avances recientes en la genética del parto prematuro. Ann Hum Genet 2020; 84(3): 205-213.
- Fraser J, Walls M, McGuire W: Complicaciones respiratorias del parto prematuro. BMJ 2004; 329(7472): 962-965.
- Wang H, St Julien KR, Stevenson DK, et al: Un estudio de asociación del genoma completo (GWAS) para la displasia broncopulmonar. Pediatría 2013; 132(2): 290-297.
- Lommatzsch ST, Aris R: Genética de la fibrosis quística. Semin Respir Crit Care Med 2009; 30(5): 531-538.
- Sztrymf B, Coulet F, Girerd B, et al: Resultados clínicos de la hipertensión arterial pulmonar en portadores de la mutación BMPR2. Am J Respir Crit Care Med 2008; 177(12): 1377-1383.
- Austin ED, Loyd JE: La genética de la hipertensión arterial pulmonar. Circ Res 2014; 115(1): 189-202.
- Husain AN, Siddiqui NH, Stocker JT: Patología del desarrollo acinar detenido en la displasia broncopulmonar postsurfactante. Hum Pathol 1998; 29(7): 710-717.
- Lopez E, Mathlouthi J, Lescure S, et al: Capnografía en recién nacidos prematuros con respiración espontánea y displasia broncopulmonar. Pediatr Pulmonol 2011; 46(9): 896-902.
- Stoll BJ, Gordon T, Korones SB, et al: Sepsis de aparición precoz en neonatos de muy bajo peso al nacer: un informe de la Red de Investigación Neonatal del Instituto Nacional de Salud Infantil y Desarrollo Humano. J Pediatr 1996; 129(1): 72-80.
- Watterberg KL, Demers LM, Scott SM, Murphy S: Corioamnionitis e inflamación pulmonar precoz en lactantes en los que se desarrolla displasia broncopulmonar. Pediatría 1996; 97(2): 210-215.
- Yoon BH, Romero R, Jun JK, et al: Citocinas del líquido amniótico (interleucina-6, factor de necrosis tumoral-alfa, interleucina-1 beta e interleucina-8) y riesgo de desarrollo de displasia broncopulmonar. Am J Obstet Gynecol 1997; 177(4): 825-830.
- Speer CP: Inflamación y displasia broncopulmonar: una historia que continúa. Semin Fetal Neonatal Med 2006; 11(5): 354-362.
- Todd DA, Earl M, Lloyd J, Greenberg M, John E: Cambios citológicos en los aspirados endotraqueales asociados a la enfermedad pulmonar crónica. Early Hum Dev 1998; 51(1): 13-22.
- Ibrahim J, Garantziotis S, Savani R: Actualizaciones sobre la enfermedad pulmonar crónica neonatal 2020, Capítulo 9 – La superautopista de la inflamación: peajes, señales y vías hacia la displasia broncopulmonar. 131-150.
- Atochina-Vasserman EN, Bates SR, Zhang P, et al: La disfunción epitelial alveolar temprana promueve la inflamación pulmonar en un modelo de ratón del síndrome de Hermansky-Pudlak. Am J Respir Crit Care Med 2011; 184(4): 449-458.
- Hilgendorff A, Parai K, Ertsey R, et al: La inhibición de la actividad de la elastasa pulmonar permite el crecimiento pulmonar en ratones recién nacidos con ventilación mecánica. Am J Respir Crit Care Med 2011; 184(5): 537-546.
- Stoll BJ, Hansen N, Fanaroff AA, et al: Cambios en los patógenos causantes de sepsis de aparición temprana en recién nacidos de muy bajo peso. N Engl J Med 2002; 347(4): 240-247.
- Olszak T, An D, Zeissig S, et al.: La exposición microbiana durante los primeros años de vida tiene efectos persistentes sobre la función de las células T asesinas naturales. Science 2012; 336(6080): 489-493.
- Bose CL, Laughon MM, Allred EN, Investigators ES, et al: Inflamación sistémica asociada a la ventilación mecánica en recién nacidos extremadamente prematuros. Citocina 2013; 61(1): 315-322.
- Jobe AH, Kallapur SG: Consecuencias a largo plazo de la oxigenoterapia en el periodo neonatal. Semin Fetal Neonatal Med 2010; 15(4): 230-235.
- Kroon AA, Wang J, Huang Z, et al: Respuesta inflamatoria al oxígeno y la endotoxina en pulmones de rata recién nacida ventilados con bajo volumen corriente. Pediatr Res 2010; 68(1): 63-69.
- Polglase GR, Hillman NH, Ball MK, et al: Inflamación pulmonar y sistémica en corderos prematuros con presión positiva continua en las vías respiratorias o ventilación convencional. Pediatr Res 2009; 65(1): 67-71.
- Kunzmann S, Speer CP, Jobe AH, Kramer BW: La inflamación prenatal induce el TGF-beta1 pero suprime el CTGF en los pulmones de los prematuros. Am J Physiol Lung Cell Mol Physiol 2007; 292(1): L223-231.
- Kazzi SN, Kim UO, Quasney MW, Buhimschi I: Polimorfismo del factor de necrosis tumoral-alfa y riesgo y gravedad de la displasia broncopulmonar entre los recién nacidos de muy bajo peso. Pediatría 2004; 114(2): e243-248.
- Nold MF, Mangan NE, Rudloff I, et al: El antagonista del receptor de la interleucina 1 previene la displasia broncopulmonar murina inducida por la inflamación perinatal y la hiperoxia. Proc Natl Acad Sci U S A 2013; 110(35): 14384-14389.
- Ibrahim JG, Stavros; Savani, Rashmin: La superautopista de la inflamación: peajes, señales y vías hacia la displasia broncopulmonar. En: Kallapur SP, Gloria, ed. Actualizaciones sobre la enfermedad pulmonar crónica neonatal. Elsevier 2020; 131-150.
- Lechner AJ, Driver IH, Lee J, et al: Los monocitos reclutados y la inmunidad de tipo 2 promueven la regeneración pulmonar tras una neumonectomía. Cell Stem Cell 2017; 21(1): 120-134 e127.
- McQuattie-Pimentel AC, Budinger GRS, Ballinger MN: Macrófagos alveolares derivados de monocitos: ¿el lado oscuro de la reparación pulmonar? Am J Respir Cell Mol Biol 2018; 58(1): 5-6.
- Olin A, Henckel E, Chen Y, et al: Desarrollo estereotipado del sistema inmunitario en recién nacidos. Cell 2018; 174(5): 1277-1292 e1214.
- Zaslona Z, Przybranowski S, Wilke C, et al: Los macrófagos alveolares residentes suprimen, mientras que los monocitos reclutados promueven, la inflamación pulmonar alérgica en modelos murinos de asma. J Immunol 2014; 193(8): 4245-4253.
- Yamada M, Fujino N, Ichinose M: Respuestas inflamatorias en el inicio de la reparación y regeneración pulmonar: su papel en la estimulación de las células madre residentes en el pulmón. Inflamm Regen 2016; 36: 15.
- Bose CL, Dammann CE, Laughon MM: Displasia broncopulmonar y biomarcadores inflamatorios en el neonato prematuro. Arch Dis Child Fetal Neonatal Ed 2008; 93(6): F455-461.
- Rose MJ, Stenger MR, Joshi MS, et al: El óxido nítrico inhalado disminuye el tráfico de leucocitos en el pulmón de ratón neonatal durante la exposición a >95% de oxígeno. Pediatr Res 2010; 67(3): 244-249.
- Vento G, Tirone C, Lulli P, et al: La peptidómica del líquido de lavado broncoalveolar sugiere un posible papel de la metaloproteinasa de matriz-3 en la displasia broncopulmonar. Medicina intensiva 2009; 35(12): 2115-2124.
- Watterberg KL, Carmichael DF, Gerdes JS, et al: Inhibidor de la proteasa leucocitaria secretora e inflamación pulmonar en la displasia broncopulmonar en desarrollo. J Pediatr 1994; 125(2): 264-269.
- Weinberger B, Anwar M, Henien S, et al: Asociación de la peroxidación lipídica con la betametasona prenatal y los trastornos radiales del oxígeno en los recién nacidos prematuros. Biol Neonate 2004; 85(2): 121-127.
- Collard KJ, Godeck S, Holley JE, Quinn MW: Concentraciones pulmonares de antioxidantes y daño oxidativo en bebés prematuros ventilados. Arch Dis Child Fetal Neonatal Ed 2004; 89(5): F412-416.
- Filippone M, Bonetto G, Corradi M, et al: Pruebas de estrés oxidativo inesperado en las vías respiratorias de adolescentes nacidos muy prematuros. Eur Respir J 2012; 40(5): 1253-1259.
- Hennessy EM, Bracewell MA, Wood N, Group EPS, et al: Respiratory health in pre-school and school age children following extremely preterm birth. Arch Dis Child 2008; 93(12): 1037-1043.
- Merritt TA, Deming DD, Boynton BR: La “nueva” displasia broncopulmonar: retos y comentarios. Semin Fetal Neonatal Med 2009; 14(6): 345-357.
- Buczynski BW, Yee M, Paige Lawrence B, O’Reilly MA: El desarrollo pulmonar y la respuesta del huésped al virus de la gripe A se ven alterados por diferentes dosis de oxígeno neonatal en ratones. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1078-1087.
- Belik J, Jankov RP, Pan J, Tanswell AK: La exposición crónica al O2 aumenta la contracción del músculo liso vascular y de las vías respiratorias en la rata recién nacida pero no en la adulta. J Appl Physiol (1985) 2003; 94(6): 2303-2312.
- Yee M, White RJ, Awad HA, Bates WA, et al: La hiperoxia neonatal causa enfermedad vascular pulmonar y acorta la vida en ratones envejecidos. Am J Pathol 2011; 178(6): 2601-2610.
- Balasubramaniam V, Mervis CF, Maxey AM, et al: La hiperoxia reduce las células progenitoras endoteliales de la médula ósea, circulantes y pulmonares en el pulmón en desarrollo: implicaciones para la patogénesis de la displasia broncopulmonar. Am J Physiol Lung Cell Mol Physiol 2007; 292(5): L1073-1084.
- Londhe VA, Sundar IK, Lopez B, et al: La hiperoxia perjudica la formación alveolar e induce la senescencia a través de la disminución de la actividad de la histona desacetilasa y la regulación al alza de p21 en el pulmón neonatal de ratón. Pediatr Res 2011; 69(5 Pt 1): 371-377.
- Nanduri J, Makarenko V, Reddy VD, et al: La regulación epigenética de la detección hipóxica altera la homeostasis cardiorrespiratoria. Proc Natl Acad Sci U S A 2012; 109(7): 2515-2520.
- Jankov RP, Keith Tanswell A: Factores de crecimiento, crecimiento pulmonar postnatal y displasia broncopulmonar. Paediatr Respir Rev 2004; 5 Suppl A: S265-275.
- Alejandre-Alcazar MA, Kwapiszewska G, Reiss I, et al: La hiperoxia modula la señalización TGF-beta/BMP en un modelo de ratón de displasia broncopulmonar. Am J Physiol Lung Cell Mol Physiol 2007; 292(2): L537-549.
- Chao CM, Moiseenko A, Kosanovic D, et al: Impacto de la deficiencia de Fgf10 en la formación de la vasculatura pulmonar en un modelo de ratón de displasia broncopulmonar. Hum Mol Genet 2019; 28(9): 1429-1444.
- Li C, Smith SM, Peinado N, et al: La señalización WNT5a-ROR es esencial para la alveologénesis. Células 2020; 9(2).
- Oak P, Hilgendorff A: ¿El trío BPD? Interacción de la señalización desregulada de PDGF, VEGF y TGF en la enfermedad pulmonar crónica neonatal. Mol Cell Pediatr 2017; 4(1): 11.
- Sucre JM, Wilkinson D, Vijayaraj P, et al: Un modelo humano tridimensional de la activación fibroblástica que acompaña a la displasia broncopulmonar identifica la fisiopatología mediada por Notch. Am J Physiol Lung Cell Mol Physiol 2016; 310(10): L889-898.
- Sucre JMS, Deutsch GH, Jetter CS, et al: Un patrón compartido de activación de beta-catenina en la displasia broncopulmonar y la fibrosis pulmonar idiopática. Am J Pathol 2018; 188(4): 853-862.
- Iosef C, Alastalo TP, Hou Y, et al: La inhibición de NF-kappaB en el pulmón en desarrollo altera la angiogénesis y la alveolarización. Am J Physiol Lung Cell Mol Physiol 2012; 302(10): L1023-1036.
- Didon L, Roos AB, Elmberger GP, et al: La inactivación específica pulmonar de la proteína de unión a potenciadores CCAAT/alfa provoca un patrón patológico característico de la EPOC. Eur Respir J 2010; 35(1): 186-197.
- Alvira CM, Abate A, Yang G, et al: La activación del factor nuclear-kappaB en el pulmón neonatal del ratón protege contra la inflamación inducida por lipopolisacáridos. Am J Respir Crit Care Med 2007; 175(8): 805-815.
- Yang G, Abate A, George AG, et al: Diferencias madurativas en la activación del NF-kappaB pulmonar y su papel en la tolerancia a la hiperoxia. J Clin Invest 2004; 114(5): 669-678.
- De Paepe ME, Greco D, Mao Q: Perfiles de expresión génica relacionados con la angiogénesis en pulmones humanos pretérmino ventilados. Exp Lung Res 2010; 36(7): 399-410.
- De Paepe ME, Mao Q, Powell J, et al: Crecimiento de la microvasculatura pulmonar en recién nacidos prematuros ventilados. Am J Respir Crit Care Med 2006; 173(2): 204-211.
- Thebaud B: Angiogénesis en el desarrollo, lesión y reparación pulmonar: implicaciones para la enfermedad pulmonar crónica del prematuro. Neonatología 2007; 91(4): 291-297.
- Ito Y, Betsuyaku T, Nagai K, et al.: La expresión de la familia VEGF pulmonar disminuye con la edad y se regula aún más a la baja en la lesión pulmonar inducida por lipopolisacárido (LPS). Exp Gerontol 2005; 40(4): 315-323.
- Vyas-Read S, Shaul PW, Yuhanna IS, Willis BC: El óxido nítrico atenúa la transición epitelio-mesénquima en las células epiteliales alveolares. Am J Physiol Lung Cell Mol Physiol 2007; 293(1): L212-221.
- Bland RD, Ling CY, Albertine KH, et al: Disfunción vascular pulmonar en corderos prematuros con enfermedad pulmonar crónica. Am J Physiol Lung Cell Mol Physiol 2003; 285(1): L76-85.
- Kamba T, Tam BY, Hashizume H, Haskell A, et al: Plasticidad dependiente del VEGF de los capilares fenestrados en la microvasculatura adulta normal. Am J Physiol Heart Circ Physiol 2006; 290(2): H560-576.
- Kinsella JP, Greenough A, Abman SH: Displasia broncopulmonar. Lancet 2006; 367(9520): 1421-1431.
- Steinhorn RH: Hipertensión pulmonar neonatal. Pediatr Crit Care Med 2010; 11(2 Suppl): S79-84.
- Torday JS, Rehan VK: La mecanotransducción determina la estructura y la función pulmonar y ósea: un modelo teórico para la fisiopatología de las enfermedades crónicas. Cell Biochem Biophys 2003; 37(3): 235-246.
- Mizikova I, Morty RE: La matriz extracelular en la displasia broncopulmonar: diana y fuente. Front Med (Lausana) 2015; 2: 91.
- Bruce MC, Schuyler M, Martin RJ, et al: Factores de riesgo para la degradación de las fibras elásticas pulmonares en el neonato ventilado. Implicaciones para el desarrollo pulmonar deficiente en la displasia broncopulmonar. Am Rev Respir Dis 1992; 146(1): 204-212.
- Bruce MC, Wedig KE, Jentoft N, et al: Altered urinary excretion of elastin cross-links in premature infants who develop bronchopulmonary dysplasia. Am Rev Respir Dis 1985; 131(4): 568-572.
- Merritt TA, Cochrane CG, Holcomb K, et al: Elastase and alpha 1-proteinase inhibitor activity in tracheal aspirates during respiratory distress syndrome. Papel de la inflamación en la patogénesis de la displasia broncopulmonar. J Clin Invest 1983; 72(2): 656-666.
- Tenholder MF, Rajagopal KR, Phillips YY, et al: Excreción urinaria de desmosina como marcador de lesión pulmonar en el síndrome de distrés respiratorio del adulto. Tórax 1991; 100(5): 1385-1390.
- Lukkarinen H, Hogmalm A, Lappalainen U, Bry K: La deficiencia de metaloproteinasa de matriz-9 empeora la lesión pulmonar en un modelo de displasia broncopulmonar. Am J Respir Cell Mol Biol 2009; 41(1): 59-68.
- Pierce RA, Albertine KH, Starcher BC, et al: Lesión pulmonar crónica en corderos prematuros: deposición desordenada de elastina pulmonar. Am J Physiol 1997; 272(3 Pt 1): L452-460.
- Thibeault DW, Mabry SM, Ekekezie, II, Truog WE: Maduración y alteraciones del tejido elástico pulmonar durante la evolución de la enfermedad pulmonar crónica. Pediatría 2000; 106(6): 1452-1459.
- Thibeault DW, Mabry SM, et al: El andamiaje del colágeno durante el desarrollo y su deformación con la enfermedad pulmonar crónica. Pediatría 2003; 111(4 Pt 1): 766-776.
- Bonvillain RW, Danchuk S, Sullivan DE, et al.: Un modelo de primate no humano de regeneración pulmonar: descelularización mediada por detergente y recelularización inicial in vitro con células madre mesenquimales. Tissue Eng Part A 2012; 18(23-24): 2437-2452.
- Jensen T, Roszell B, Zang F, et al.: Un protocolo de descelularización pulmonar rápida favorece la diferenciación de células madre embrionarias in vitro y tras la implantación. Tissue Eng Part C Methods 2012; 18(8): 632-646.
- Förster K, Ertl-Wagner B, Ehrhardt H, et al: Los tiempos de relajación alterados en la resonancia magnética indican displasia broncopulmonar. Tórax 2019; tóraxjnl-2018-212384.
- Oda K, Ishimoto H, Yatera K, et al: La escala de clasificación basada en el sistema de puntuación de TC de alta resolución predice los resultados clínicos en pacientes con fibrosis pulmonar idiopática. Respir Res 2014; 15: 10.
- Walkup LL, Tkach JA, Higano NS, et al: Resonancia magnética cuantitativa de la displasia broncopulmonar en el entorno de la unidad de cuidados intensivos neonatales. Am J Respir Crit Care Med 2015; 192(10): 1215-1222.
- Washko GR: Diagnóstico por imagen en la EPOC. Semin Respir Crit Care Med 2010; 31(3): 276-285.
- Weatherley ND, Eaden JA, Stewart NJ, et al: Técnicas de imagen experimentales y cuantitativas en la enfermedad pulmonar intersticial. Thorax 2019; 74(6): 611-619.
- Capaldi DP, Zha N, Guo F, et al: Biomarcadores de imagen pulmonar del atrapamiento de gases y el enfisema en la EPOC: Mapas de respuesta paramétrica de RMN (3)He y TC. Radiología 2016; 279(2): 597-608.
- De Boeck K, Derichs N, Fajac I, Grupo EDNW, EuroCare CFWPGoCFd, et al: Nuevos procedimientos de diagnóstico clínico de la fibrosis quística en Europa. J Cyst Fibros 2011; 10 Suppl 2: S53-66.
- Sileo C, Corvol H, Boelle PY, et al: HRCT y RM del pulmón en niños con fibrosis quística: comparación de diferentes sistemas de puntuación. J Cyst Fibros 2014; 13(2): 198-204.
- Tulek B, Kivrak AS, Ozbek S, et al: Fenotipado de la enfermedad pulmonar obstructiva crónica mediante el sistema de puntuación de Bhalla modificado para la tomografía computarizada de alta resolución. Can Respir J 2013; 20(2): 91-96.
- Jobe AH, Ikegami M: Prevención de la displasia broncopulmonar. Curr Opin Pediatr 2001; 13(2): 124-129.
- Newman JB, DeBastos AG, Batton D, Raz S: Disfunción respiratoria neonatal y rendimiento neuropsicológico en la edad preescolar: un estudio de niños muy prematuros con displasia broncopulmonar. Neuropsicología 2011; 25(5): 666-678.
- Bolton CE, Bush A: Próximamente en una clínica de tórax cercana. Thorax 2013; 68(8): 707-708.
- Bolton CE, Bush A, Hurst JR, et al: Consecuencias pulmonares en adultos nacidos prematuramente. Thorax 2015; 70(6): 574-580.
- May C, Kennedy C, Milner AD, et al: Anomalías de la función pulmonar en lactantes que desarrollan displasia broncopulmonar. Arch Dis Child 2011; 96(11): 1014-1019.
- Miller MR, Pedersen OF, Lange P, Vestbo J: Mejora de la predicción de la supervivencia a partir de datos de la función pulmonar en una gran muestra de población. Respir Med 2009; 103(3): 442-448.
- Hilgendorff A, Reiss I, Gortner L, et al: Impacto de la obstrucción de las vías respiratorias en la función pulmonar de los recién nacidos muy prematuros a término. Pediatr Crit Care Med 2008; 9(6): 629-635.
- Greenough A, Alexander J, Burgess S, et al: Utilización de asistencia sanitaria preescolar relacionada con el estado del oxígeno domiciliario. Arch Dis Child Fetal Neonatal Ed 2006; 91(5): F337-341.
- Greenough A, Alexander J, Burgess S, et al: Estado del oxígeno domiciliario y necesidades de rehospitalización y atención primaria de los lactantes con enfermedad pulmonar crónica. Arch Dis Child 2002; 86(1): 40-43.
- Doyle LW, Cheung MM, Ford GW, et al: Peso al nacer <1501 g y salud respiratoria a los 14 años. Arch Dis Child 2001; 84(1): 40-44.
- Greenough A, Cox S, Alexander J, et al: Utilización de la asistencia sanitaria en lactantes con enfermedad pulmonar crónica, relacionada con la hospitalización por infección por VRS. Arch Dis Child 2001; 85(6): 463-468.
- Broughton S, Roberts A, Fox G, et al: Estudio prospectivo de la utilización de la asistencia sanitaria y la morbilidad respiratoria debida a la infección por VRS en niños nacidos prematuramente. Thorax 2005; 60(12): 1039-1044.
- Baraldi E, Carraro S, Filippone M: Displasia broncopulmonar: definiciones y resultados respiratorios a largo plazo. Early Hum Dev 2009; 85(10 Suppl): 1-3.
- Greenough A, Limb E, Marston L, et al: Factores de riesgo de morbilidad respiratoria en la infancia tras un nacimiento muy prematuro. Arch Dis Child Fetal Neonatal Ed 2005; 90(4): F320-323.
- Gross SJ, Iannuzzi DM, Kveselis DA, Anbar RD: Efecto del nacimiento prematuro sobre la función pulmonar en la edad escolar: un estudio prospectivo controlado. J Pediatr 1998; 133(2): 188-192.
- Broughton S, Thomas MR, Marston L, et al: Niños muy prematuros con sibilancias durante el seguimiento: función pulmonar y factores de riesgo. Arch Dis Child 2007; 92(9): 776-780.
- Pelkonen AS, Hakulinen AL, Turpeinen M: Labilidad bronquial y capacidad de respuesta en escolares nacidos muy prematuros. Am J Respir Crit Care Med 1997; 156(4 Pt 1): 1178-1184.
- Yuksel B, Greenough A: Relación de los síntomas con las anomalías de la función pulmonar en recién nacidos prematuros durante el seguimiento. Pediatr Pulmonol 1991; 11(3): 202-206.
- Welsh L, Kirkby J, Lum S, Odendaal D, Group EPS, et al: The EPICure study: maximal exercise and physical activity in school children born extremely preterm. Thorax 2010; 65(2): 165-172.
- Doyle LW, Faber B, Callanan C, et al: Displasia broncopulmonar en sujetos de muy bajo peso al nacer y función pulmonar en la adolescencia tardía. Pediatría 2006; 118(1): 108-113.
- Greenough A, Dimitriou G, Bhat RY, et al: Volúmenes pulmonares en lactantes con displasia broncopulmonar de leve a moderada. Eur J Pediatr 2005; 164(9): 583-586.
- Hjalmarson O, Sandberg KL: La función pulmonar a término refleja la gravedad de la displasia broncopulmonar. J Pediatr 2005; 146(1): 86-90.
- Hurst JR, Beckmann J, Ni Y, et al: Resultados respiratorios y cardiovasculares en supervivientes de parto extremadamente prematuro a los 19 años. Am J Respir Crit Care Med 2020; 202(3): 422-432.
- Northway WH, Jr, Moss RB, Carlisle KB, et al: Secuelas pulmonares tardías de la displasia broncopulmonar. N Engl J Med 1990; 323(26): 1793-1799.
- Vollsaeter M, Roksund OD, Eide GE, et al: Función pulmonar tras el nacimiento prematuro: desarrollo desde la infancia media hasta la edad adulta. Thorax 2013; 68(8): 767-776.
- Bolton CE, Bush A, Hurst JR, et al: ¿Se tienen en cuenta los factores de los primeros años de vida en el tratamiento de las enfermedades respiratorias? Una encuesta de la Sociedad Torácica Británica sobre la práctica actual. Tórax 2012; 67(12): 1110.
- Crump C: La elaboración de la historia clínica en adultos debe incluir preguntas sobre el parto prematuro. BMJ 2014; 349: g4860.
- Baraldi E, Filippone M: Enfermedad pulmonar crónica tras el nacimiento prematuro. N Engl J Med 2007; 357(19): 1946-1955.
- Filippone M, Carraro S, Baraldi E: ¿De la DBP a la EPOC? La hipótesis es intrigante pero carecemos de datos de patología pulmonar en humanos. Eur Respir J 2010; 35(6): 1419-1420; respuesta del autor 1420.
- Anderson PJ, Doyle LW: Resultados del neurodesarrollo de la displasia broncopulmonar. Semin Perinatol 2006; 30(4): 227-232.
- Bal MP, de Vries WB, van Oosterhout MF, et al: Efectos cardiovasculares a largo plazo del tratamiento neonatal con dexametasona: seguimiento hemodinámico mediante bucles de presión-volumen ventricular izquierdo en ratas. J Appl Physiol (1985) 2008; 104(2): 446-450.
- Kamphuis PJ, de Vries WB, Bakker JM, et al: Reducción de la esperanza de vida en ratas tras el tratamiento neonatal con dexametasona. Pediatr Res 2007; 61(1): 72-76.
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2021; 3(2): 10-15