¿Debe resecarse inicialmente un tumor primario colorrectal asintomático con metástasis hepáticas sincrónicas no resecables o sólo si hay una buena respuesta tras la quimioterapia? Esta cuestión volvió a debatirse en la 23ª Semana Europea Unida de Gastroenterología. Un estudio retrospectivo sugiere la equivalencia entre los dos enfoques. Otro estudio se centró en el seguimiento tras la cirugía curativa de los tumores en estadio II-III de la AJCC. En el Simposio sobre Cánceres Gastrointestinales 2016 celebrado en San Francisco, hubo noticias emocionantes sobre el cáncer de recto localmente avanzado.
El cáncer colorrectal es el tercero más frecuente en todo el mundo y es la cuarta causa de muerte [1]. El sitio metastásico primario es el hígado, detectándose la metástasis hepática de forma sincrónica con el diagnóstico del tumor primario en aproximadamente 20% de los pacientes. En otro 25%, las metástasis hepáticas se desarrollan tras un intervalo de tratamiento por carcinoma colorrectal (metástasis metacrónicas).
La gran mayoría de los pacientes con cáncer colorrectal en estadio IV presentan metástasis hepáticas no resecables en el momento del diagnóstico. En la actualidad, la resecabilidad se define principalmente por la posibilidad de resección R0 de las metástasis y por el volumen de tejido hepático sano que queda tras la operación (al menos el 30% del volumen hepático) [2]. En pacientes con cáncer colorrectal metastásico y metástasis hepáticas no resecables, no está claro el valor de la resección paliativa inicial del tumor primario seguida de quimioterapia de primera línea frente a la quimioterapia inmediata seguida de resección para obtener una buena respuesta [3–6]. Esta cuestión también es objeto de estudios clínicos.
Nuevos datos de la UEGW
En la Semana Europea Unida de Gastroenterología (UEGW) de Barcelona se presentó un análisis retrospectivo sobre el tema [7]. Se incluyeron 148 pacientes con cáncer colorrectal y metástasis hepáticas no resecables sincrónicas. Los pacientes fueron observados durante una mediana de 45,5 meses. El 57% de los pacientes fueron tratados con quimioterapia inicial, seguida como máximo de resección del tumor primario y quimioterapia postoperatoria adicional para reducir el tamaño de las metástasis hepáticas (grupo 1). Al 43% restante se le practicó una escisión quirúrgica del tumor primario, seguida como mucho de quimioterapia de primera línea para reducir el tamaño de las metástasis hepáticas (grupo 2). Las características basales de los dos grupos de estudio eran comparables. El criterio de valoración primario fue la supervivencia global tras una mediana de 48 meses.
Grupo 1: 34 de los 85 pacientes de este grupo se sometieron finalmente a una resección colorrectal. De ellos, 33 recibieron quimioterapia de segunda línea. En diez casos hubo que realizar una intervención quirúrgica de urgencia durante la primera quimioterapia: dos perforaciones y cuatro obstrucciones requirieron resección con estoma, dos pacientes recibieron un estoma sin resección y dos un stent metálico autoexpandible. La supervivencia global fue del 15,3%. Las metástasis hepáticas se resecaron tras una buena respuesta a la quimioterapia de conversión en el 20% de los pacientes y se trataron de forma ablativa con radiofrecuencia percutánea en el 16%.
Grupo 2: 42 de los 63 pacientes de este grupo recibieron quimioterapia tras la cirugía (mediana tras 1,43 meses). La supervivencia global fue del 19%. La resección de las metástasis hepáticas fue posible en el 30,2% de los casos, la ablación percutánea por radiofrecuencia se realizó en el 19%.
¿Ambos tratamientos son igual de eficaces?
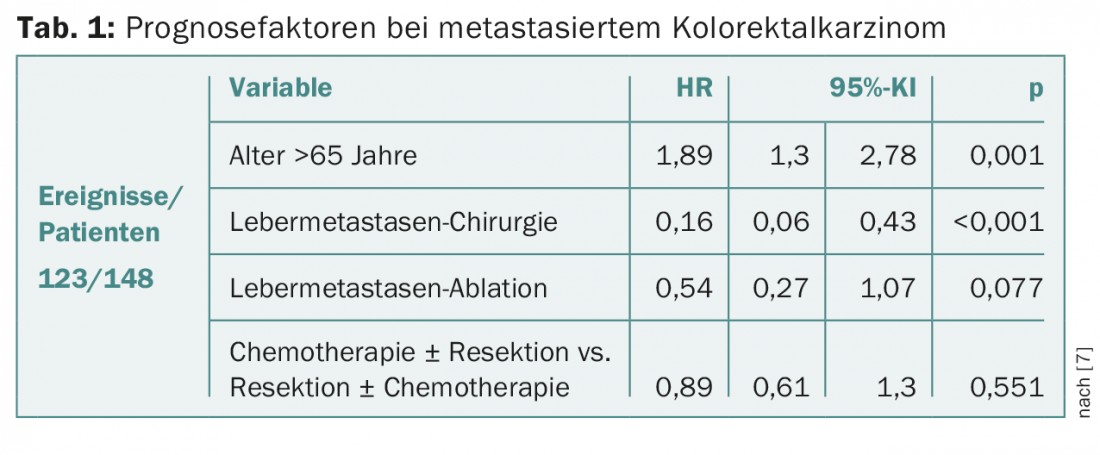
Los dos grupos no difirieron significativamente en cuanto a las tasas de supervivencia (15,3% frente a 19%; p=0,633). Sin embargo, cuando se comparó a las personas que recibieron una resección colorrectal con las que no se sometieron a cirugía en la población general, se encontraron diferencias significativas (p=0,025). En el segundo grupo, la tasa de resecciones de metástasis hepáticas fue mayor, pero no de forma significativa (20% frente a 30,2%; p=0,056). Los regímenes de quimioterapia fueron comparables, pero en el primer grupo los anticuerpos monoclonales anti-VEGF y -EGFR se utilizaron con más frecuencia en general (53,8% frente a 22,5%; p=0,014) y el tratamiento se interrumpió con más frecuencia debido a la progresión de la enfermedad. En el análisis multivariante, la edad (>65 años) y la ausencia de cirugía de metástasis hepática fueron factores pronósticos negativos relevantes (Tab. 1) . Considerando sólo a las pacientes operadas y tratadas con quimioterapia en ambos grupos, se demostró una mejor supervivencia con la quimioterapia postoperatoria, un porcentaje de ganglios linfáticos profundos y una edad inferior a 65 años.
Los autores concluyen que, teniendo en cuenta las limitaciones de un análisis retrospectivo, ambas vías de tratamiento son igual de eficaces. De hecho, en el carcinoma colorrectal con metástasis sincrónicas, suele ser el control de las metástasis o la evolución de la enfermedad lo que resulta decisivo para el pronóstico, más que el estado de resección del tumor primario.
Cuidados posteriores a la cirugía curativa
El objetivo del seguimiento postoperatorio del carcinoma colorrectal es diagnosticar una recidiva (asintomática) en una fase temprana para propiciar una nueva resección curativa y, ergo, una prolongación del tiempo de supervivencia. Un estudio portugués, también presentado en el congreso [8], comprobó los efectos de un seguimiento estructurado intensivo durante cinco años en 404 pacientes con cáncer colorrectal en estadio II-III de la AJCC tras cirugía curativa (tab. 2).

El programa del Instituto Portugués de Oncología de Lisboa Francisco Gentil (IPOLFG) consistió en una anamnesis y exploración física periódicas, la recogida de los marcadores tumorales CEA y CA 19-9, un TAC de tórax/abdomen/pelvis y una colonoscopia (Tab. 3) . El criterio de valoración primario fue la tasa de resecciones recurrentes con intención curativa.

Por término medio, el seguimiento duró 37 meses. El programa de seguimiento mostró una buena precisión diagnóstica para la detección de recidivas (AUC 0,885). La tasa de recurrencia fue del 12,9%, y la mayoría de los casos se detectaron en los tres primeros años (88,4%). Las metástasis fueron significativamente más frecuentes que las recidivas locorregionales (86,5% frente a 13,5%). El aumento de los marcadores tumorales fue responsable de la detección en el 46% de los casos, el TAC en el 40%, la colonoscopia en el 8% y los síntomas en el 6%. 21 pacientes fueron sometidos a resección curativa. En este caso, la supervivencia a 2 años fue del 95,2%, mientras que fue del 59,9% para las recidivas irresecables (p=0,016). La edad superior a 70 años (RR 5,43; IC 95%: 1,33-22,17; p=0,018) y la localización del tumor en el colon (RR 0,237; IC 95%: 0,064-0,873; p=0,030) se asociaron significativamente con la irresecabilidad de la recidiva.
Según los autores, este programa de seguimiento postoperatorio intensivo muestra así un claro beneficio: de los 52 pacientes (12,9%) con recidiva detectada, casi la mitad, es decir, 21 pacientes (40,3%), pudieron someterse de nuevo a una resección curativa.
ASCO-GI: Nuevo régimen para el cáncer de recto localmente avanzado
En comparación con la quimio-radioterapia de cinco semanas, que es el tratamiento preoperatorio estándar para el cáncer rectal localmente avanzado en muchos países, una radiación más corta (de cinco días) seguida de tres ciclos de dos días de quimioterapia de consolidación durante un periodo de siete semanas produjo resultados igual de buenos con mejor tolerabilidad (y menores costes). El correspondiente ensayo de fase III se presentó en el Simposio sobre Cánceres Gastrointestinales de 2016 celebrado en San Francisco [9]. El estudio incluyó a 515 pacientes con cáncer de recto localmente avanzado (estadio cT3 o cT4 sin metástasis a distancia). Un grupo recibió 5-FU, Leucovorin® y oxaliplatino junto con radioterapia (50,4 Gy), el otro FOLFOX-4 una semana después de la radioterapia de cinco días (5× 5 Gy). Cabe señalar que la adición de oxaliplatino no cumple actualmente la norma común.
Un número igual de pacientes de los dos brazos podría someterse a cirugía radical. Después de tres años, la supervivencia libre de enfermedad no presentaba diferencias significativas. La supervivencia global mostró una tendencia a favor del régimen más corto (73% frente a 64,5%; p=0,055). Además, hubo significativamente menos efectos secundarios agudos (74% frente a 83%; p=0,007).
Los autores también ven un gran potencial en la radioterapia más corta, especialmente para los pacientes con metástasis en el hígado o los pulmones, ya que permite iniciar la quimioterapia mucho antes para el control de las metástasis.
Fuente: 23ª Semana Europea Unida de Gastroenterología, 24-28 de octubre de 2015, Barcelona; Simposio sobre Cánceres Gastrointestinales, 21-23 de enero de 2016, San Francisco.
Literatura:
- Ferlay J, et al: Incidencia y mortalidad por cáncer en todo el mundo: fuentes, métodos y patrones principales en GLOBOCAN 2012. Int J Cancer 2015 Mar 1; 136(5): E359-386.
- Clavien PA, et al: Estrategias para una cirugía hepática y un trasplante hepático parcial más seguros. N Engl J Med 2007 abr 12; 356(15): 1545-1559.
- Venderbosch S, et al: Valor pronóstico de la resección del tumor primario en pacientes con cáncer colorrectal en estadio IV: Análisis retrospectivo de dos estudios aleatorizados y revisión de la literatura. Ann Surg Oncol 2011; 18(12): 3252-3260.
- Ferrand F, et al: Impacto de la resección tumoral primaria en la supervivencia de los pacientes con cáncer colorrectal y metástasis sincrónicas tratados con quimioterapia: resultados del ensayo multicéntrico y aleatorizado Federation Francophone de Cancerologie Digestive 9601. Eur J Cancer 2013; 49: 90-97.
- Poultsides GA, et al: Resultado del tumor primario en pacientes con cáncer colorrectal sincrónico en estadio IV que reciben quimioterapia combinada sin cirugía como tratamiento inicial. J Clin Oncol 2009; 27: 3379-3384.
- McCahill LE, et al: mFOLFOX6 primario más bevacizumab sin resección del tumor primario para pacientes que presentan un cáncer de colon metastásico no resecable quirúrgicamente y un cáncer de colon asintomático intacto: análisis definitivo del ensayo NSABP C-10. J Clin Oncol 2012; 30(26): 3223-3228.
- Arolfo S, et al: Cáncer colorrectal con metástasis hepáticas no resecables sincrónicas. ¿Cuál es el mejor tratamiento? UEGW 2015; P1677.
- Rodrigues RV, et al: Seguimiento intensivo tras la cirugía curativa del cáncer colorrectal. UEGW 2015; P1671.
- Bujko K, et al: Quimiorradiación neoadyuvante para el cáncer de recto fijo cT3 o cT4: Resultados de un estudio multicéntrico polaco de fase III. Simposio sobre cánceres gastrointestinales 2016; Resumen 489.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(1): 48-50