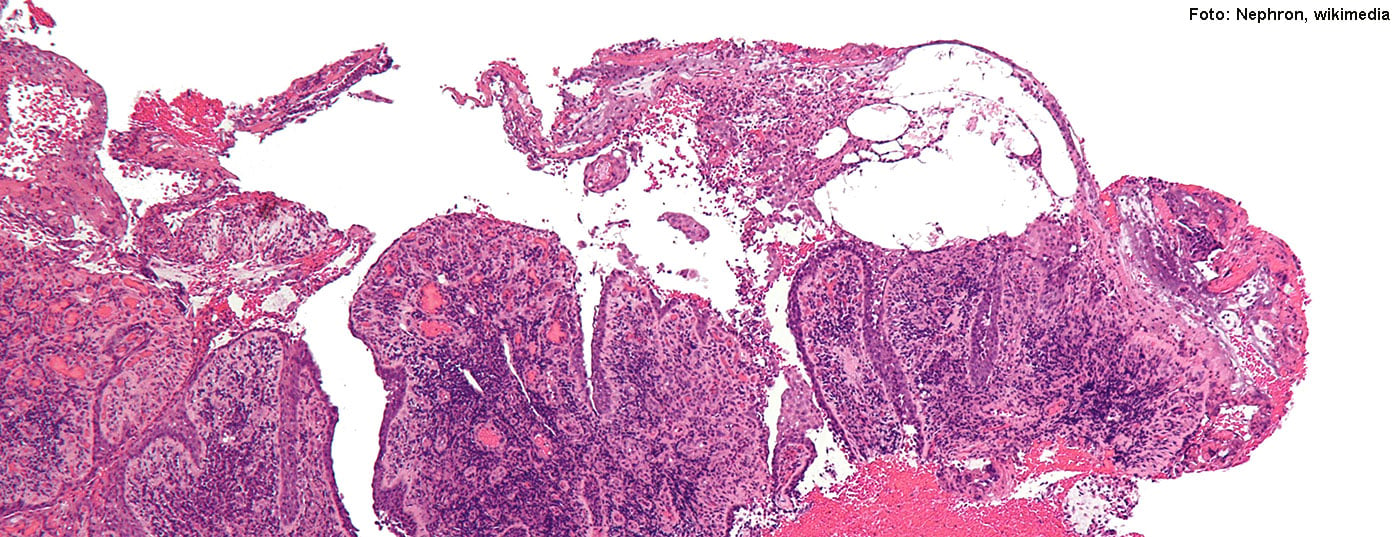
En los últimos años se ha avanzado mucho en la investigación de las terapias inmunocelulares autólogas. El desarrollo de un receptor de antígeno quimérico (CAR) específico contra el pénfigo vulgar de células B autoreactivo patogénico es uno de estos hitos.
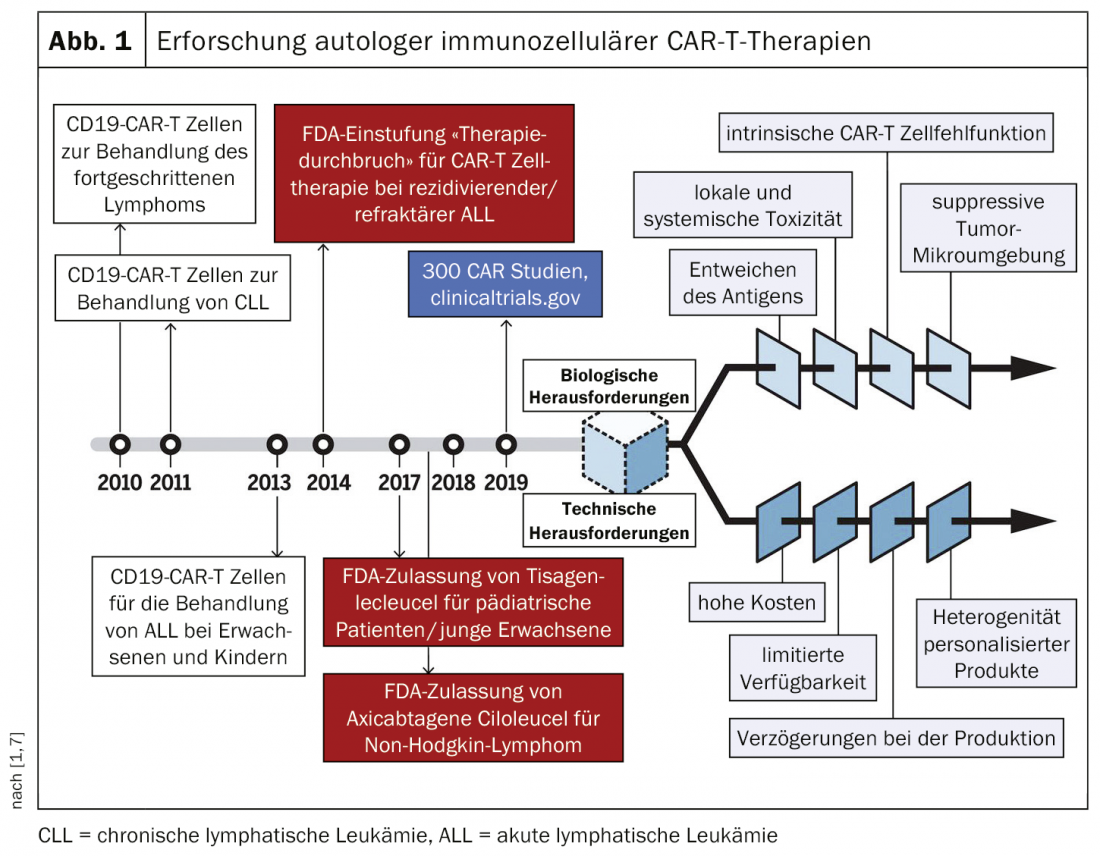
Las inmunoterapias son una técnica en la que los linfocitos T se modifican genéticamente para que destruyan selectivamente el material celular patógeno. El Dr. Christoph Ellebrecht, de la Universidad de Pensilvania (EE UU), habló en la reunión anual de este año de la Arbeitsgemeinschaft Dermatologische Forschung (ADF) [1] sobre las inmunoterapias específicas CAR-T (“terapia con células T receptoras de antígenos quiméricos”) y CAAR-T (“terapia con células T receptoras de autoanticuerpos quiméricos”) para la enfermedad autoinmune rara, ampollosa y potencialmente mortal pénfigo vulgar (PV) [2–4]. Varios estudios han demostrado que las células receptoras de antígenos quiméricos son eficaces como terapia diana específica (CAR-T) contra los linfocitos B patógenos en la PV. El concepto de células CAR-T se ha investigado durante varias décadas, principalmente en el campo de las terapias contra el cáncer, aunque los desafíos técnicos retrasaron su irrupción en el mercado (Fig. 1) . En 2018, un producto CAR-T recibió la autorización de comercialización en Suiza en el campo de la oncología (tisagenlecleucel: para casos refractarios de leucemia y linfoma de células B grandes) [5].
La terapia anti-CD 20 sólo suele ser eficaz a corto plazo
Si no se trata, la PV es mortal al cabo de unos años debido a la pérdida de líquidos y a la sobreinfección a través de la barrera cutánea dañada. Las opciones de tratamiento utilizadas hasta ahora incluyen corticosteroides sistémicos, azatioprina, mofetil micofenolato, ciclofosfamida, metotrexato. En marzo de 2019, el anticuerpo monoclonal rituximab recibió la autorización de comercialización en la UE para las formas moderadas a graves de PV; en EE.UU., esta ampliación de la indicación ya se concedió en 2018. El rituximab es un biológico que se dirige específicamente al CD20 uniéndose a este antígeno transmembrana localizado en los linfocitos B pre-B y maduros. El ponente explicó que el rituximab es una estrategia terapéutica eficaz a corto plazo, pero que la tasa de recurrencia es relativamente alta. En el 95% de los casos, la actividad de la enfermedad puede controlarse destruyendo las células B de memoria, pero en el 77%, la enfermedad recae [6]. Se sabe que las células B autorreactivas desempeñan un papel clave en el patomecanismo de las recaídas.
CAR-T y CAAR-T en el pénfigo vulgar
Para tratar la PV sin causar una inmunosupresión generalizada, el equipo de investigación de la Universidad de Pensilvania desarrolló un receptor quimérico artificial de autoanticuerpos (CAAR) que muestra fragmentos del autoantígeno Dsg3, los mismos fragmentos a los que suelen unirse los anticuerpos causantes de la PV y sus células B. Las células B autorreactivas desempeñan un papel importante en el patomecanismo de la PV y su eliminación específica es un mecanismo de acción central de esta estrategia de tratamiento. Un diseño de receptor probado en cultivo celular también tuvo éxito en un modelo de ratón para la PV. Los estudios in vivo demostraron que las células T CAAR reconocen y eliminan específicamente las células B reactivas al Dsg3 y no provocan toxicidad fuera del objetivo contra los queratinocitos [1].
A diferencia de la terapia basada en anticuerpos, en la que se infunde una dosis definida, las células T CAAR pueden expandirse varias veces in vivo y dar lugar a células T que persisten durante décadas. Por tanto, sólo tiene que infundir las células T CAAR una vez, matan todas las células B del pénfigo y luego se vuelven inactivas. Si una célula B del pénfigo reaparece en cualquier momento en el futuro, las células T CAAR de memoria pueden agrandarse de nuevo y eliminarla.
Un artículo de revisión publicado en 2018 por Siddiqi et al. [4] coincide en que la CAR-T es un enfoque terapéutico prometedor para la PV, pero los autores señalan que las terapias CAR-T actuales están asociadas a un riesgo relativamente alto de síndrome de liberación de citoquinas como efecto secundario adverso, una enfermedad inflamatoria sistémica potencialmente mortal.
El desarrollo y la aprobación comercial de los productos CAR-T en el campo de la oncología también está asociado a obstáculos, pero ya se dispone de algunos preparados. El producto CAR-T tisagenlecleucel, aprobado en Suiza desde 2018 para el tratamiento de la leucemia linfoblástica aguda de células B refractaria (adolescentes) y el linfoma de células B grandes refractario (adultos), es una terapia oncológica inmunocelular autóloga que conduce a una reprogramación de las células T del propio paciente con un transgén que codifica un receptor de antígeno quimérico (CAR) para que identifiquen y eliminen las células que expresan CD19 [5].
Literatura:
- Ellebrecht CT: Go CAART – Inmunoterapia para aplicaciones no relacionadas con el cáncer, Christoph Ellebrecht, MD, residente de Dermatología, Universidad de Pensilvania, presentación de diapositivas 46ª Reunión Anual de la Asociación para la Investigación Dermatológica (ADF), 13-16 de marzo de 2019, Múnich.
- Ellebrecht CT, Payne AS: Fijar el objetivo de la terapia del pénfigo vulgar. JCI Insight 2017; 2(5): e92021. https://doi.org/10.1172/jci.insight.92021.
- Ellebrecht CT, et al: Reengineering chimeric antigen receptor T cells for targeted therapy of autoimmune disease. Science 2016; 353(6295): 179-184. doi: 10.1126/science.aaf6756. Epub 2016 jun 30.
- Siddiqi HF, Staser KW, Nambudiri VE: Técnicas de investigación simplificadas: terapia con células T CAR. Revista de Dermatología Investigativa 2018; 138: 2501e2504. doi:10.1016/j.jid.2018.09.002. https://beaumont.cloud-cme.com/assets/beaumont/Presentations/14208/14208.pdf
- Compendio: KYMRIAH, https://compendium.ch/prod/kymriah-zellsuspension-inf-los–nh-/de, último acceso: 15 de julio de 2019.
- Joly P: Rituximab de primera línea combinado con prednisona a corto plazo frente a prednisona sola para el tratamiento del pénfigo (Ritux 3): un ensayo prospectivo, multicéntrico, de grupos paralelos y abierto. Lancet 2017; 389(10083): 2031-2040. doi: 10.1016/S0140-6736(17)30070-3. Epub 2017 Mar 22.
- Schultz L, et al: Impulsar la traducción de las células T CAR. Science Translational Medicine 2019; 11 (481), eaaw2127. DOI: 10.1126/scitranslmed.aaw2127
DERMATOLOGIE PRAXIS 2019; 29(4): 46-47 (publicado el 28.8.19, antes de impresión).