No existen parámetros químicos de laboratorio validados, suficientemente sensibles y específicos para el diagnóstico de la miocarditis o la pericarditis. En la sospecha clínica de miocarditis, las troponinas cardiacas elevadas tienen un valor predictivo positivo con respecto a la detección de la biopsia. Las serologías no tienen valor en el diagnóstico diferencial de la cardiopatía inflamatoria en la mayoría de los casos. La búsqueda del VIH, la hepatitis C, la tuberculosis, la enfermedad de Chagas y la Borelia puede seguir siendo útil en función de la constelación de riesgos. La biopsia endomiocárdica se recomienda en pacientes con insuficiencia cardiaca fulminante y equívoca o en pacientes con insuficiencia cardiaca progresiva no isquémica a pesar del tratamiento conforme a las directrices.
Las cardiopatías inflamatorias en sentido estricto son la miocarditis y la pericarditis. La miocarditis se considera una enfermedad bastante rara, pero lo más probable es que se subestime su frecuencia. La pericarditis, en cambio, se diagnostica con bastante frecuencia. Las formas transitorias son posibles y se definen en consecuencia como miopericarditis (pericarditis con inflamación miocárdica acompañante) y perimiocarditis (miocarditis con inflamación pericárdica acompañante) [1]. La presentación clínica es variable, desde síntomas generales inespecíficos hasta arritmias, dolor torácico e insuficiencia cardiaca. Además del conocimiento de la epidemiología y la expresión clínica, deben conocerse las posibilidades y los límites de los diagnósticos de laboratorio para realizar diagnósticos racionales, rentables y basados en pruebas.
Epidemiología de la pericarditis y la miocarditis
La epidemiología de la cardiopatía inflamatoria es difícil de comprender. Por un lado, no existe un consenso internacional oficial sobre los criterios de diagnóstico y, por otro, la clínica es extraordinariamente variable, por lo que lo más probable es que se subestime la verdadera incidencia. Las pruebas indirectas de los cursos subclínicos las proporcionan, por ejemplo, los estudios prospectivos que documentaron un aumento asintomático de las enzimas cardiacas tras la vacunación contra la viruela en hasta un 3% de los sujetos [2]. La pericarditis es una enfermedad relevante en la vida cotidiana, con una prevalencia estimada de 2,7 casos por cada 100.000 habitantes y una cuota de alrededor del 5% de los pacientes que acuden a un servicio de urgencias con dolor torácico [3,4]. La miocarditis es mucho menos frecuente, con una incidencia estimada del 0,1-1% en la población general. Sin embargo, los datos estadísticos son difíciles de evaluar debido a la variabilidad de los criterios diagnósticos y al enfoque retrospectivo de los estudios [5,6]. En Suiza, en la última década se registraron una media de 289 casos de miocarditis en pacientes hospitalizados y 933 casos de pericarditis en pacientes hospitalizados al año (Oficina Federal de Estadística suiza, casos de miocarditis en pacientes hospitalizados 2003-2013).
Causas de la cardiopatía inflamatoria
La lista de causas potenciales de la cardiopatía inflamatoria es larga [7–26]. Básicamente, pueden distinguirse causas infecciosas, tóxicas, alérgicas, inmunológicas y otras (Fig. 1) . No es infrecuente que la miocarditis y la pericarditis se produzcan en el contexto de colagenosis o enfermedades sistémicas autoinmunes como la enfermedad celíaca, la esclerosis sistémica o el lupus eritematoso [7,8]. Un hallazgo central es que la miocarditis y la pericarditis tienen etiologías muy similares, respectivamente. pueden representar variantes fisiopatológicas y fenotípicas de la misma causa. La pericarditis sigue siendo idiopática en dos tercios de los casos. Sin embargo, si estos casos se aclararan de forma sistemática, posiblemente hasta la biopsia pericárdica, podría encontrarse una causa vírica en muchos casos [9,10].
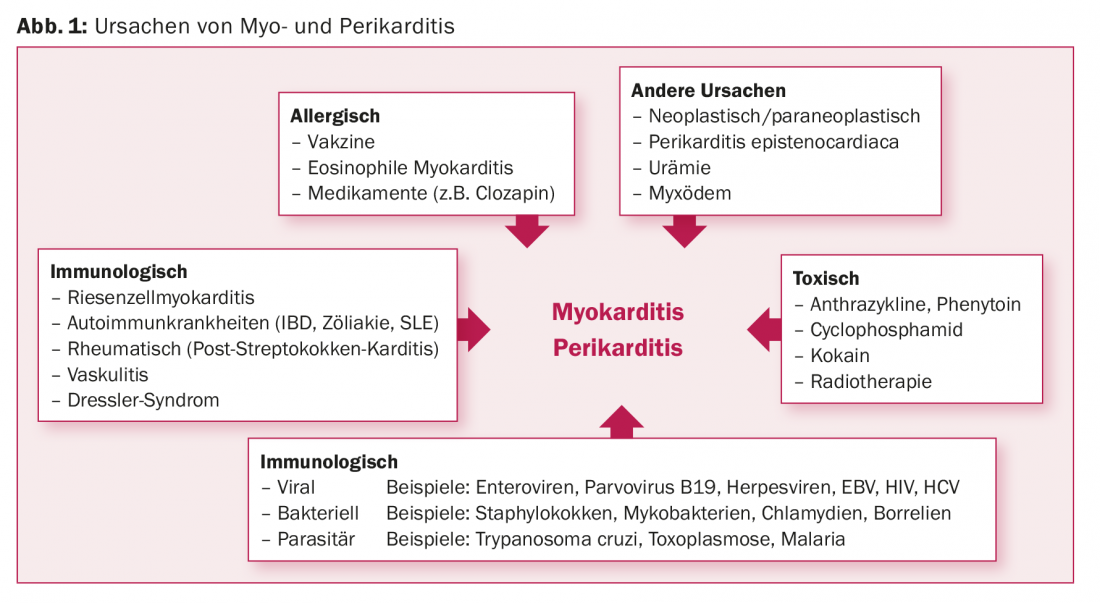
Los virus se consideran la causa específica más común en los países industrializados. Curiosamente, en la miocarditis existe una gran varianza geográfica en la distribución de frecuencias de los virus causantes. En Alemania, por ejemplo, el parvovirus B19 se identificó con mayor frecuencia (19-37%) en biopsias endomiocárdicas (BEM) de pacientes con miocarditis mediante la reacción en cadena de la polimerasa (PCR) [11–18]. En Norteamérica, en cambio, los adenovirus y los enterovirus fueron los más frecuentes (en el 20% de 624 pacientes con miocarditis confirmada por biopsia) [19]. Por último, en Japón, la hepatitis C se identifica con frecuencia en el BEM [20,21].
La infección por VIH suele provocar una respuesta inflamatoria cardiaca. Los derrames pericárdicos -generalmente pequeños- se encuentran en prácticamente todos los pacientes con VIH como expresión de una pericarditis subclínica. Los análisis post mortem mostraron signos histológicos de miocarditis en el 67% de los pacientes con VIH. La incidencia anual de miocardiopatía dilatada (MCD) en pacientes no tratados con antirretrovirales es del 1,6%. La DKM en pacientes con VIH tiene un mal pronóstico [24–26].
Numerosos fármacos se consideran desencadenantes potenciales de la miocarditis alérgica. Entre ellos se encuentran los antidepresivos tricíclicos, los antibióticos y los antipsicóticos [22,23]. Sin embargo, faltan grandes estudios prospectivos para evaluar la incidencia real y la causalidad. Cabe mencionar una incidencia de miocarditis sospechada retrospectivamente de aproximadamente el 1% en pacientes que reciben tratamiento con clozapina [23].

Clínica y evolución de la pericarditis
Clásicamente, la pericarditis va precedida de síntomas gastrointestinales o respiratorios inespecíficos parecidos a los de la gripe. Tras un periodo de latencia de una a tres semanas, suele aparecer dolor torácico dependiente de la posición, siendo casi patognomónica la irradiación al margen del trapecio. Los síntomas son más pronunciados al tumbarse y suelen ir acompañados de síntomas generales graves y a menudo también de temperaturas subfebriles. La extensión de la inflamación, la relevancia del derrame pericárdico acompañante y la frecuente aparición de disritmias, en su mayoría supraventriculares, completan el cuadro sintomático. Diagnóstico diferencial: debe excluirse un síndrome coronario agudo, en caso de duda también de forma invasiva [27]. A menudo no existe una pericarditis aislada, sino una inflamación miocárdica concomitante más o menos pronunciada en el sentido de miopericarditis. En un análisis retrospectivo de datos de 54 pacientes con miopericarditis, el 70% se quejaba de dolor retroesternal y el 35% de disnea al ingreso. Hasta el 30% de los pacientes mostraron signos de insuficiencia cardiaca y el 57% declararon haber sufrido infecciones previas por gripe. El pronóstico a largo plazo de la pericarditis es bueno. Sin embargo, la enfermedad recae hasta en un 30% [28]. La pericarditis constrictiva se produce en <2% y no es frecuente ni siquiera en los cursos recurrentes [29,30].
Clínica y evolución de la miocarditis
La miocarditis diagnosticada tiene un pronóstico grave, con una mortalidad estimada a 1 año del 15-20% y a 4 años de más del 50% [31–35]. Los pacientes con la forma rara de miocarditis de células gigantes tienen una tasa de mortalidad a los 5 años especialmente alta, superior al 80% [36]. Liebermann et al. distinguir a los pacientes con miocarditis fulminante, es decir, rápidamente progresiva en dos semanas y rápida insuficiencia cardiaca, pero paradójicamente con un buen pronóstico a largo plazo (93% de supervivencia sin trasplante al cabo de cinco años), de los pacientes con miocarditis aguda, lentamente progresiva, con un peor pronóstico a largo plazo [31,37]. El buen pronóstico a largo plazo de la miocarditis fulminante justifica un tratamiento médico agresivo e intensivo que incluya el uso de dispositivos de asistencia. En general, se estima que la tasa de recuperación espontánea de la miocarditis clínicamente sintomática bajo tratamiento farmacológico para la insuficiencia cardiaca y reposo físico es superior al 50% [38,39].
Los datos epidemiológicos y experimentales apoyan un vínculo entre la miocarditis y la miocardiopatía dilatada (MCD). Esto se ve respaldado, entre otras cosas, por la detección de células inflamatorias específicas como células T o macrófagos y el aumento de la expresión de marcadores inflamatorios y moléculas de adhesión en el BEM de algunos pacientes con DKM [40]. Los estudios prospectivos a largo plazo en pacientes con miocarditis confirmada histológicamente estiman que la proporción de los que desarrollan DKM es de hasta el 52%, dependiendo de los criterios de diagnóstico y de la selección de pacientes [38]. Por último, la miocarditis también desempeña un papel en la muerte súbita cardiaca. Los criterios histológicos de miocarditis se cumplen en el 8,6-12% de los corazones examinados en autopsia de pacientes con muerte súbita cardiaca [41,42]. Las reacciones inflamatorias perimortem deben diferenciarse de la miocarditis real.
Importancia general de los diagnósticos de laboratorio en las cardiopatías inflamatorias
El diagnóstico de miocarditis o pericarditis se realiza clínicamente, excluyendo otros diagnósticos diferenciales, normalmente frecuentes, y utilizando técnicas de imagen más o menos específicas. En este último caso, la resonancia magnética cardiaca proporciona actualmente la información más completa. Sin embargo, el patrón oro para diagnosticar la miocarditis es la BEM. Los análisis químicos de laboratorio proporcionan información importante sobre la etiología, el diagnóstico diferencial y el pronóstico. (Tab. 1). Sin embargo, no existen marcadores diagnósticos específicos para la miocarditis o la pericarditis. Los análisis de laboratorio disponibles deben utilizarse de forma selectiva en el contexto clínico, teniendo en cuenta la probabilidad previa a la prueba, que se ve incrementada por consideraciones clínicas, epidemiológicas y la exclusión de cardiopatías comunes.

En los pacientes con pericarditis, los parámetros inflamatorios como los leucocitos y la proteína C reactiva (PCR) suelen estar elevados. Sin embargo, esto no se aplica a la miocarditis. En este caso, los valores normales no excluyen en absoluto una inflamación miopericárdica [43–45]. Las enzimas cardiacas que pueden determinarse en suero son las troponinas cardiacas y las creatinina quinasas (CK). Estos últimos no tienen cabida en el diagnóstico de la cardiopatía inflamatoria debido a su baja sensibilidad y especificidad [43,46,47]. Por el contrario, las troponinas cardiacas suelen estar inicialmente elevadas (30-80%) tanto en la miocarditis como en la pericarditis. En pacientes con sospecha de miocarditis, los niveles elevados de troponina aumentan la probabilidad previa a la prueba para la confirmación de la biopsia. Por otra parte, el valor predictivo negativo de la troponina T cardiaca (cTnT) inferior al 60% no es útil para excluir la miocarditis [43,46,48,49]. Curiosamente, los pacientes con miocarditis demostrada por biopsia pero troponina negativa tienen una duración de los síntomas hasta el diagnóstico significativamente mayor que los pacientes con troponina elevada [46]. Sin embargo, los niveles de troponina elevados en el momento del diagnóstico no tienen valor predictivo para una evolución desfavorable o una recidiva [9,50–52]. Aunque son específicas de un órgano, las troponinas y los cursos de troponina sólo son moderadamente adecuados para el diagnóstico diferencial de una cardiopatía definida.
Pericarditis: importancia clínica de la química de laboratorio
La pericarditis es idiopática en un 85-90% en los países industrializados. Las series de casos demuestran que la búsqueda constante de una etiología específica en la pericarditis juzgada inicialmente como idiopática no ofrece ventajas pronósticas [53–55]. Así pues, las aclaraciones etiológicas excesivas no son muy útiles en pacientes inmunocompetentes. Esto es especialmente cierto para “reumatología” y “reumatología”. búsqueda de anticuerpos antinucleares y factores reumatoides. Estas investigaciones sólo son apropiadas si existen más pruebas clínicas o anamnésicas de colagenosis, vasculitis u otra enfermedad autoinmune sistémica [53].
Por el contrario, en el África subsahariana y especialmente con infección concurrente por VIH, la tuberculosis es responsable del 70-80% de los casos de pericarditis. Esta circunstancia debe tenerse en cuenta en pacientes con infección por VIH, un historial correspondiente de residencia o inmunosupresión con una aclaración adecuada. Deben realizarse hemocultivos en pacientes con pericarditis y afecciones sépticas [56]. Los indicadores de riesgo de un curso grave y una etiología no idiopática son la fiebre alta, los síntomas prolongados subagudos, los derrames pericárdicos grandes (>20 mm), el taponamiento pericárdico y la falta de respuesta a los antiinflamatorios. Estos pacientes deben ser aclarados con más detalle [9]. La pericardiocentesis con análisis histoquímico y cultural sólo se recomienda en pacientes con taponamiento, derrame grande y una constelación de riesgo de neoplasia o tuberculosis en caso de investigaciones aún no concluyentes [57]. El único marcador pronóstico de pericarditis recurrente son los niveles persistentemente elevados de PCR bajo una terapia antiinflamatoria adecuada [45]. Aún no se ha investigado si una terapia antiinflamatoria prolongada para la PCR persistentemente elevada puede prevenir las recurrencias a largo plazo.
Miocarditis: importancia clínica de la química de laboratorio
En un entorno clínico adecuado, los valores elevados de troponina son sugestivos de miocarditis tras la exclusión de otras etiologías (enfermedad arterial coronaria, taquiarritmias, riesgo hipertensivo, insuficiencia cardiaca crónica) [50]. Recientemente se ha demostrado que los niveles elevados de cTnT no sólo se asocian a una mayor probabilidad de miocarditis probada mediante biopsia, sino que son significativamente más altos en la miocarditis aguda que en las formas crónicas [50]. Los parámetros químicos de laboratorio más novedosos, la copeptina y la “proadrenomodulina medio-regional”, que también se investigaron en este estudio, no mostraron ningún beneficio diagnóstico ni pronóstico. Sin embargo, las concentraciones sanguíneas marcadamente elevadas de péptido natriurético cerebral (BNP) por encima de 4245 pg/ml se asociaron con un aumento significativo de la mortalidad en el plazo de un año [50].
Las proteínas de la superficie celular sFas y el ligando sFas se identificaron a finales de los años 90 como marcadores de apoptosis en la insuficiencia cardiaca y la miocarditis. Su concentración sérica se correlaciona con el fenotipo sintomático o el estadio NYHA de la enfermedad [58–60]. Un estudio japonés investigó el valor diagnóstico y pronóstico de estos parámetros séricos en la miocarditis. El sFas y el ligando sFas fueron significativamente más elevados en los pacientes con miocarditis en comparación con los voluntarios sanos o los pacientes con estado postinfarto de miocardio. El nivel de las concentraciones séricas de los dos biomarcadores fue predictivo del resultado clínico (“fatal” frente a “recuperación”) en un estudio retrospectivo de pacientes con miocarditis fulminante [61]. La interleucina-10 y la interleucina-12 se han identificado como otros marcadores séricos de pronóstico en varios estudios pequeños [62,63]. Sin embargo, no existen estudios prospectivos sobre el valor diagnóstico del sFas, el ligando sFas, la interleucina-10 y la interleucina-12 en la miocarditis probada por BEM ni un análisis coste-beneficio estratificado de estos marcadores séricos.
Las aclaraciones serológicas sistemáticas y amplias, especialmente las serologías víricas, no tienen ningún valor en el diagnóstico de la miocarditis. Kandolf et al. mostraron una sensibilidad y especificidad sorprendentemente bajas de las serologías virales en comparación con la identificación biológica molecular del virus en la biopsia cardiaca en un estudio prospectivo de 124 pacientes con sospecha de miocarditis. Sólo en el 9% de los pacientes con detección del virus en la biopsia cardiaca pudo confirmarse también serológicamente [44]. Las excepciones son las poblaciones de riesgo con pruebas anamnésicas o clínicas de infecciones víricas o bacterianas muy específicas. Entre ellas se incluyen las infecciones por VIH o hepatitis B/C[24–26]. Con el aumento de la incidencia de la borreliosis de Lyme con una prevalencia de carditis del 0,3-4%, la serología de borrelia en zonas endémicas es útil [64]. Debido al creciente comportamiento migratorio, la enfermedad de Chagas, endémica sobre todo en Sudamérica y causada por el parásito Trypanosomi cruzii, también está cobrando importancia. Los estudios estiman la prevalencia actual en Europa entre 80.000 y 100.000 personas, lo que equivale aproximadamente al 4% de los sudamericanos inmigrantes [65,66]. La enfermedad de Chagas conduce al DKM [67] a través de una inflamación miocárdica persistente. En las personas con insuficiencia cardiaca y/o arritmias de nueva aparición y los correspondientes antecedentes de migración o viaje, debe buscarse activamente la enfermedad de Chagas mediante frotis sanguíneo (microscopía) y serología. Esto es tanto más importante cuanto que un tratamiento a tiempo limita la progresión de las complicaciones cardiacas [68].
Valor de la biopsia endomiocárdica en la miocarditis
El análisis inmunohistológico y biológico molecular del EMB tiene consecuencias diagnósticas, pronósticas y terapéuticas. La indicación de una BEM se basa en las características del paciente, la duración del tratamiento de la insuficiencia cardíaca, las complicaciones y otros criterios de las recomendaciones vigentes en 2007 de la Sociedad Europea de Cardiología ( ESC) (Tab. 2) [69]. El examen se considera relativamente seguro con una tasa de complicaciones del 6% (>3% arritmias transitorias y punciones arteriales accidentales) con una experiencia adecuada del intervencionista [70]. Aunque la BEM es el patrón oro diagnóstico, su sensibilidad no está exenta de controversia. La limitada sensibilidad se basa, por un lado, en el patrón de infiltración inflamatoria, a menudo focal, y en el “error de muestreo” asociado. Por otro lado, los datos de estudios con animales sugieren que la composición de los infiltrados inflamatorios puede cambiar rápidamente durante el curso de la enfermedad. Ésta es también la razón por la que los criterios históricos de Dallas de 1998, definidos puramente de forma histológica, han sido sustituidos por criterios biológicos moleculares e inmunohistoquímicos con mayor sensibilidad y especificidad para el diagnóstico de la miocarditis [71–75].
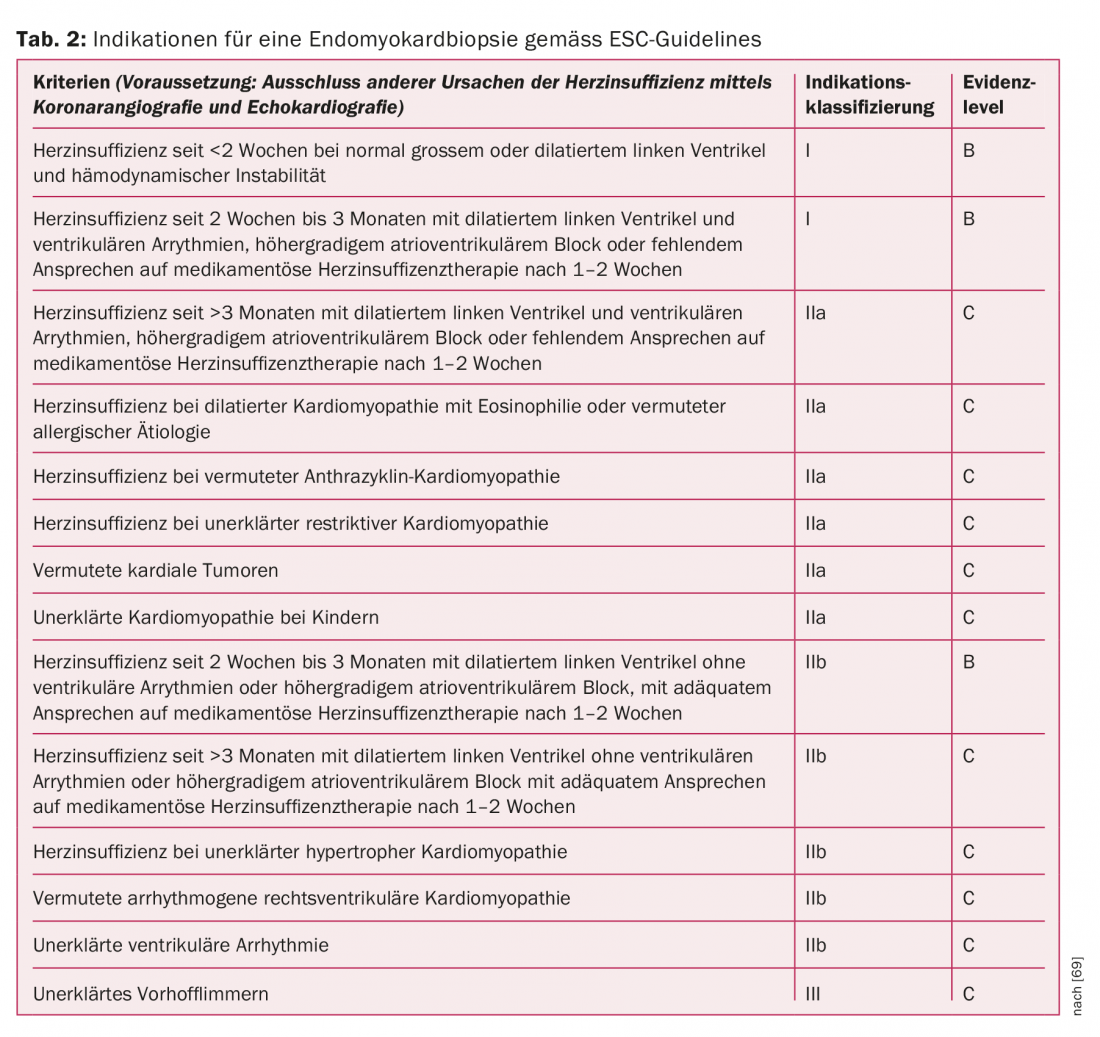
La evidencia bióptica de inflamación miocárdica se considera un predictor negativo de la progresión posterior y de la supervivencia libre de injerto. Sin embargo, esto no se aplica a la detección biológica molecular de un patógeno viral cardiotrópico, que tiene éxito en aproximadamente el 40% de los BEM [19,76]. Es probable que la detección inmunohistológica de la inflamación con detección simultánea del virus en el BEM se considere la base de una posible terapia antivírica en el futuro. Si no hay evidencia de virus, pero se confirma la inflamación, está justificado un intento de terapia inmunosupresora. La importancia pronóstica de la persistencia del virus en los BEM obtenidos en serie aún no puede evaluarse de forma concluyente [77,78]. Además de la detección inmunohistológica de la inflamación y la detección molecular del patógeno, la BEM también permite identificar subgrupos específicos de miocarditis con implicaciones terapéuticas potencialmente específicas (sarcoidosis, miocarditis de células gigantes, miocarditis en el síndrome de hipersensibilidad) [10].
Anticuerpos autoinmunes específicos del corazón en la miocarditis
Los anticuerpos autoinmunes específicos del corazón (AHA) pueden determinarse mediante inmunofluorescencia o ELISA en hasta el 60% de los pacientes con miocarditis diagnosticada clínicamente y en el 35% de los pacientes con miocarditis confirmada por biopsia, mientras que no son detectables en corazones sanos. En consecuencia, se postula una génesis autoinmune para un subgrupo de miocarditis con detección vírica negativa e inflamación persistente en el BEM y detección de AHA en el suero [79–81]. Por ejemplo, un estudio prospectivo publicado recientemente por Caforio et al. con 174 pacientes con miocarditis confirmada biopticamente en el 48% de los sujetos la deteccion de AHA con deteccion bioptica simultanea negativa del virus [39]. Curiosamente, los AHA también pueden detectarse en algunos de los pacientes con DKM y, en parte, también en el suero de sus familiares asintomáticos. Por un lado, estos datos apoyan el concepto de que la DKM es la consecuencia tardía de la miocarditis, por otro, abogan por una génesis autoinmune contributiva potencialmente hereditaria de la DKM [82,83].
Conceptos terapéuticos
El tratamiento de la pericarditis idiopática consiste principalmente en antiinflamatorios no esteroideos (AINE) y colchicina [57]. Esto último reduce el riesgo de recidiva y acelera el proceso de curación clínica [84]. Debido a la mayor probabilidad de recidiva con una PCR persistentemente elevada, una reducción de la dosis del tratamiento antiinflamatorio sólo debe llevarse a cabo bajo control de laboratorio [45].
En los pacientes con una alta sospecha de miocarditis, es indispensable el esclarecimiento hospitalario, ya que no puede predecirse el curso a corto plazo y pueden surgir importantes consecuencias terapéuticas a corto plazo durante la exploración diagnóstica [85]. Los pacientes hemodinámicamente inestables necesitan un soporte circulatorio agresivo en una fase temprana, ya que tras la supervivencia de la fase fulminante el pronóstico a largo plazo es favorable [31]. Además de la prohibición de hacer deporte, todos los pacientes con miocarditis y deterioro de la función ventricular izquierda cumplen los requisitos para recibir tratamiento farmacológico contra la insuficiencia cardiaca según el régimen habitual [86]. Los AINE y la colchicina no tienen valor terapéutico en la miocarditis [10]. Dado que no existen estudios multicéntricos más amplios que hayan investigado las terapias inmunomoduladoras, inmunosupresoras o antivirales en subgrupos específicos de miocarditis, las recomendaciones correspondientes se basan en estudios con un número reducido de pacientes y en un consenso de expertos [10]. La razón es que un diagnóstico diferenciado, estructurado y racional permite clasificar la miocarditis en distintos subgrupos con sus correspondientes opciones terapéuticas (Fig. 2).
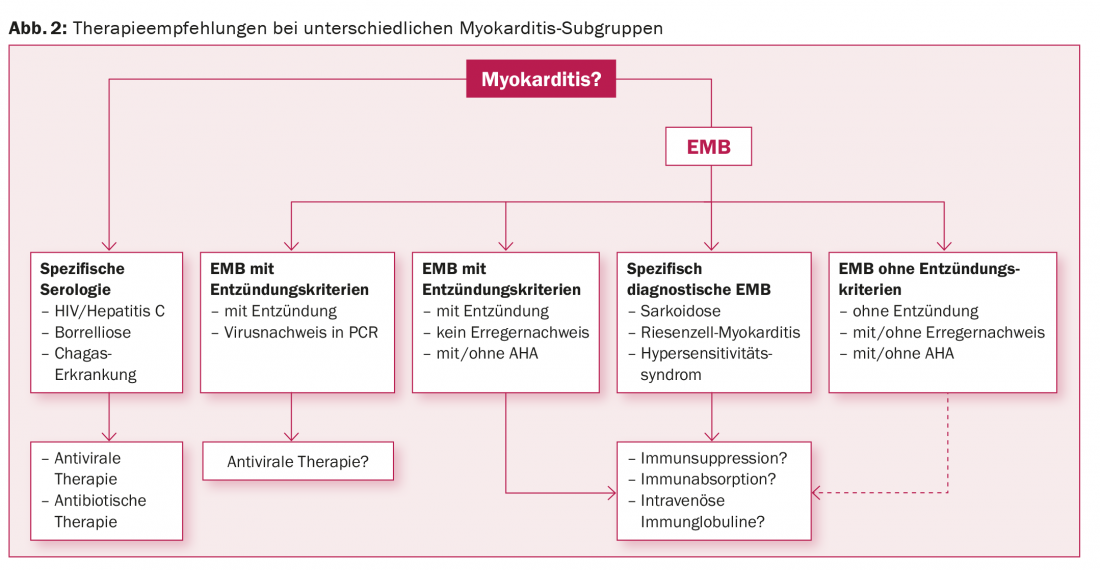
Para los pacientes con VIH, Chagas, borreliosis o tuberculosis, la atención se centra en la terapia de estas enfermedades. Si se detecta inflamación con detección simultánea de virus en el BEM, las opciones de terapia antiviral dependen del tipo de virus. En ausencia de detección vírica, el tratamiento inmunosupresor es básicamente una opción; ya se ha demostrado el efecto potencialmente beneficioso en las miocarditis negativas al virus confirmadas biopticamente, al menos en lo que respecta a los parámetros funcionales registrados ecocardiográficamente [87]. Para el futuro, esperamos ensayos controlados aleatorios prospectivos, multicéntricos e internacionales con un gran número de pacientes.
Bibliografía del editor
CARDIOVASC 2015; 14(4): 22-29