Un 1% de todas las mujeres se ven afectadas por un fallo ovárico prematuro. A menudo se desconoce la causa exacta.
El término insuficiencia ovárica prematura (IOP) hace referencia a la pérdida prematura de la función ovárica antes de los 40 años con la consecuente aparición combinada de hipogonadismo hipergonadotrópico y amenorrea primaria/secundaria.
Se supone que la prevalencia de la IOP es del 1% de la población femenina antes de los 40 años y del 0,1% antes de los 30 años. La menopausia entre los 40 y los 44 años se denomina “menopausia precoz” y tiene una prevalencia del 5%. La menopausia a partir de los 45 años se considera regular [1].
Diagnóstico
La PDI está presente cuando se cumplen los siguientes criterios diagnósticos:
- Amenorrea primaria o secundaria ≥4 meses
- Edad <40 años de vida
- FSH ≥25 U/l, dos mediciones a intervalos de >4 semanas
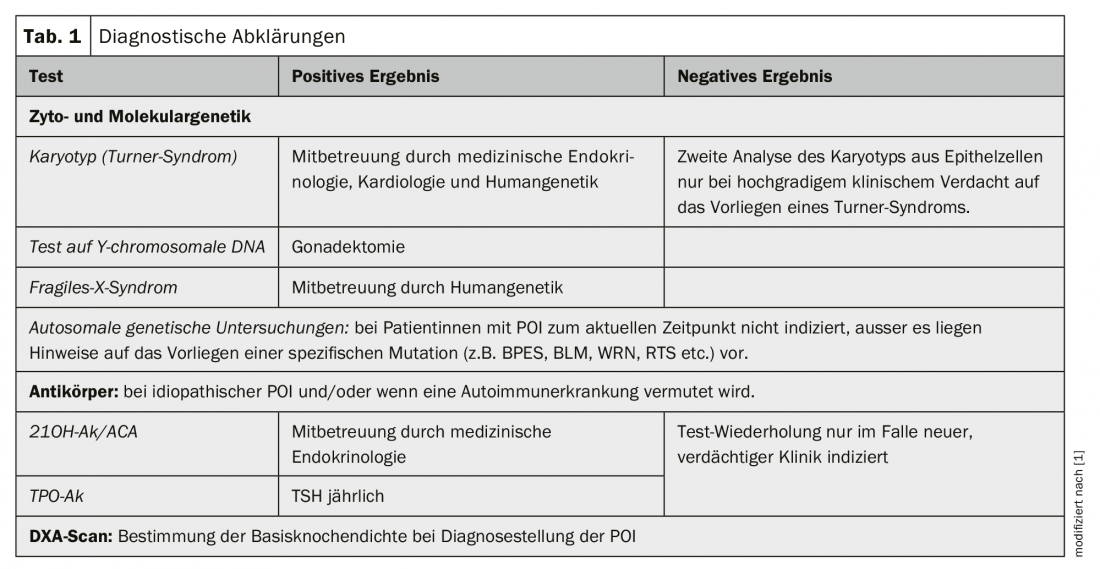
La tabla 1 ofrece una visión general de las aclaraciones diagnósticas.
Etiología
PDI idiopática: En la gran mayoría de todas las PDI (85-90%), no puede identificarse una causa exacta. Esto se denomina PDI idiopática [1].
PDI de causa genética: Las anomalías cromosómicas son detectables en el 10-13% de todos los pacientes con PDI. La mayoría (94%) son aberraciones numéricas y/o estructurales del cromosoma X (por ejemplo, el síndrome de Turner) [1]. En los casos de disgenesia gonadal con ADN cromosómico Y detectable, se recomienda la gonadectomía profiláctica debido al riesgo significativamente mayor (45%) de desarrollar una neoplasia gonadal durante el curso de la enfermedad [2]. Debe realizarse un cariotipo en todas las mujeres con PDI no iatrogénica [1].
El síndrome del cromosoma X frágil (síndrome de Martin Bell) es la causa más común de retraso mental hereditario. Este trastorno dominante ligado al cromosoma X con penetrancia reducida en el sexo femenino está causado por una mutación en el gen FMR1 (“fragile-X-mental-retardation 1”) del brazo largo del cromosoma X. En presencia de una premutación, existe un riesgo del 13-26% de desarrollar POI en las hembras, pero no así en presencia de una mutación completa. En pacientes con PDI esporádica, cabe esperar una prevalencia de una premutación FraX del 0,8-7,5%, en pacientes con antecedentes familiares positivos para PDI incluso de hasta el 13% [3]. La exclusión genética de una premutación FraX está indicada en todos los pacientes con IOP [1].
PDI de causa autoinmunológica: En aproximadamente el 5% de todas las madrinas con PDI, el cuadro clínico está causado por un daño de origen autoinmunológico en el ovario. En la mayoría de las IOP autoinmunes, otros órganos están implicados en el proceso autoinmune además del ovario, como parte de un síndrome autoinmune poliglandular de tipo 1/2. La autoinmunidad dirigida contra la corteza suprarrenal se encuentra en el 60-80% y contra la glándula tiroides en el 14-27%. La biopsia ovárica para el diagnóstico de la IOP autoinmunológica se considera obsoleta. La detección serológica de los denominados SCA (anticuerpos esteroideos celulares), como por ejemplo El 21OH-Ak (21-hidroxilasa-Ak) o alternativamente el ACA/NNR-Ak (Ak adrenocortical/Ak cortical suprarrenal), todos ellos dirigidos contra enzimas implicadas en la síntesis de hormonas esteroideas y, por tanto, potencialmente contra la corteza suprarrenal, el ovario, los testículos y la placenta, es el marcador con mayor sensibilidad diagnóstica para una IOP de causa autoinmunológica. En consecuencia, debe ofrecerse el cribado de 21OH-Ak o alternativamente ACA/NNR-Ak a todos los pacientes con PDI idiopática. Además, el cribado de la tiroides A (TPO A) está indicado en todos los pacientes con PDI idiopática [1].
PDI como resultado de intervenciones iatrogénicas (quimioterapia, radioterapia, cirugía): Las quimioterapias citotóxicas tienen un grado variable de efecto gonadotóxico en función de la sustancia activa utilizada, la dosis acumulada y la edad del paciente, lo que a su vez se asocia a un mayor riesgo de desarrollar IOP.
Asimismo, en función de la dosis de radiación, el campo de radiación y la edad de la paciente, la radioterapia deteriora la función ovárica hasta el POI.
Las intervenciones quirúrgicas en la zona de los ovarios, como la extirpación de endometriomas en la endometriosis, también conducen a una edad menopáusica significativamente inferior, así como a un mayor riesgo de IOP [4,5] debido a la pérdida asociada de tejido ovárico sano con la consiguiente reducción de la reserva ovárica.
Consecuencias a corto plazo del POI
Al igual que en la menopausia normal, la intensidad de los síntomas relacionados con la deficiencia de estrógenos varía con la IOP. El abanico se extiende desde pacientes completamente asintomáticas que sólo acuden para aclarar una amenorrea hasta pacientes que sufren considerablemente. Los síntomas típicos de la menopausia incluyen molestias vasomotoras en el sentido de sofocos y brotes de sudoración, trastornos del sueño, agotamiento físico y mental, atrofia urogenital con molestias en el sentido de vejiga hiperactiva, incontinencia de esfuerzo, sequedad vaginal con dispareunia consecutiva, infecciones urinarias recurrentes, problemas sexuales con falta de libido y cambios en la satisfacción sexual, molestias articulares y musculares difusas y un estado de ánimo deprimido. Dependiendo de los síntomas, se utiliza terapéuticamente la sustitución estrogénica sistémica y, si es necesario, la sustitución estrogénica local aditiva. Sin embargo, incluso aquellas pacientes con IOP que son asintomáticas requieren una THS sistémica constante para prevenir las consecuencias negativas a largo plazo de la deficiencia prematura de estrógenos sobre la salud cardiovascular, el metabolismo óseo y la función cognitiva [6].
Efectos a largo plazo del POI
Salud cardiovascular: Como resultado de la pérdida prematura del efecto estrogénico protector cardiovascular, las pacientes con IOP tienen un riesgo significativamente mayor de sufrir enfermedades cardiovasculares y mortalidad cardiovascular [7]. Se recomienda iniciar la sustitución con esteroides sexuales lo antes posible y continuarla hasta la edad media de la menopausia regular, 52 años, para contrarrestar lo mejor posible el aumento del riesgo cardiovascular [1].
Salud ósea: Es bien conocida la influencia beneficiosa de los estrógenos en la regulación del metabolismo óseo y el mantenimiento de la estructura ósea, así como las consecuencias negativas de la menopausia natural en la densidad ósea y el riesgo de fracturas. Se ha demostrado que la POI está asociada a una reducción de la densidad ósea debida a la deficiencia de estrógenos. Esto nos permite concluir que la PDI se asocia de forma consecutiva a un mayor riesgo de fractura, aunque esta suposición aún no pueda ser suficientemente corroborada por los estudios en la actualidad [8]. Cuando se diagnostica la PDI, se recomienda realizar una exploración DXA para determinar la densidad ósea basal. En el caso de una densidad ósea normal adecuada a la edad y el inicio de una THS con dosis suficientes, no es necesario repetir la exploración DXA [1].
La terapia de sustitución de estrógenos es el tratamiento de elección tanto para la prevención como para el tratamiento de la osteoporosis en pacientes con IOP. En consecuencia, se recomienda iniciar la THS lo antes posible y continuarla hasta la edad menopáusica fisiológica media [6].
Fertilidad, embarazo y riesgos obstétricos: La THS no es anticonceptiva y, por lo tanto, puede/debe recomendarse también a todas las pacientes con un deseo existente de tener hijos. Se favorece un régimen secuencial en la maternidad positiva. Por el contrario, las pacientes para las que el embarazo no es una opción requieren una anticoncepción segura [1].
Debido a la reactivación intermitente de la actividad ovárica, sobre todo al principio, la posibilidad de que se produzca un embarazo espontáneo con la IOP no puede descartarse por completo, aunque es muy pequeña. La probabilidad de concepción espontánea disminuye de forma natural con la duración de la amenorrea. Una revisión sistemática sobre la fertilidad y los resultados del embarazo en la IOP encontró una probabilidad de concepción espontánea del 5-10%. El 80% de estos embarazos dieron lugar a un nacido vivo, en el 20% se produjo un aborto espontáneo, cifras que no difieren de las de las mujeres normalmente fértiles [9].
En la actualidad, no se conocen intervenciones reproductivas que mejoren de forma fiable la actividad ovárica y, en consecuencia, la tasa de concepción espontánea en la IOP. No cabe esperar una respuesta ovárica a la estimulación con gonadotropinas y/o inducción de la ovulación debido a la reserva de ovocitos agotada con gonadotropinas consecutivas ya elevadas endógenamente. Una vez diagnosticada la IOP, la opción de protección de la fertilidad también ha pasado a mejor vida. La donación de óvulos es una opción realista y bien establecida para que las pacientes con IOP puedan quedarse embarazadas [1].
Salud neurológica: Varios estudios observacionales de gran tamaño han encontrado un mayor riesgo de deterioro de la función cognitiva o de desarrollo de demencia en pacientes con IOP. El riesgo de deterioro cognitivo aumentaba cuanto más joven era el paciente en el momento del diagnóstico. En pacientes que habían recibido terapia de sustitución estrogénica hasta los 50 años, no se pudo encontrar ni deterioro mental ni un mayor riesgo de demencia [10, 11]. En consecuencia, para reducir el riesgo de un posible deterioro cognitivo relacionado con la deficiencia hormonal en pacientes con IOP, la THS debe administrarse al menos hasta la edad media normal de la menopausia [1].
Función sexual y urogenital: Una terapia de sustitución estrogénica sistémica adecuada proporciona la base para una función sexual y urogenital normal. Si esto no es suficiente, pueden utilizarse estrógenos locales como aditivo. Faltan datos sobre la eficacia y la seguridad a largo plazo de la suplementación opcional con andrógenos adicionales [1].
Calidad de vida: El diagnóstico de PDI tiene un impacto negativo significativo en el bienestar psicológico y la calidad de vida de la persona afectada. Esto debe abordarse en las conversaciones y debe ofrecerse apoyo psicológico.
Terapia hormonal sustitutiva
La THS para la IOP no sólo está indicada para aliviar los síntomas relacionados con la deficiencia de estrógenos, como las molestias vasomotoras, sino también por motivos profilácticos. Debería recomendarse a las pacientes con IOP al menos una dosis estándar de THS para la prevención primaria de las enfermedades cardiovasculares y para la protección ósea y neuroprotectora hasta que alcancen la edad menopáusica fisiológica media [1].
Sustancia activa: Se utiliza la THS clásica (estrógeno: estradiol) por un lado y los anticonceptivos orales combinados (estrógeno: etinilestradiol) por otro. Tanto las progestinas sintéticas como la progesterona micronizada “bioidéntica”, cada una en dosis de transformación, pueden utilizarse para la protección del endometrio.
Régimen: Para evitar en la medida de lo posible los síntomas de la carencia de estrógenos, se recomienda una terapia de sustitución estrogénica continua. La gran mayoría de los preparados de THS aprobados cumplen este requisito, pero no la mayoría de los anticonceptivos hormonales aprobados. No es infrecuente que las mujeres con IOP que toman anticonceptivos orales combinados en el régimen 21/7 estén sintomáticas en el intervalo sin píldora. Por consiguiente, si hay necesidad de anticoncepción, es aconsejable prescribir píldoras en el régimen 24/4 o 26/2 o en el ciclo largo.
Ahora se plantea la cuestión de si la administración aditiva de progestágenos se realiza mejor de forma continua o cíclica. En principio, pueden utilizarse ambos regímenes de THS, según la preferencia de la paciente. Como consecuencia de la actividad ovárica, que suele brotar de forma intermitente, sobre todo al principio, pueden producirse hemorragias vaginales impredecibles de forma repetida con un régimen combinado continuo. Debido a la hemorragia por deprivación hormonal regulada cuando se utiliza un régimen secuencial, este régimen suele ser el preferido por las pacientes, al menos al principio. Lo mismo ocurre en las mujeres con un deseo positivo de tener hijos, ya que un régimen secuencial imita mejor el ciclo endometrial regular con una alternancia cíclica de las fases de proliferación y secreción. El deseo de amenorrea se satisface con el régimen combinado continuo, que es superior al régimen secuencial en términos de seguridad endometrial [1].
Forma farmacéutica: Los datos sobre la THS en mujeres menopáusicas a tiempo muestran que los estrógenos orales aumentan significativamente el riesgo de TEV. Esta es la ventaja de la terapia estrogénica transdérmica, que no afecta a este riesgo [17]. A diferencia de la forma de administración oral, la aplicación transdérmica de estradiol puede eludir el efecto de primer paso en el hígado y, en consecuencia, evitar el desplazamiento del equilibrio hemostaseológico hacia la procoagulación. Aunque faltan datos sobre la IOP, la administración transdérmica de estrógenos es preferible en pacientes con riesgo de TEV [1].
Cáncer de mama, el riesgo más temido: Según los datos actuales, las pacientes con IOP tienen incluso un riesgo significativamente menor de padecer cáncer de mama en comparación con el grupo de control. Lo más probable es que esto se deba a la deficiencia prematura de esteroides sexuales que acompaña inevitablemente a la IOP. Las mujeres con IOP deben estar tranquilas porque, según los datos actuales, la THS antes de la edad menopáusica normal/fisiológica no aumenta el riesgo de cáncer de mama en comparación con la población normal. El hecho de que la THS aplicada a pacientes después de los 50 años aumente significativamente el riesgo de cáncer de mama en función de la duración de la terapia no debe extrapolarse a las pacientes con PDI [1,6].
Mensajes para llevarse a casa
- El fallo ovárico prematuro requiere un diagnóstico exhaustivo: anamnesis (quimioterapia, radioterapia, operaciones), esclarecimiento de las causas genéticas, exclusión de un síndrome autoinmune poliglandular.
- Cuando se establece un diagnóstico, se recomienda realizar una exploración DXA para determinar la densidad ósea basal.
- Faltan enfoques terapéuticos causales.
- La terapia hormonal sustitutiva (THS) está indicada hasta que se alcanza la edad media de la menopausia regular para contrarrestar las consecuencias negativas a largo plazo, relacionadas con la deficiencia de estrógenos, sobre la salud ósea, el sistema cardiovascular y la función cognitiva.
Literatura:
- European Society for Human Reproduction and Embyology (ESHRE) Guideline Group on POI, et al: Directriz de la ESHRE: tratamiento de las mujeres con insuficiencia ovárica prematura. Hum Reprod 2016; 31(5): 926-937.
- Michala L, et al: Síndrome de Swyer: presentación y resultados. BJOG 2008; 115(6): 737-741.
- Wittenberger MD, et al: La premutación FMR1 y la reproducción. Fertil Steril 2007; 87(3): 456-465.
- Raffi F, Metwally M, Amer S: El impacto de la escisión del endometrioma ovárico en la reserva ovárica: una revisión sistemática y metaanálisis. J Clin Endocrinol Metab 2012; 97(9): 3146-3154.
- Coccia ME, et al: La cirugía ovárica por endometriomas bilaterales influye en la edad de la menopausia. Hum Reprod 2011; 26(11): 3000-3007.
- Hamoda H: Sociedad Británica de Menopausia y Women’s Health Concern: Recomendaciones de la Sociedad Británica de Menopausia y Women’s Health Concern sobre el tratamiento de las mujeres con insuficiencia ovárica prematura. Post Reprod Health 2017; 23(1): 22-35.
- Roeters van Lennep JE, et al: Riesgo de enfermedad cardiovascular en mujeres con insuficiencia ovárica prematura: Una revisión sistemática y metaanálisis. Eur J Prev Cardiol 2016; 23(2): 178-186.
- Kanis JA, et al: Una revisión sistemática de los umbrales de intervención basados en el FRAX: Un informe elaborado para el Grupo Nacional de Directrices sobre Osteoporosis y la Fundación Internacional de Osteoporosis. Arch Osteoporos 2016; 11(1): 25.
- van Kasteren YM, Schoemaker J: Fallo ovárico prematuro: una revisión sistemática sobre las intervenciones terapéuticas para restaurar la función ovárica y lograr el embarazo. Hum Reprod Update 1999; 5(5): 483-492.
- Rocca WA, et al.: Mayor riesgo de deterioro cognitivo o demencia en mujeres sometidas a ooforectomía antes de la menopausia. Neurología 2007; 69(11): 1074-1083.
- Phung TK, et al: Histerectomía, ovariectomía y riesgo de demencia: un estudio de cohortes histórico a escala nacional. Dement Geriatr Cogn Disord 2010; 30(1): 43-50.
- Langrish JP, et al: Efectos cardiovasculares de los regímenes de sustitución de esteroides sexuales fisiológicos y estándar en el fallo ovárico prematuro. Hipertensión 2009; 53(5): 805-811.
- Crofton PM, et al: Reemplazo fisiológico frente a reemplazo estándar de esteroides sexuales en mujeres jóvenes con fallo ovárico prematuro: efectos sobre la adquisición de masa ósea y el recambio. Clin Endocrinol (Oxf) 2010; 73(6): 707-714.
- Cartwright B, et al: Terapia hormonal sustitutiva frente a la píldora anticonceptiva oral combinada en el fallo ovárico prematuro: un ensayo controlado aleatorizado de los efectos sobre la densidad mineral ósea. J Clin Endocrinol Metab 2016; 101(9): 3497-3505.
- Mueck AO: Terapia hormonal sustitutiva posmenopáusica y enfermedad cardiovascular: el valor del estradiol transdérmico y la progesterona micronizada. Climaterio 2012; 15(Suppl 1): 11-17.
- Davey DA: THS: algunas cuestiones clínicas sin resolver en el cáncer de mama, el cáncer de endometrio y la insuficiencia ovárica prematura. Womens Health (Lond) 2013; 9(1): 59-67.
- Canonico M, et al: Terapia hormonal sustitutiva y riesgo de tromboembolia venosa en mujeres posmenopáusicas: revisión sistemática y metaanálisis. BMJ 2008; 336(7655): 1227-1231.
PRÁCTICA GP 2019; 14(5): 9-12