Las opciones farmacológicas en el tratamiento del cáncer de pulmón se han desarrollado rápidamente en los últimos años. Además de la quimioterapia clásica, la inmunoterapia y la terapia dirigida de las mutaciones impulsoras están cobrando cada vez más protagonismo. La importancia de la biopsia y también de la rebiopsia bajo terapia ha aumentado enormemente.
Las opciones farmacológicas en el tratamiento del cáncer de pulmón se han desarrollado rápidamente en los últimos años. Además de la quimioterapia clásica, la inmunoterapia y la terapia dirigida de las mutaciones impulsoras están cobrando cada vez más protagonismo. El requisito previo básico para una terapia farmacológica personalizada es el examen inmunohistoquímico y molecular patológico del tejido tumoral. Debido a estos avances, la importancia de la biopsia y también de la rebiopsia bajo terapia ha aumentado enormemente.
Debido a la favorable relación riesgo-beneficio, la broncoscopia es el método de elección. El examen debe proporcionar una aclaración exhaustiva de la situación torácica. Esto incluye las manifestaciones tumorales centrales y periféricas y el estado de los ganglios linfáticos mediastínicos.
Un requisito previo obligatorio para ello es la presencia de imágenes de sección torácica al menos en forma de un TAC con contraste, óptimamente un TAC-TEP combinado.
Tumor central
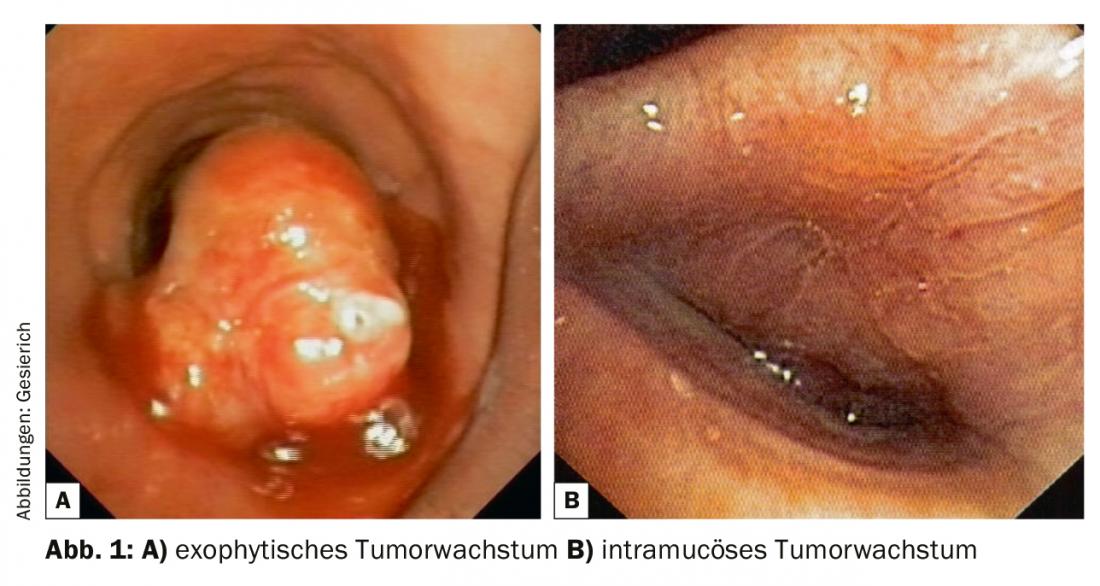
Un tumor central en la zona visible broncoscópicamente debe describirse en primer lugar en términos de su localización y extensión. Debe indicarse la distancia a los puntos de referencia proximales y distales más próximos (carina principal, colgajo, ostia del segmento y subsegmento), así como la longitud del segmento bronquial afectado por el tumor. En este contexto, el broncólogo debe estar familiarizado con las opciones quirúrgicas torácicas, incluidos los procedimientos broncoplásticos complejos (“resecciones en manguito”). Debe describirse el tipo de infestación tumoral (exofítica, intramucosa, submucosa). Se caracterizará y cuantificará cualquier estenosis de las vías respiratorias resultante (endoluminal-exofítica; compresión extrínseca; estenosis combinadas).
El siguiente paso es la biopsia, en la que también deben tenerse en cuenta las mayores necesidades de tejido de la patología para la realización de análisis inmunohistoquímicos y moleculares. En el caso de los tumores exofíticos (Fig. 1), la extracción de los biospis con fórceps suele ser suficiente para este fin. Si se planifica al mismo tiempo la ablación de exófitos tumorales para su recanalización, la extracción con la criosonda también es una opción, que proporciona muestras excelentes para el procesamiento histopatológico. Este tipo de recogida de material también ofrece ventajas en caso de crecimiento tumoral intramucoso debido a la mayor profundidad de la biopsia. En caso de crecimiento submucoso, suele ser necesaria una aspiración transbronquial con aguja (TBNA) para la confirmación histológica. Esto puede hacerse con agujas TBNA convencionales y flexibles, pero también puede utilizarse la ecografía endobronquial (EBUS) para la orientación.
Tumor periférico
Existen dos posibles vías de acceso a las manifestaciones tumorales periféricas, que difieren en términos de rendimiento diagnóstico y riesgo (tab. 1) : La punción transtorácica tiene una alta sensibilidad. Para los focos con contacto con la pared torácica, puede ser ecoguiada de la mano del neumólogo. Si hay tejido pulmonar que contenga aire entre el foco y la pared torácica, se requiere un abordaje guiado por TC por parte del radiólogo. Sin embargo, debido a la necesaria lesión de la pleura, existe un riesgo relevante de neumotórax. La biopsia transbronquial guiada por broncoscopia tiene una sensibilidad menor, especialmente para los focos más pequeños. Sin embargo, como se realiza por vía naturalis, también se asocia a una tasa de neumotórax significativamente menor. Por lo tanto, el abordaje broncoscópico debe preferirse siempre que sea posible, sobre todo porque permite aclarar otras manifestaciones tumorales torácicas en el mismo procedimiento. Para la elección individual del método óptimo, es necesario un estudio detallado del TAC torácico en la ventana pulmonar, prestando especial atención a la relación posicional del foco con el árbol bronquial y a la presencia de un bronquio de alimentación. Una alta resolución en forma de un bajo grosor de capa (≤1 mm) supone una gran ventaja en este caso.

Antes de la biopsia transbronquial, el examinador debe planificar mentalmente la vía de acceso en el TAC torácico con la mayor precisión posible. Para poder dirigir los instrumentos de biopsia lo más periféricamente posible, debe elegirse un broncoscopio fino (<5 mm). Los fabricantes también han desarrollado ahora broncoscopios ultrafinos (≤3 mm) con un canal de trabajo suficiente para esta indicación. Además, debe prestarse atención a los indicios indirectos de localización tumoral en la zona visible broncoscópicamente, como restos de sangre, fenómenos de compresión y formación de secreciones en los ostia.
La palpación más allá de la zona visible broncoscópicamente requiere el uso de otro procedimiento para la navegación y la orientación del instrumento de biopsia. Para ello se utiliza clásicamente la fluoroscopia de rayos X. Un co-movimiento del foco en la imagen fluoroscópica en el momento de la biopsia (“signo de bamboleo”) puede ser una indicación de la consecución del objetivo. Una combinación de instrumentos de biopsia (pinzas, cepillo citológico, aguja TBNA) puede aumentar el rendimiento diagnóstico. Sin embargo, la sensibilidad desciende rápidamente en proporción al tamaño del foco periférico (tab. 1).
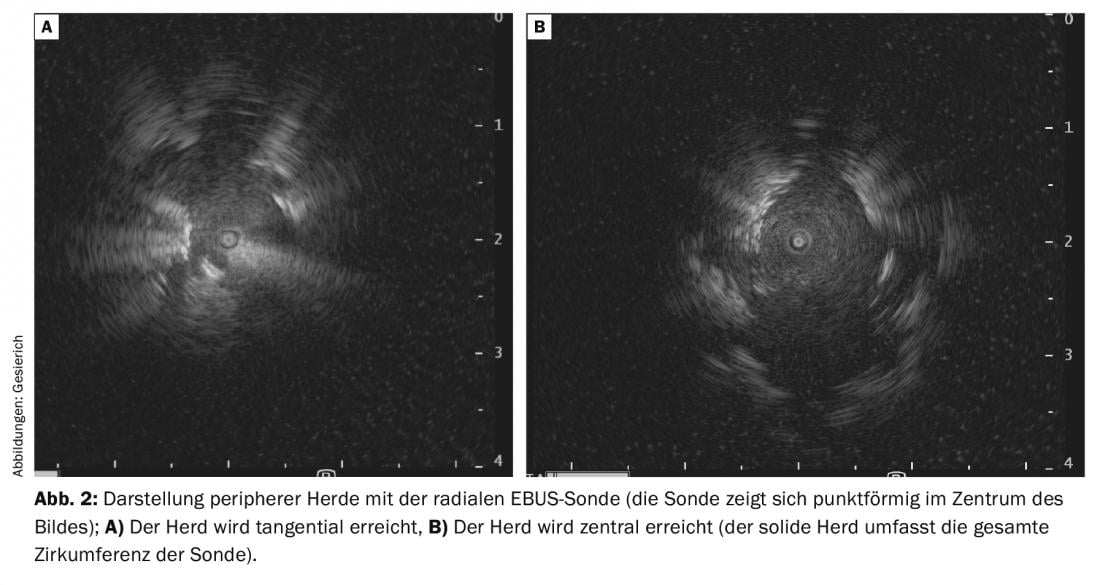
Esto supone un incentivo para el desarrollo de otras ayudas a la navegación [2]. Debido a su bajo coste y a que ahorra tiempo, la sonda radial de ultrasonidos (rEBUS) se ha convertido en la más utilizada. Un transductor giratorio en la punta de una sonda flexible proporciona una imagen de 360° del entorno bronquial. De camino al foco, se muestra la imagen ecográfica típica del parénquima pulmonar que contiene aire. Cuando se alcanza el foco, se demarca en la imagen de ultrasonidos. Debe distinguirse una posición tangencial en el foco de una posición central dentro del foco (visualización de tejido sólido en toda la circunferencia de la sonda) (Fig. 2A y B) . Esta última situación se asocia a un mayor rendimiento diagnóstico. A continuación se traza la trayectoria así encontrada con el instrumento de biopsia, utilizando como referencia la posición de la sonda rEBUS en la imagen fluoroscópica. Para facilitar la orientación, la sonda también puede utilizarse para hacer avanzar un catéter guía hasta el foco, a través del cual se introducen después los instrumentos de biopsia una vez retirada la sonda. Este procedimiento también permite utilizar criosondas ultrafinas para la biopsia transbronquial. Esto permite obtener grandes biopsias hemisféricas que, a diferencia de una biopsia con fórceps más ortógrada, también contienen porciones tangenciales del entorno bronquial. Por lo tanto, este método debe considerarse especialmente en caso de visualización únicamente tangencial del punto focal periférico en el rEBUS.
Un método mucho más costoso y que requiere más tiempo es la navegación electromagnética (REM). El paciente yace en un campo electromagnético generado por una placa integrada en la camilla de exploración. La navegación se realiza con una sonda en cuya punta se inducen corrientes de inducción en bobinas. Estas corrientes varían en función de la posición en el campo electromagnético y su magnitud permite la localización. El TAC torácico del paciente debe leerse primero en el sistema de navegación como un “mapa de carreteras”, y la posición de la punta de la sonda se muestra entonces tridimensionalmente en la imagen del TAC. También con este método se lleva un catéter guía hasta el foco periférico, a través del cual se pueden realizar las biopsias. Por último, existe la opción de la broncoscopia virtual (VB): un programa informático reconstruye un árbol bronquial virtual a partir del conjunto de datos de un TAC torácico de alta resolución, mediante el cual se puede planificar de antemano de forma semiautomática una trayectoria hasta el foco periférico. Durante la broncoscopia real con un broncoscopio ultrafino, se produce una comparación continua, asistida por software, entre la imagen virtual y la endoscópica. En los puntos de división bronquial, el software muestra el subsegmento que debe seleccionarse.
Con las ayudas a la navegación descritas, puede alcanzarse una sensibilidad de hasta el 70% incluso con focos periféricos más pequeños [3]. La accesibilidad técnica de un bronquio sigue siendo una limitación. Por ello, existen intentos experimentales de abandonar el árbol bronquial y proceder de forma transparente hasta el foco periférico (“acceso broncoscópico transparente al nódulo”, BTPNA). En una broncoscopia virtual, se planifican de antemano un “punto de entrada” (POE) en la pared de la vía aérea y un trayecto a través del parénquima hasta el foco que esté lo más libre posible de vasos. En la broncoscopia, la punción se realiza en el POE y se utiliza un trocar para crear un túnel hasta el foco periférico.
En la actualidad, el uso de sistemas de broncoscopia asistida por robot puede considerarse muy experimental y probablemente muy costoso. La “Plataforma Ion” (Intuitive Surgical, Sunnyvale, CA, EE.UU.) consiste en un catéter flexible con un canal de trabajo de 2 mm, cuya punta puede angularse en todos los planos con movimientos finamente controlados. Toda la longitud del catéter es recorrida por una fibra sensora que proporciona información sobre la forma y la posición. El examinador puede controlar a distancia el sistema a través de una consola mediante una bola de seguimiento y una rueda de desplazamiento, que el robot traduce en movimientos precisos y limpios de la punta de la sonda. La orientación es similar a la de la broncoscopia virtual, ya que la fibra del sensor proporciona información adicional para la navegación y la estabilidad posicional durante la biopsia [4].
En relación con la introducción prevista del cribado del cáncer de pulmón, es de esperar un gran número de focos periféricos que requieran una aclaración, por lo que la mayoría de estos hallazgos serán benignos. También en este contexto, es de agradecer un mayor desarrollo de la instrumentación broncoscópica para el sondaje periférico que permita aclarar estos hallazgos de la forma más mínimamente invasiva posible.
En algunas localizaciones tumorales de difícil acceso para una biopsia transbronquial, se puede acceder mediante aspiración transbronquial con aguja a través de un broncoscopio de punción por ultrasonidos (EBUS-TBNA). Esto se aplica a los tumores paramediastínicos de ambos lóbulos superiores adyacentes a la tráquea y el esófago, así como a los tumores peribronquiales e hiliares.
Estado de los ganglios linfáticos mediastínicos
El estado de los ganglios linfáticos mediastínicos es el factor pronóstico más importante en pacientes metastásicos no remotos y un parámetro decisivo para determinar la operabilidad en el cáncer de pulmón. Por ello, la detección preterapéutica lo más precisa posible de la afectación de los ganglios linfáticos mediastínicos es de gran importancia para la planificación de la terapia.
Los métodos de diagnóstico por imagen, incluido el PET-TC, tienen una sensibilidad y especificidad insuficientes (Tab. 2). Por lo tanto, es necesaria una estadificación invasiva.

Debido al gran alcance y a la alta sensibilidad y especificidad asociadas, así como al menor riesgo, la endosonografía y la aspiración transbronquial con aguja guiada por ecografía (EBUS-TBNA) se recomiendan ahora en las directrices como método mínimamente invasivo de primera elección para la estadificación mediastínica, mientras que a las vías de acceso quirúrgicas invasivas (mediastinoscopia, toracoscopia asistida por vídeo) se les ha dado el estatus de reserva para situaciones poco claras.
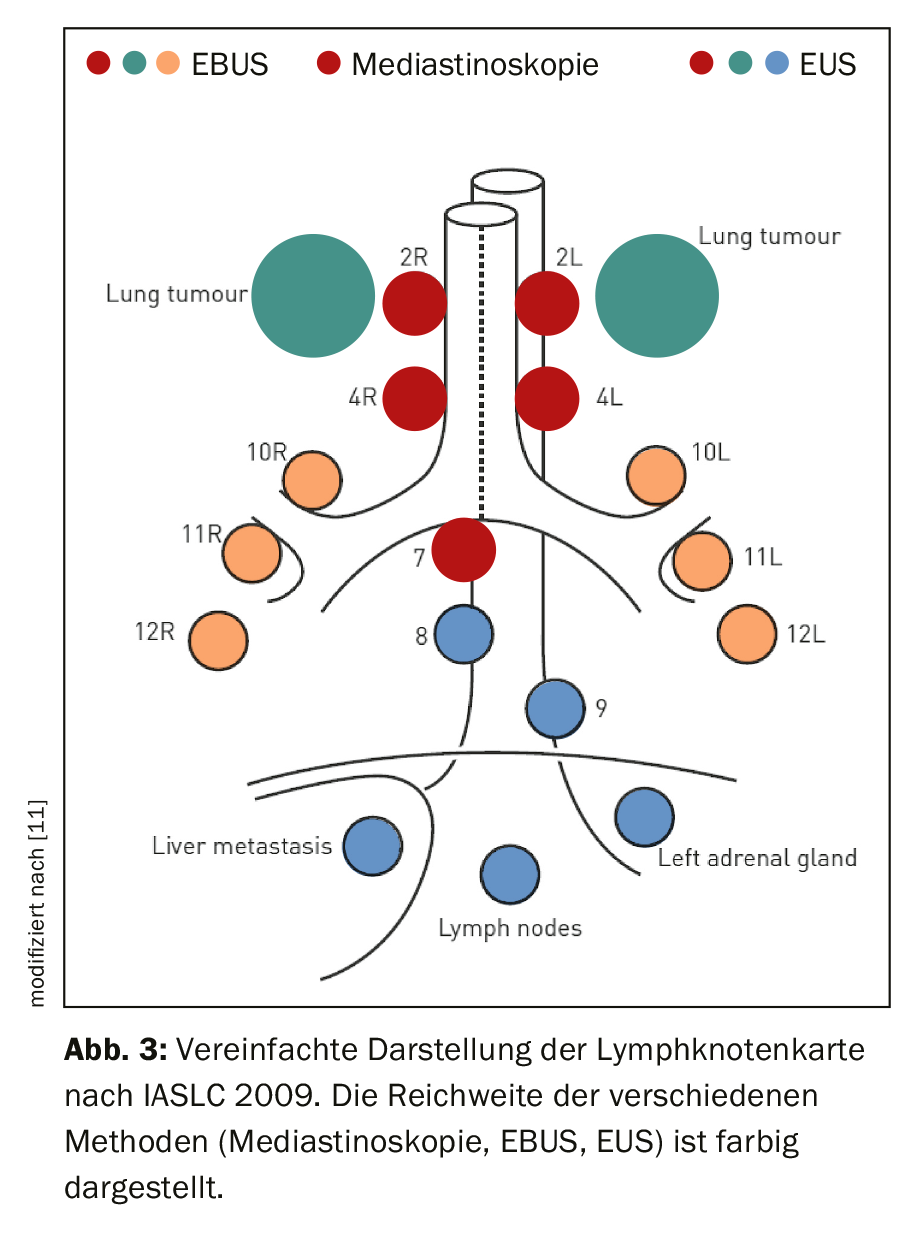
El examinador necesita un conocimiento detallado de la anatomía de los ganglios linfáticos torácicos. Para ello, se utiliza el mapa de ganglios linfáticos de la Asociación Internacional para el Estudio del Cáncer de Pulmón (IASLC) en su versión propuesta en 2009, cuyos detalles pueden consultarse en la publicación correspondiente [6,7]. Las estaciones individuales de los ganglios linfáticos se definen en su relación topográfica con el árbol traqueobronquial y los vasos torácicos. El pabellón 1 corresponde a los ganglios linfáticos supracalviculares, por lo que se asigna al nivel N3. Las estaciones 2-9 están situadas de craneal a caudal en el mediastino. Se asignan al nivel N2 en caso de localización tumoral ipsilateral, y al nivel N3 en caso de localización tumoral contralateral. La estación 10 está situada en el hilio, las estaciones 11-14 son lobares, segmentarias y subsegmentarias en los pulmones. Pertenecen al nivel N1 en el caso de un tumor ipsilateral y al nivel N3 en el caso de un tumor contralateral. La figura 3 muestra la selección de las estaciones ganglionares accesibles endosonográficamente. Mientras que la mediastinoscopia sólo abarca los ganglios linfáticos paratraqueales superiores e inferiores (salas 2 y 4) y los ganglios linfáticos infracarinales (sala 7), la ecografía endobronquial (EBUS) alcanza además los ganglios linfáticos hiliares (sala 10), interlobulares (sala 11) y segmentarios (sala 12). Los ganglios linfáticos mediastínicos inferiores (salas 8 y 9) también pueden puncionarse mediante un abordaje transoesofágico (ecografía endoscópica; EE).
La estadificación endosonográfica debe ser completa y sistemática. Las directrices de la Sociedad Respiratoria Europea (ERS) recomiendan la combinación de EBUS y EUS, si se dispone de ellas, ya que es la única forma de conseguir el alcance completo de la endosonografía [8]. El examen EUS suele realizarse con un gastroscopio de ultrasonidos en la mano del gastroenterólogo. Pero el broncoscopio ecográfico (EUS-B) también puede introducirse a través del esófago. Esto requiere una formación adecuada del examinador, pero permite una estadificación endosonográfica completa por parte del neumólogo en un solo procedimiento, con la correspondiente reducción de la carga y el coste para el paciente. Las directrices recomiendan al menos una aspiración con aguja de los ganglios linfáticos paratraqueales inferiores (salas 4R y 4L) e infracarinales (sala 7). Además, se tomarán muestras de todas las salas que sean radiológica y/o endosonográficamente llamativas. Para la endosonografía, a menudo se ha aplicado en los estudios un umbral de tamaño de 5 mm. Dado que la EBUS-TBNA es un método citológico, el muestreo debe comenzar en el nivel N3 y progresar a través del nivel N2 hasta el nivel N1. Un procedimiento desviado podría conducir a una estadificación superior al transportar células malignas de las estaciones ganglionares infestadas de tumores de rango inferior a través de la aguja de punción a vasos de muestra asignados a estaciones de rango superior.
La estadificación endosonográfica [8] está indicada en todos los casos con mediastino radiológicamente anormal, definido por ganglios linfáticos mediastínicos >1 cm en la TC y/o con actividad metabólica en la PET. En caso de mediastino radiológicamente discreto, existe una indicación en las siguientes situaciones: localización central del tumor primario, sospecha radiológica de metástasis ganglionares en el hilio (situación N1) y un tumor periférico >3 cm. Si la técnica endoscópica con aguja proporciona un resultado positivo, la afectación de los ganglios linfáticos puede considerarse confirmada. Si no se encuentran células tumorales, no puede descartarse un resultado falso negativo. En la literatura se da una frecuencia de hasta el 24% [1]. Si es relevante para la decisión terapéutica, esta situación debe ir seguida de una estadificación quirúrgica invasiva (Fig. 4).
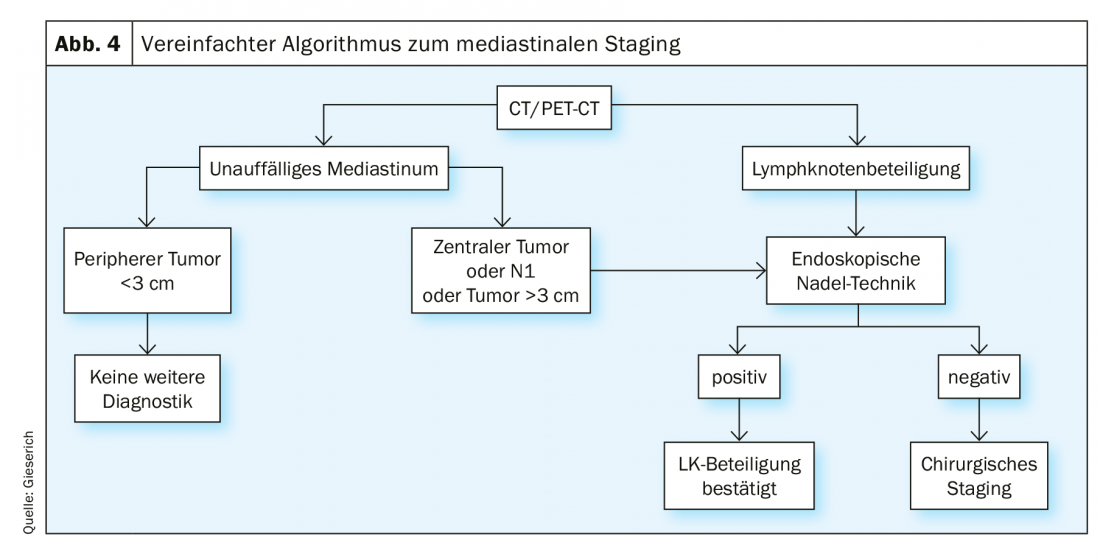
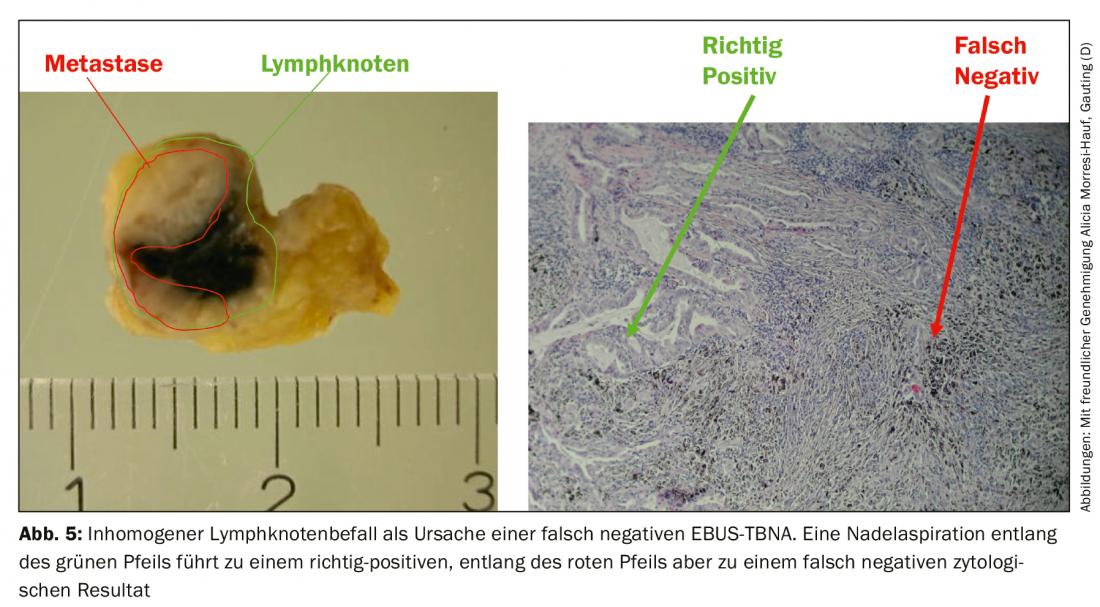
La tasa de falsos negativos se debe a la afectación tumoral no homogénea de los ganglios linfáticos, por lo que en los casos desfavorables la aguja sólo capta el parénquima ganglionar sano (Fig. 5) . Además de la comparación con los hallazgos radiológicos, la endosonografía también proporciona criterios para la clasificación posterior de los aspirados negativos con aguja. Por un lado, se describen las características de la imagen EBUS convencional asociadas a la malignidad: Mientras que los ganglios linfáticos benignos suelen tener una forma ovalada con un borde difuminado y un hilio vascular típico, los ganglios malignos tienden a adoptar una forma redondeada, el borde se delinea más nítidamente, el vaso hiliar central puede estar ausente y la textura del eco puede volverse no homogénea debido a la necrosis por coagulación. Por otro lado, la elastografía puede utilizarse como método ecográfico aún experimental. El método representa la deformabilidad (elasticidad) del tejido examinado. En la aplicación torácica, la deformación de los ganglios linfáticos se aprovecha de la pulsación regular del corazón y de los grandes vasos. De forma similar a la velocidad del flujo en la ecografía dúplex, la deformabilidad se transfiere a una escala de colores y se superpone a la ecografía B-scan. La representación cromática cambia de alta a baja elasticidad del rojo al amarillo y del verde al azul. La predicción de malignidad se basa en el supuesto de que el tejido del ganglio linfático pierde su elasticidad debido a la infiltración del carcinoma. Por lo tanto, los ganglios linfáticos malignos aparecen predominantemente azules (Fig. 6A) y los benignos predominantemente no azules. El examinador debe hacer constar estos hallazgos -si dispone de ellos- en el informe del examen e introducirlos en la discusión de la conferencia sobre el tumor.

En situaciones en las que no es posible el acceso broncoscópico al tumor primario periférico, las metástasis en los ganglios linfáticos mediastínicos e hiliares pueden ser las únicas manifestaciones tumorales accesibles. Por lo tanto, es importante destacar que todos los exámenes histopatológicos necesarios, incluidos los análisis moleculares, pueden realizarse en los aspirados con aguja obtenidos mediante endosonografía. Esto requiere un procesamiento de muestras de alta calidad en el laboratorio de patología, que incluye no sólo la preparación de frotis, sino también la preparación de un bloque celular por centrifugación, el enriquecimiento del material citológico y la incrustación en parafina.
Metástasis
Las metástasis a distancia suelen interponerse en el camino de la terapia curativa. Por lo tanto, en situaciones radiológicamente poco claras, también es necesaria una aclaración histológica. Mientras que las metástasis cerebrales y óseas suelen tener que depender de los hallazgos por imagen, otras localizaciones metastásicas son más susceptibles de recogida de muestras.
Si se produce un derrame pleural en el contexto de un carcinoma de pulmón, el primer paso es un examen citológico del punteado pleural. Dado que la sensibilidad es sólo del 50% aproximadamente, en caso de citología negativa y relevancia terapéutica, el siguiente paso debe ser una toracoscopia asistida por vídeo para la exclusión definitiva de la carcinomatosis pleural.
En el caso de las lesiones ocupantes de espacio en la glándula suprarrenal, la sensibilidad y especificidad del diagnóstico por imagen no son suficientes para un diagnóstico definitivo, por lo que puede ser deseable la confirmación histológica, especialmente en el caso de metástasis aisladas. La vía de acceso clásica es la punción transcutánea guiada por TC. El acceso endosonográfico a través del tracto gastrointestinal superior permite la punción transgástrica de la glándula suprarrenal izquierda en la mayoría de los casos; en algunos casos, también se puede llegar a la glándula suprarrenal derecha por vía transduodenal. Suele realizarse en manos del gastroenterólogo con un gastroscopio de ultrasonidos. Factible pero aún experimental es el acceso con el broncoscopio de ultrasonidos a la glándula suprarrenal izquierda (Fig. 6B y C), que a su vez hace el procedimiento accesible al neumólogo y puede realizarse en la misma sesión con broncoscopia [9]. También hay informes de casos individuales en la literatura de aseguramiento de metástasis hepáticas y metástasis en los ganglios linfáticos epigástricos por la misma vía.
Aspectos procedimentales
Los requisitos descritos para una broncoscopia moderna para el cáncer de pulmón dan una idea de la complejidad del procedimiento. En principio, todos los métodos enumerados pueden utilizarse en la tecnología puramente flexible. Sin embargo, el sondaje periférico difícil, así como la estadificación endosonográfica exhaustiva, se asocian a la correspondiente necesidad de tiempo y requieren unas condiciones de examen tranquilas. Por lo tanto, una unidad de broncoscopia moderna debe tener la posibilidad de realizar el examen bajo anestesia general. La técnica óptima para ello es la broncoscopia rígida. Si no se dispone de ella, se puede optar por la mascarilla laríngea como acceso de ventilación. Esto permite el libre movimiento de los instrumentos broncoscópicos flexibles -especialmente el broncoscopio de punción por ultrasonidos- en la tráquea, de modo que las estaciones de los ganglios linfáticos paratraqueales también permanecen accesibles.
Además, se exige mucho de la cualificación del examinador. Con el aumento de la experiencia, aumenta el rendimiento diagnóstico y disminuye la tasa de complicaciones. Para la endosonografía, existen simuladores y modelos de órganos de goma o animales con los que el aprendiz puede dominar la primera parte de la curva de aprendizaje. El siguiente paso es asumir gradualmente el examen del paciente bajo supervisión. Dado que la curva de aprendizaje puede variar en inclinación de un individuo a otro y que la especificación de un número mínimo de exámenes es arbitraria, en la literatura se proponen pruebas estandarizadas y validadas [10] para comprobar la competencia del broncólogo antes del examen independiente.
Mensajes para llevarse a casa
- La broncoscopia es el método de elección para la confirmación histológica del carcinoma pulmonar. Permite una evaluación completa de la situación torácica, incluidas las manifestaciones tumorales centrales y periféricas, así como el estado de los ganglios linfáticos mediastínicos.
- La criosonda está cobrando cada vez más importancia como instrumento para la biopsia central y transbronquial y para la recanalización en la estenosis exofítica de las vías respiratorias.
- Las ayudas a la navegación para sondear focos periféricos están en rápido desarrollo, desde la sonda radial de ultrasonidos, sencilla y poco costosa de utilizar, hasta técnicas más complejas como la navegación electromagnética y la broncoscopia virtual, pasando por enfoques experimentales como el acceso quimal transparente y la broncoscopia asistida por robot.
- Las estaciones de los ganglios linfáticos torácicos se dividen en 14 estaciones según el mapa de la IASLC de 2009, cuya anatomía debe dominar el examinador.
- En las directrices para la estadificación mediastínica, las técnicas de aguja guiadas por endosonografía se consideran actualmente los métodos de primera elección por su alta sensibilidad y su baja tasa de complicaciones.
- La gama completa se consigue mediante un acceso combinado a través de las vías respiratorias (EBUS) y el esófago (EUS). Ambos pueden realizarse en un solo procedimiento con el broncoscopio ecográfico.
Literatura:
- Rivera MP, Mehta AC: American College of Chest P: Diagnóstico inicial del cáncer de pulmón: directrices de práctica clínica basadas en la evidencia de la ACCP (2ª edición). Tórax 2007; 132: 131S-148S.
- Ishiwata T, Gregor A, Inage T, Yasufuku K: Avances en broncoscopia diagnóstica intervencionista para lesiones pulmonares periféricas. Expert Rev Respir Med 2019; 13: 885-897.
- Wang Memoli JS, Nietert PJ, Silvestri GA: Metaanálisis de la broncoscopia guiada para la evaluación del nódulo pulmonar. Tórax 2012; 142: 385-393.
- Fielding DIK, Bashirzadeh F, Son JH, et al: Primer uso en humanos de un nuevo sistema de navegación con sensores de fibra óptica asistido por robot para pequeños nódulos pulmonares periféricos. Respiración 2019; 98: 142-150.
- Silvestri GA, Gonzalez AV, Jantz MA, et al: Methods for staging non-small cell lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Tórax 2013; 143: e211S-250S.
- Rusch VW, Asamura H, Watanabe H, et al: The IASLC lung cancer staging project: a proposal for a new international lymph node map in the forthcoming seventh edition of the TNM classification for lung cancer. J Thorac Oncol 2009; 4: 568-577.
- Tournoy KG, Annema JT, Krasnik M, et al:. Ecografía endoscópica y endobronquial según la definición de mapa de ganglios linfáticos propuesta en la séptima edición de la clasificación de tumores, ganglios y metástasis para el cáncer de pulmón. J Thorac Oncol 2009; 4: 1576-1584.
- Vilmann P, Clementsen PF, Colella S, et al: Endosonografía endobronquial y esofágica combinada para el diagnóstico y la estadificación del cáncer de pulmón: Directriz de la Sociedad Europea de Endoscopia Gastrointestinal (ESGE), en colaboración con la Sociedad Respiratoria Europea (ERS) y la Sociedad Europea de Cirujanos Torácicos (ESTS). Endoscopia 2015; 47: c1.
- Crombag LM, Annema JT: Análisis de la glándula suprarrenal izquierda en pacientes con cáncer de pulmón utilizando el ecógrafo endobronquial: un ensayo de viabilidad. Respiración 2016; 91: 235-240.
- Konge L, Vilmann P, Clementsen P, et al: Evaluación fiable y válida de la competencia en ultrasonografía endoscópica y aspiración con aguja fina para la estadificación mediastínica del cáncer de pulmón de células no pequeñas. Endoscopia 2012; 44: 928-933.
- DOI http://dx.doi.org/10.1055/s-0034-1392040 Publicado en línea: 0.0. Endoscopia 2015; 47: 545-559 © Georg Thieme Verlag KG Stuttgart – Nueva York ISSN 0013-726X
InFo NEUMOLOGÍA Y ALERGOLOGÍA 2019; 1(3): 6-11.