El espectro de agentes sistémicos aprobados para el tratamiento de la dermatitis atópica de moderada a grave se ha ampliado en los últimos tiempos, de modo que ahora se puede elegir entre varios productos biológicos e inhibidores de la quinasa Janus. El alivio del picor es un objetivo clave del tratamiento para los afectados: ¿qué se sabe sobre el efecto antipruriginoso de los nuevos tratamientos sistémicos? Esta cuestión se discute en una minirrevista publicada recientemente en el Journal of the Dermatological Society.
La primera autora de la publicación es la doctora Hanna Bonnekoh, de la Clínica de Dermatología, Venereología y Alergología de la Charité Universitätsmedizin de Berlín [1]. La importancia del conocimiento de los efectos de los nuevos fármacos sobre la mejora del prurito queda demostrada, entre otras cosas, por una encuesta publicada recientemente entre 1104 pacientes con dermatitis atópica: el prurito fue considerado muy importante para evaluar la eficacia de un tratamiento por el 95,4% de los pacientes [2]. En los ensayos clínicos sobre dermatitis atópica, los parámetros del picor suelen notificarse utilizando criterios de valoración estandarizados, lo que permite comparar las sustancias activas en función de sus efectos sobre el picor.
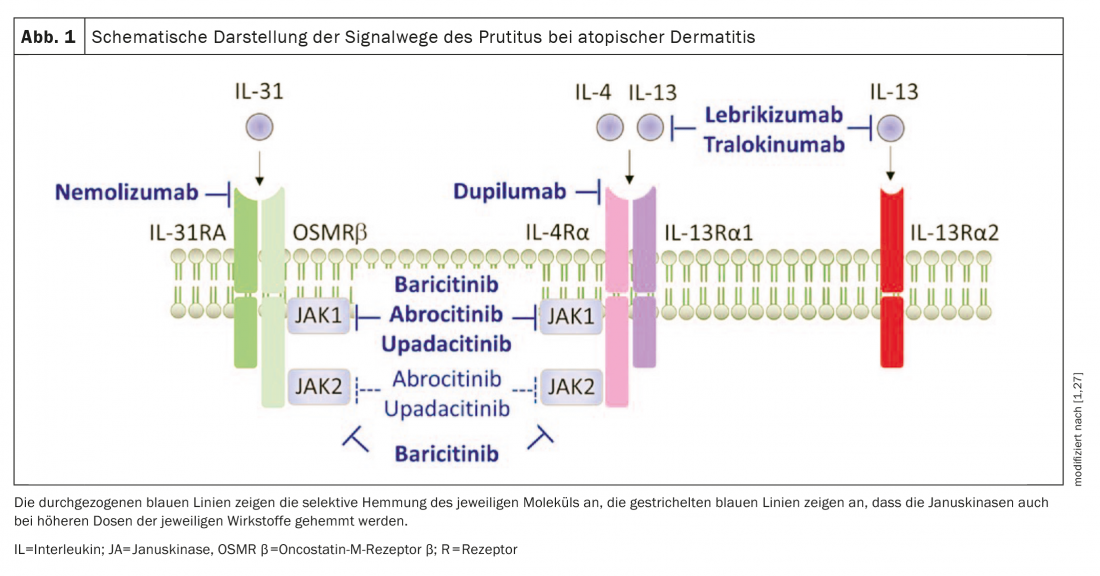
En general, todos los estudios incluidos en la revisión de Bonnekoh et al. 2022 nuevos fármacos para la dermatitis atópica (Fig. 1) han mostrado datos prometedores en la mejora del picor.
¿Cuál es el estado actual de los conocimientos?
El sufrimiento de los afectados es elevado; entre otras cosas, muchos se quejan de trastornos del sueño relacionados con el picor [11–13]. Además de un rápido inicio de acción, la reducción general del picor durante todo el periodo de tratamiento también es de gran importancia para los pacientes con neurodermatitis, como demostraron Bonnekoh et al. enfatizar [1]. A continuación se resumen las terapias sistémicas modernas aprobadas actualmente por la EMA y Swissmedic para el tratamiento de la dermatitis atópica de moderada a grave.

Dupilumab: El anticuerpo monoclonal de inmunoglobulina (Ig)-G4κ totalmente humano Dupilumab (Dupixent®), inhibe la señalización de IL-4 e IL-13 mediante la inhibición de IL-4Rα. Un análisis reciente de cuatro ensayos clínicos aleatorizados de fase III analizó los efectos del dupilumab sobre el prurito en pacientes con dermatitis atópica de moderada a grave. Esto demostró que el tratamiento con dupilumab produjo una mejora rápida y estadísticamente significativa del picor diario más intenso (cambio porcentual en la escala de valoración numérica, NRS) en comparación con el placebo, ya en el día 2 en adultos y en el día 5 en pacientes adolescentes. Además, se observó una rápida mejoría (definida como la proporción de pacientes con una mejoría de al menos 3 puntos con respecto al valor inicial) del picor a partir del día 4 en adultos y a partir del día 13 en adolescentes. Además, en el transcurso de los respectivos estudios, la intensidad del picor se redujo significativamente en todos ellos en comparación con el placebo y mostró una disminución progresiva con el tiempo [3].
Tralokinumab: El anticuerpo monoclonal IgG4λ humano recombinante anti-IL-13 tralokinumab (Adtralza®) impide que la IL-13 se una a la IL-13Rα1 y a la IL-13Rα2 y ha sido aprobado recientemente en Suiza para adultos con dermatitis atópica de moderada a grave [34]. Los resultados de los ensayos de fase III de tralokinumab como monoterapia (ECZETRA1 y 2) y en combinación con el tratamiento tópico con corticosteroides (ECZETRA 3) en pacientes con dermatitis atópica de moderada a grave fueron muy convincentes. En la semana 16, una mayor proporción de pacientes tratados con tralokinumab logró una reducción de la media semanal del peor prurito diario (NRS ≥4) en comparación con el valor basal en la comparación con placebo. Además, el tratamiento con tralokinumab mostró mayores cambios desde el inicio en la peor NRS diaria de prurito en comparación con el grupo placebo, con una diferencia significativa desde la semana 1 de tratamiento [4,5].
Baricitinib: El inhibidor oral de JAK baricitinib (Olumiant®) tiene una especificidad igualmente alta para JAK-1 y -2 y menor para Tyk-2 [21,34]. En combinación con tópicos
corticosteroides (TCS), se consiguió una reducción significativa del picor (NRS media en comparación con el valor inicial) ya en el día 2 con el tratamiento diario con 2 mg o 4 mg de baricitinib. En la semana 16, una proporción significativamente mayor de pacientes del brazo de tratamiento (44% en el grupo de 4 mg, 38% en el grupo de 2 mg) mostraron una mejoría clínicamente significativa del picor (definida como un cambio respecto al valor inicial NRS ≥4) en comparación con el grupo placebo (20%) [6,7].
Upadacitinib: El upadacitinib (Rinvoq®), otro fármaco de molécula pequeña, es un inhibidor oral de la JAK-1 [8,9,34]. La monoterapia con 15 mg o 30 mg (1×/día cada una) produjo una mejora significativa del picor en la semana 16 en comparación con el placebo, así como una reducción significativa del prurito en comparación con el valor inicial (NRS ≥4) [10]. El upadacitinib también resultó convincente cuando se combinó con TCS en un estudio de fase III.
|
La patogénesis del prurito sigue siendo un misterio Hasta la fecha, no se ha dilucidado por completo el mecanismo subyacente exacto del prurito en la dermatitis atópica (DA). Pruebas recientes sugieren que los pruritógenos independientes de la histamina están implicados en el desarrollo del picor crónico [28,29]. Además de la interleucina-31 -una citocina producida predominantemente por las células Th2 que causa prurito a través de un complejo receptor expresado en las fibras C-, la IL-13 y la IL-4 son citocinas específicas de Th2 que se cree que están implicadas en la patogénesis de la EA y en la sintomatología del prurito. Otros pruritógenos asociados al picor en la EA son la histamina, la triptasa, la IL-33 y la linfopoyetina del estroma tímico (TSLP), pero su relevancia clínica en el desencadenamiento del picor en la EA sigue sin estar clara [30]. |
Hay más sustancias activas en proyecto
Bonnekoh et al. 2022 también abordan los agentes sistémicos que aún estaban en desarrollo en el momento de su revisión. Además del ahora aprobado inhibidor de JAK abrocitinib, los anticuerpos monoclonales lebrikizumab y nemolizumab están descritos en cuanto a sus efectos sobre las características del prurito [1,34]. Los autores señalan que su revisión no analiza enfoques terapéuticos tópicos novedosos como el inhibidor de la tirosina quinasa 2 (TYK2) brepocitinib o el agente modulador de los receptores de aril hidrocarburos tapinarof [25,26].
Aún no es la última palabra en sabiduría
El circuito picor-rascado es el final de una cascada de complejas interacciones entre los factores ambientales y de exposición [14,32,33], el microbioma cutáneo [15–19], la barrera epidérmica [20,21], y las respuestas inmunitarias e inflamatorias [31]. Estos procesos se desarrollan sobre un trasfondo genético particular y epigenético aún poco investigado [22]. Aún no se ha aclarado si son directamente los factores asociados a la inflamación los que contribuyen al patomecanismo y a la gravedad del prurito o si intervienen otros factores. Aunque se ha observado que el prurito en la dermatitis atópica moderada y grave está estrechamente relacionado con la gravedad de la dermatitis atópica, muchos pacientes con dermatitis atópica refieren un prurito que no se limita a la piel lesional y algunos pacientes con dermatitis atópica leve sufren un prurito grave [11,23,24].
Literatura:
- Bonnekoh H, Butze M, Metz M: JDDG 2022; 20(2): 150-156.
- Kobyletzki LB, et al: Acta Derm Venereol 2017; 97(1): 86-90
- Silverberg JI, et al: J Am Acad Dermatol 2020; 82(6): 1328-1336.
- Wollenberg A, et al: Br J Dermatol 2021; 184(3): 437-449.
- Silverberg JI, et al: Br J Dermatol 2021; 184(3): 450-463.
- Simpson EL, et al: Br J Dermatol 2020; 183(2): 242-255.
- Reich K, et al: JAMA Dermatol 2020; 156(12): 1333-1343.
- Guttman-Yassky E, et al: Lancet 2021; 397(10290): 2151-2168.
- Reich K, et al: Lancet 2021; 397(10290): 2169-2181.
- Bieber T: Nature Reviews Drug Discovery 2022; 21(1): 21-40.
- Huet F, et al: Acta Derm Venereol 2019; 99(3): 279-283.
- Kage P, Simon JC, Treudler R: J Dtsch Dermatol Ges 2020; 18(2): 93-102.
- Stand S: N Engl J Med 2021; 384(12): 1136-1143.
- Mack MR, Kim BS:Trends Immunol 2018; 39: 980-991.
- Byrd AL, Belkaid Y, Segre JA: Nature Reviews Drug Discovery 2018; 16: 143-155.
- Meisel JS, et al: Microbioma 2018; 6: 20.
- Kong HH, et al: Genome Res 2012; 22: 850-859.
- Shi B, et al: J. Allergy Clin Immuno 2016; 138: 1233-1236.
- Williams MR, et al: Sci. Transl Med 2019;11:eaat8329.
- Kim BE, Leung DY: Allergy Asthma Immunol Res 2012; 4: 12-16.
- Rerknimitr P, et al: Inflamación y Regeneración 2017; 37: 14.
- Marenholz I, et al: Nature Communications 2015; 6: 8804.
- Hawro T, et al: J Am Acad Dermatol 2021; 84(3): 691-700.
- Chovatiya R, et al: Ann Allergy Asthma Immunol 2021; 127(1): 83-90e2.
- Jo CE, Gooderham M, Beecker J: Int J Dermatol 2022; 61(2): 139-147.
- Paller AS, et al: J Am Acad Dermatol 2021; 84(3): 632-638.
- Med ChemExpress, www.medchemexpress.com/lab-consumables-gift.html (último acceso 27.05.2022)
- Dillon SR, et al: Nature Immunology 2004; 5(7): 752-760.
- Zheng T, et al: J Invest Dermatol 2009; 129(3): 742-751
- Langan SM, Irvine AD, Weidinger S: Lancet 2020; 396(10247): 345-360.
- Weidinger S, et al: Dermatitis atópica. Nature Reviews Disease Primers 2018; 4: 1.
- Gilles S, et al: Dermatología experimental 2018; 27: 1193-1200.
- Stefanovic N, Flohr C, Irvine AD: Alergia 2020; 75: 63-74.
- Información sobre medicamentos, www.swissmedicinfo.ch, (último acceso 12.06.2022)
PRÁCTICA DERMATOLÓGICA 2022; 32(3): 22-23