En el congreso de la DGHO celebrado en Viena se abordaron diversos aspectos de la práctica clínica en el cáncer de pulmón no microcítico (CPNM), el cáncer de células renales (CCR) y la leucemia mieloide crónica. En particular, se debatió la situación actual de la investigación sobre los nuevos inhibidores de la tirosina quinasa crizotinib, sunitinib y bosutinib.
El cáncer de pulmón no microcítico (CPNM) suele cursar de forma asintomática durante un largo periodo de tiempo. Más de la mitad de los pacientes se encuentran ya en una fase avanzada cuando se les diagnostica por primera vez.
“El tratamiento farmacológico del CPNM metastásico no es actualmente muy eficaz, los citostáticos clásicos se han agotado. El tiempo de supervivencia en los estudios actuales sin biológicos es de 10-12 meses”, afirma el profesor Norbert Frickhofen, de Wiesbaden (Alemania). “Sin embargo, la genética se conoce bien. El ALK translocado es un potente oncogén y un factor clave en la carcinogénesis en una proporción de pacientes con CPNM. Suele producirse con el socio de fusión EML4, pero también hay socios más raros como KIF5B y TFG. En el CPNM con un gen de fusión ALK, la inhibición dirigida es, por tanto, una buena opción terapéutica, ya que la fusión descrita provoca la activación constitutiva de la quinasa ALK.”

El crizotinib provoca una inhibición de este tipo de la tirosina quinasa ALK. Es una aminopiridina oral que también bloquea MET y ROS1. Está aprobado en Suiza como Xalkori®. La FDA lo autorizó en 2011 para el CPNM localmente avanzado o metastásico ALK-positivo (evaluado mediante una prueba aprobada por la FDA). La EMA lo aprobó en 2012 como terapia para el CPNM localmente avanzado o metastásico ALK-positivo pretratado.
Un estudio de fase III con el criterio principal de valoración de la supervivencia sin progresión (RECIST 1.1, evaluación radiológica independiente) investigó la eficacia tras la preterapia (Fig. 1) [1]. Concluye que el crizotinib es superior a la quimioterapia estándar en pacientes con CPNM ALK-positivo previamente tratados. La mediana de supervivencia libre de progresión fue de 7,7 meses en el grupo de crizotinib (n=173) y de tres meses en el grupo de quimioterapia (n=174), los resultados son estadísticamente significativos (p<0,001). Las tasas de respuesta también fueron significativamente superiores con crizotinib (65 frente a 20%, p<0,001) y la mediana de tiempo hasta la respuesta fue más rápida (6,3 frente a 12,6 semanas). Sin embargo, un análisis provisional no mostró ninguna mejora significativa en la supervivencia global. Los efectos secundarios más frecuentes fueron alteraciones visuales, efectos secundarios gastrointestinales y aumento de los niveles de aminotransferasa hepática. En general, los pacientes que tomaron crizotinib frente a quimioterapia notaron una mayor reducción de los síntomas del cáncer de pulmón y una mayor mejora de la calidad de vida en general.
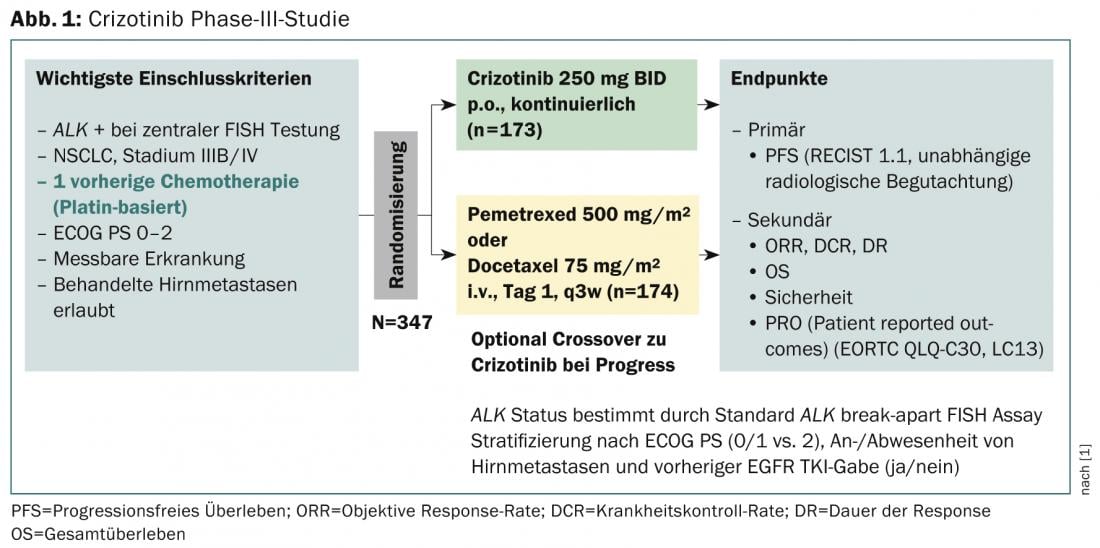
Crizotinib en la práctica
En la práctica, la pregunta es: ¿quién debe someterse a las pruebas de ALK? “La respuesta es: todos los pacientes para los que la inhibición de ALK sea una opción terapéutica. El diagnóstico de ALK se realiza mediante cribado IHC y cribado FISH. En cuanto a los efectos secundarios, las alteraciones visuales como los trazos en el campo visual periférico con luz límite, los objetos que se atascan, los destellos de luz sin referencia o las inversiones de contraste son funcionales y no críticas. El efecto secundario más crítico es la hepatotoxicidad, que alcanza el grado 3/4 en el 16%, y que puede provocar la muerte, por lo que debe controlarse cuidadosamente y abordarse con rapidez. Si se produce un aumento de la alanina aminotransferasa (ALT) o de la aspartato aminotransferasa (AST) de grado 3 ó 4 y de la bilirrubina total ≤grado 1, se recomienda suspender el tratamiento hasta que se recupere a ≤grado 1 o al valor basal, y reiniciar entonces con 2×200 mg/día. Si la bilirrubina total también se eleva a los grados 2, 3 ó 4 (en ausencia de colestasis o hemólisis), es necesario interrumpir el tratamiento”, afirma el Prof. Frickhofen. “En general, la terapia específica con crizotinib es eficaz y tolerable en el CPNM ALK-positivo”.
Opciones para el CCRm
“Hay que agotar al máximo las posibilidades de una terapia para el carcinoma de células renales metastásico. En términos concretos, esto significa un tratamiento constante con una sustancia durante el mayor tiempo posible y lograr la mejor remisión posible. Además, la segunda línea debe considerarse ya en la terapia de primera línea. Hay que optimizar la gestión de los efectos secundarios y promover la educación y la implicación del paciente y de los coterapeutas (médicos de cabecera)”, afirma el PD Dr. med. Jochen Casper, de Oldenburg.
Para la primera línea, pueden considerarse el sunitinib, el bevacizumab más IFN y el pazopanib si hay histología de células claras y un pronóstico bueno/intermedio. Aunque no se trata de un estudio comparativo frente a frente, el Dr. Casper demostró que los tres factores de supervivencia sin progresión y global, así como la respuesta, tienden a ser mejores con el sunitinib (Sutent®) que con las demás opciones de tratamiento, basándose en varios ensayos aleatorizados de fase III en entornos de riesgo bajo e intermedio. Un análisis retrospectivo [2] del sunitinib también concluye que la respuesta se correlaciona con la supervivencia global. Fue significativamente mayor en los respondedores, con una supervivencia global larga incluso en los respondedores tardíos.
“No sólo la reducción tumoral está relacionada con la supervivencia global tanto en primera como en segunda línea, sino que la respuesta y el grado de ésta también son relevantes en este sentido. Por lo que se ha estudiado, este efecto es independiente de la terapia utilizada (inhibidor de la tirosina quinasa [TKI], mTOR, citoquina). La inclusión de la terapia de primera línea o la secuencia correcta en la elección del tratamiento de segunda línea pueden tener un impacto significativo en la supervivencia global. Se necesitan más estudios en este ámbito. Pero el objetivo debe ser siempre la supervivencia global, y ésta ha mejorado significativamente desde la introducción de los TKI”, concluye el Dr. Casper.
Optimizar la terapia TKI también en la LMC
PD Dr. med. Philipp le Coutre, Berlín, habló sobre la leucemia mieloide crónica (LMC). Un nuevo inhibidor de la tirosina quinasa aprobado por la FDA en 2012 para el tratamiento de la LMC se llama bosutinib. Se utiliza en pacientes en los que otros TKI no funcionan o se toleran mal. En Europa, el principio activo fue aprobado condicionalmente por la Comisión Europea en 2013 como medicamento para el tratamiento de una enfermedad huérfana (aún no aprobado en Suiza).
“Esta nueva opción terapéutica podría ofrecer una alternativa potencial en casos de respuesta y resistencia inadecuadas, comorbilidades o factores de riesgo específicos del paciente e intolerancia a terapias anteriores”, concluyó la Dra. le Coutre la presentación.
Fuente: “Evidence and clinical practice in NSCLC, RCC and CML”, simposio satélite de Pfizer Pharma GmbH en el Congreso de la DGHO, 18-22 de octubre de 2013, Viena.
Literatura:
- Shaw AT, et al: Crizotinib frente a quimioterapia en cáncer de pulmón avanzado ALK-positivo. N Engl J Med 2013; 368: 2385-2394.
- Molina AM, et al: Respuesta objetiva al sunitinib en el carcinoma metastásico de células renales: análisis de 1059 pacientes tratados en ensayos clínicos. Eur J Cancer 2013 Sep 16. pii: S0959-8049(13)00789-2. doi: 10.1016/j.ejca.2013.08.021. [Epub ahead of print].
InFo Oncología y Hematología 2014; 2(2): 36-38











