Para ralentizar la progresión de la enfermedad renal crónica, existen medidas específicas y no específicas para la enfermedad. El diagnóstico básico de la insuficiencia renal crónica incluye un estado de la orina y una ecografía de los riñones. Si la enfermedad renal no se corresponde claramente con una nefropatía hipertensiva o diabética, suele ser útil la aclaración de un especialista para procurar un diagnóstico exacto y, en caso necesario, posibilitar una terapia específica. La medida no específica de inhibición de la progresión mejor probada es el tratamiento de los pacientes proteinúricos con inhibidores de la ECA o ARA-II. Otras medidas incluyen un control adecuado de la tensión arterial, el tratamiento de la acidosis si es necesario y la limitación de la ingesta de sal. Los pacientes con enfermedad renal crónica son sensibles a los “segundos golpes”. Por lo tanto, deben evitarse los AINE, los laxantes que contengan fosfatos y los medios de contraste para rayos X que contengan yodo.
La incidencia y prevalencia de la enfermedad renal crónica (ERC) ha aumentado de forma constante en las últimas décadas. Etiológicamente, la ERC puede estar causada por una gran variedad de enfermedades renales. Las más comunes -y también responsables en gran medida del aumento de la prevalencia de la ERC- son la nefropatía diabética y la hipertensiva. Además del riesgo de desarrollar una enfermedad renal terminal, la ERC conlleva un aumento significativo de la morbilidad y la mortalidad cardiovascular [1]. La enfermedad renal crónica representa, por tanto, una carga relevante para el sistema sanitario. La mayoría de los pacientes con ERC son atendidos principalmente por médicos de cabecera. Por lo tanto, es importante que se identifique a tiempo a los pacientes que necesitan una terapia específica y que se conozcan y apliquen medidas no específicas de reducción de la progresión.
Tratamiento específico de la enfermedad
Como ya se ha mencionado, una variedad de enfermedades renales etiológicamente diferentes pueden conducir a la ERC. Existen terapias específicas (por ejemplo, inmunosupresoras) para algunos de ellos. Por lo tanto, para posibilitar una terapia causal, debe aspirarse a un diagnóstico de la enfermedad subyacente. Un buen triaje en la consulta del médico de cabecera es crucial para garantizar que los pacientes con una enfermedad renal específica tratable sean atendidos nefrológicamente. Se aplican las siguientes reglas generales:
- El diagnóstico básico de todo paciente con una alteración relevante de la función renal, que no pueda explicarse prerrenal y sea rápidamente reversible, incluye un análisis de orina y una ecografía de los riñones. La ecografía ayuda a excluir una causa posrenal, puede ser diagnóstica en las nefropatías quísticas y a veces permite sacar conclusiones sobre la cronicidad o la reversibilidad potencial de la nefropatía en función del tamaño del riñón.
- Los pacientes con nefropatía hipertensiva suelen ser mayores, muestran un deterioro de la función renal bastante lento y progresivo, no suelen presentar proteinuria relevante (como mucho una “microalbuminuria”), un sedimento urinario poco visible y, por lo general, una historia de hipertensión de larga duración con otros daños hipertensivos en órganos terminales. Típico de estos pacientes es también un deterioro de la capacidad autorreguladora de los riñones con fluctuaciones pronunciadas de la creatinina sérica en función de la hidratación y la tensión arterial. En pacientes de edad avanzada, a menudo no es necesario un examen especializado.
- La nefropatía diabética se caracteriza típicamente por una albuminuria lentamente progresiva seguida de un descenso más rápido de la tasa de filtración glomerular (TFG) en comparación con la nefropatía hipertensiva. Para entonces, suelen aparecer otras complicaciones microvasculares (retinopatía). Si el curso es atípico, merece la pena buscar causas alternativas.
- En los pacientes que no encajen en una de las categorías anteriores, especialmente los que presenten proteinuria relevante, sedimento urinario anormal o disminución rápida del FG, debe considerarse la posibilidad de aclararlo mediante biopsia renal y suele estar indicada la derivación a nefrología. Podría deberse a una causa específica tratable (por ejemplo, vasculitis ANCA, nefropatía membranosa, nefropatía IgA, etc.).
Factores de progresión inespecíficos y su tratamiento
Una vez que se ha producido un daño renal relevante, una serie de mecanismos de mala adaptación contribuyen a un mayor deterioro de la función renal, independientemente de la enfermedad subyacente (Fig. 1).
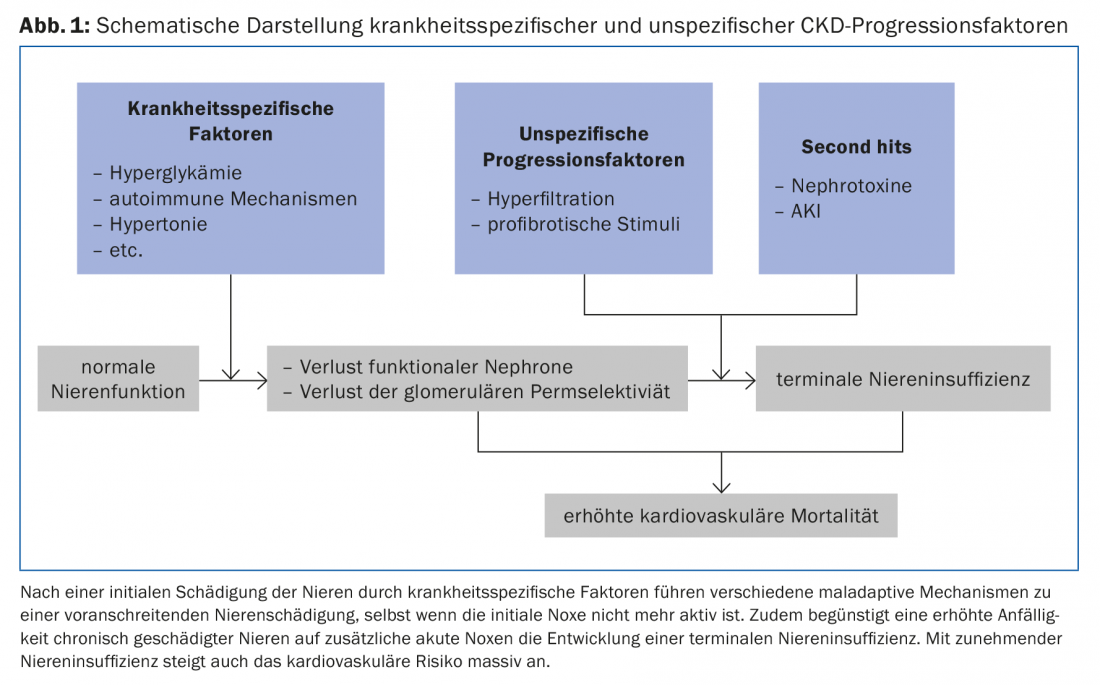
Proteinuria/albuminuria: La proteinuria o albuminuria suele ser el resultado de una alteración de la permeabilidad glomerular (recuadro, tab. 1). Su extensión se correlaciona con la progresión de la insuficiencia renal [2]. Las intervenciones que reducen la proteinuria o la albuminuria también conducen a una ralentización de la progresión de la ERC. Los inhibidores de la ECA y los antagonistas de los receptores de angiotensina (ARA) reducen la presión intraglomerular, la hiperfiltración glomerular y la albuminuria. Su eficacia para reducir la progresión en pacientes con ERC con proteinuria está bien establecida tanto para los diabéticos [3] como para los no diabéticos [4]. La dosis debe aumentarse hasta que la proteinuria se haya reducido al intervalo objetivo (que varía según la enfermedad renal subyacente) o la dosis esté limitada por efectos secundarios inaceptables (por ejemplo, hipotensión/mareo ortostático) o se haya alcanzado la dosis máxima permitida del fármaco. La terapia combinada de inhibidores de la ECA y ARA-II preconizada anteriormente se ha abandonado en gran medida.

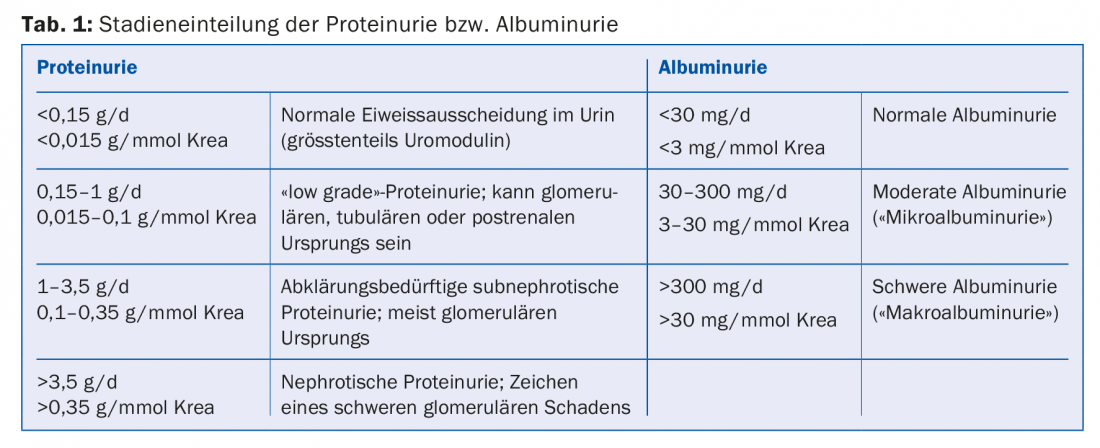
Hipertensión: La hipertensión arterial puede provocar una nefropatía hipertensiva, pero también puede favorecer la progresión de otras enfermedades renales, por lo que debe tratarse adecuadamente. Para la nefroprotección, los valores objetivo habituales de <140/90 mmHg parecen suficientes en pacientes sin albuminuria patológicamente aumentada, y los inhibidores de la ECA o los ARA no son claramente superiores a otros fármacos. En pacientes con albuminuria grave y probablemente también en pacientes con albuminuria moderada, es razonable aspirar a valores de <130/80 mmHg. En este caso, debe dosificarse primero un inhibidor de la ECA o un ARA, y sólo después añadir otros antihipertensivos si es necesario [5]. En la mayoría de los pacientes con una función renal significativamente deteriorada, sólo puede lograrse un control adecuado de la presión arterial con la adición de un diurético de asa. Debe mencionarse que los valores objetivo mencionados se aplican con respecto a la nefroprotección y el reciente estudio SPRINT ha demostrado un posible beneficio de valores objetivo más bajos sobre la mortalidad por todas las causas [6].
Acidosis metabólica y su corrección: Con el aumento de la insuficiencia renal, la capacidad de excreción de ácido de los riñones disminuye y con el tiempo se desarrolla una acidosis metabólica, que tiene efectos negativos sobre el metabolismo óseo y la musculatura, entre otros. Sin embargo, más allá de estos efectos extrarrenales, la exposición a los ácidos también parece dañar los propios riñones [7]. Se sabe por estudios observacionales que el bicarbonato sérico se correlaciona inversamente con la progresión en pacientes con ERC. En caso de acidosis renal, la terapia puede dirigirse a reducir la ingesta de ácido a través de la alimentación (especialmente proteínas animales) o a neutralizar la ingesta de ácido mediante terapia oral con bicarbonato sódico. Algunos pequeños ensayos aleatorizados han demostrado un impresionante efecto reductor de la progresión de esta intervención sencilla y rentable [6], pero aún están pendientes los resultados de ensayos más amplios. Las desventajas de la terapia con bicarbonato son la elevada “carga de pastillas” (suelen ser necesarias de 3 a 6 cápsulas à 500 mg de NaBic para un efecto suficiente) y la ingesta de sodio asociada a la misma.
Intervenciones sobre nutrición y estilo de vida: Aunque no se ha demostrado formalmente en estudios controlados una influencia positiva de la actividad física y el objetivo de un peso corporal “saludable” (IMC 20-25) en la progresión de la insuficiencia renal, estas intervenciones son capaces de influir favorablemente en diversos factores de riesgo cardiovascular, así como en la proteinuria.
Hace tiempo que se promueve una dieta baja en proteínas como medida para reducir la hiperfiltración glomerular. Sin embargo, los datos sobre la eficacia de la restricción proteica en la ERC no están del todo claros, y los estudios existentes son anteriores al uso generalizado de los inhibidores de la ECA y los ARA. Además, una restricción proteínica severa puede conducir a la malnutrición, que es muy desfavorable en términos de pronóstico si se requiere diálisis en una fase posterior. Por lo tanto, hoy en día ya no se recomienda una restricción proteica severa, pero debe evitarse una ingesta excesiva de proteínas (por ejemplo, en forma de suplementos proteicos para el entrenamiento con pesas) en pacientes con ERC.
El consumo elevado de sal se ha asociado en estudios epidemiológicos con un aumento de la presión arterial, un incremento de la proteinuria y una disminución más rápida de la TFG en pacientes renales [8]. Además, la ingesta elevada de sal reduce en gran medida los efectos antiproteinúricos y de pronóstico positivo de los inhibidores de la ECA y los ARA [9]. Se recomienda restringir la ingesta de sal a 5-6 g NaCl/día para la mayoría de los pacientes con insuficiencia renal crónica. En la actualidad no está claro si una mayor restricción es útil o incluso desfavorable en determinados pacientes.
El tabaquismo se ha asociado en varios estudios de población no sólo con acontecimientos cardiovasculares, sino también con la albuminuria y la insuficiencia renal [10]. También se han realizado pocos estudios de intervención sobre la influencia del abandono de la nicotina en la evolución de la ERC, pero todos ellos fueron positivos.
Enfoques terapéuticos con efecto incierto o no demostrado: Numerosos estudios epidemiológicos muestran una conexión entre la hiperuricemia y la insuficiencia renal, así como el riesgo cardiovascular, aunque la causalidad aún no se ha aclarado del todo [11]. Pequeños estudios individuales han demostrado un efecto favorable de la terapia uricostática con alopurinol en la evolución de la insuficiencia renal crónica. Sin embargo, dado que el alopurinol no está exento de riesgos en cuanto a efectos secundarios, especialmente en caso de deterioro de la función renal, se necesitan estudios más amplios para recomendar en principio el uso de alopurinol en pacientes con ERC sin gota y, si es necesario, definir niveles objetivo de ácido úrico sensatos. El febuxostat, que no se elimina por vía renal y tiene menos efectos secundarios, podría desempeñar un papel en este sentido en el futuro. La hiperlipidemia se consideró un posible factor de progresión de la ERC basándose en consideraciones fisiopatológicas y en datos epidemiológicos. Sin embargo, una evaluación del estudio SHARP (el mayor estudio de reducción de lípidos en pacientes con ERC) no logró demostrar un efecto positivo de la simvastatina y la ezetimiba en la progresión de la ERC [12]. Así pues, las estatinas no parecen tener un efecto relevante en la progresión de la ERC, pero son útiles para reducir el riesgo cardiovascular en muchos pacientes con ERC. Los análogos activos de la vitamina D parecen tener un efecto positivo sobre la proteinuria, pero queda por demostrar un efecto sobre la progresión de la insuficiencia renal [13].
“Segundos golpes y su prevención: Los riñones predañados son mucho más sensibles a las noxas agudas que los sanos. Esto significa que los pacientes con insuficiencia renal crónica tienen un riesgo masivamente mayor de sufrir una lesión renal aguda (LRA) [5], que a menudo se recupera de forma incompleta [14].
Los antiinflamatorios no esteroideos (AINE) se encuentran entre los medicamentos más recetados en todo el mundo. En pacientes con insuficiencia cardiaca grave o deterioro de la función renal, la inhibición de la síntesis intrarrenal de prostaglandinas puede provocar una reducción crítica de la perfusión glomerular y desencadenar una IRA [15]. Por lo tanto, los AINE están contraindicados en pacientes con una función renal gravemente deteriorada y sólo deben utilizarse con moderación y a corto plazo en pacientes con una función renal ligeramente reducida [5].
Los medios de contraste para rayos X que contienen yodo pueden provocar lesiones renales agudas en caso de deterioro preexistente de la función renal, deshidratación e insuficiencia cardiaca descompensada. Las medidas más importantes para la profilaxis de la nefropatía por contraste en pacientes con ERC son: (a) Cuestionarse críticamente la indicación y la consecuencia terapéutica de un examen, (b) Considere métodos de examen alternativos en función del problema (por ejemplo, ecografía, gammagrafía), (c) si es inevitable realizar un examen con medio de contraste radiográfico: prehidratarse, minimizar la cantidad de medio de contraste aplicado y elegir un medio de contraste radiográfico isoosmolar [5,16].
Los laxantes que contienen fosfato se utilizan ocasionalmente en la preparación de la colonoscopia como alternativa a los laxantes que contienen polietilenglicol. Una cantidad considerable de fosfato se absorbe a través del intestino. Con una función renal normal, esta carga de fosfato puede excretarse con relativa rapidez a través de los riñones. Sin embargo, con una función renal deteriorada, se alcanzan niveles extremadamente altos de fosfato en la sangre y la consecuente concentración muy elevada de fosfato en la orina primaria puede provocar una nefropatía aguda por cristales de fosfato cálcico [17]. Por lo tanto, los laxantes que contienen fosfatos están contraindicados con un FG <60 ml/min/1,73m2 ; otros factores de riesgo de nefropatía aguda por cristales de fosfato son la depleción de volumen, los diuréticos, los inhibidores de la ECA y la edad [17].
Literatura:
- Matsushita K, et al: Association of estimated glomerular filtration rate and albuminuria with all-cause and cardiovascular mortality in general population cohorts: a collaborative metaanalysis. Lancet 2010; 375: 2073-2081.
- Gansevoort RT, et al.: Consorcio para el pronóstico de la enfermedad renal crónica. Un FG estimado más bajo y una mayor albuminuria se asocian a resultados renales adversos. Un metaanálisis colaborativo de cohortes de población general y de alto riesgo. Kidney Int. 2011;80(1): 93-104.
- Kistler AD: Albuminuria en diabéticos: gestión práctica. Práctica (Berna 1994). 2013;102(20): 1229-35.
- Jafar TH, et al.: Inhibidores de la enzima convertidora de angiotensina y progresión de la enfermedad renal no diabética. Un metaanálisis de datos a nivel de paciente. Ann Intern Med. 2001; 135(2): 73-87.
- Guía de práctica clínica KDIGO 2012 para la evaluación y el tratamiento de la enfermedad renal crónica. Kidney Int Suppl 2013;3(1). (www.kdigo.org/home/guidelines)
- Grupo de investigación SPRINT, Wright JT Jr, et al: A Randomized Trial of Intensive versus Standard Blood-Pressure Control. N Engl J Med. 2015 Nov 26;373(22): 2103-16
- Kovesdy CP: Acidosis metabólica y enfermedad renal: ¿el tratamiento con bicarbonato ralentiza la progresión de la ERC? Nephrol Dial Transplant. 2012;27(8): 3056-62.
- Meier P, et al: Sal e insuficiencia renal. Foro Med Suiza 2014;14(04): 50-53
- Lambers Heerspink HJ, et al: La moderación del sodio dietético potencia los efectos protectores renales y cardiovasculares de los bloqueantes de los receptores de angiotensina. Kidney Int. 2012;82(3): 330-7.
- Orth SR, et al: Fumar: un factor de riesgo para la progresión de la enfermedad renal crónica y para la morbilidad y mortalidad cardiovascular en pacientes renales–¿ausencia de pruebas o pruebas de ausencia? Clin J Am Soc Nephrol. 2008;3(1): 226-36.
- Jalal DI, et al: El ácido úrico como diana terapéutica en la ERC. Am J Kidney Dis. 2013;61(1): 134-46.
- Haynes R, et al. para el Grupo de Colaboración SHARP: Efectos de la reducción del colesterol LDL en la progresión de la enfermedad renal. J Am Soc Nephrol. 2014;25(8): 1825-33.
- de Borst MH, et al: Tratamiento activo con vitamina D para la reducción de la proteinuria residual: una revisión sistemática. J Am Soc Nephrol. 2013;24(11): 1863-71.
- Chawla LS, et. al.: La lesión renal aguda y la enfermedad renal crónica como síndromes interconectados. N Engl J Med. 2014;371(1): 58-66.
- Harirforoosh S, et al: Efectos renales adversos de los antiinflamatorios no esteroideos. Expert Opin Drug Saf. 2009;8(6): 669-81.
- Guía de práctica clínica KDIGO 2012 para la lesión renal aguda. Kidney Int Suppl 2012;2(1). (www.kdigo.org/home/guidelines)
- Markowitz GS, et. al: Hacia la incidencia de la nefropatía aguda por fosfatos. J Am Soc Nephrol. 2007;18(12): 3020-2.
PRÁCTICA GP 2016; 11(12): 35-38