Un estudio reciente investigó la concordancia entre la variabilidad de la frecuencia cardiaca derivada de la señal fotopletismográfica de un smartwatch comercial y la variabilidad de la frecuencia cardiaca derivada del electrocardiograma de alta resolución (patrón oro) en pacientes con enfermedades cardiovasculares.
La variabilidad de la frecuencia cardiaca (VFC) refleja la variación de los intervalos entre latidos y es una herramienta no invasiva de probada eficacia para evaluar el estado funcional del sistema nervioso autónomo cardiaco [2]. La disfunción del sistema nervioso autónomo, a menudo caracterizada por la hiperactividad del sistema nervioso simpático y el repliegue vagal, desempeña un papel clave en la patogénesis de diversas enfermedades cardio y cerebrovasculares y, por tanto, se asocia a un peor pronóstico [3,4]. En consecuencia, las mediciones de la VFC se han propuesto para la predicción del riesgo en pacientes con enfermedades cardiovasculares, incluidos el infarto de miocardio, la insuficiencia cardiaca crónica, la diabetes mellitus, el ictus isquémico y otras [5–8].
Partiendo de las mediciones estándar tradicionales de la VFC en el dominio del tiempo y la frecuencia, se han desarrollado una serie de mediciones no estándar [9] que incluyen, entre otras, marcadores de complejidad de tiempo corto [10], entropía [11] así como el análisis del diagrama de Poincare [12], capacidad de desaceleración (CC) [13] y turbulencia de la frecuencia cardiaca [14]. Aunque algunas de estas medidas han mostrado resultados prometedores como predictores de riesgo en grandes ensayos clínicos, la VFC apenas se ha utilizado en la práctica clínica.
Incluso una grabación de 5 minutos del electrocardiograma (ECG) permite analizar la VFC [2]. Sin embargo, a efectos de predicción del riesgo, el análisis de la VFC suele realizarse con registros de ECG más largos, especialmente cuando se evalúan parámetros de VFC que captan los componentes de baja frecuencia de la VFC. Esto puede limitar la aplicabilidad de la VFC en la vida diaria, especialmente si la VFC se va a utilizar como herramienta de monitorización continua en un entorno ambulatorio. Con ciertas limitaciones, la VFC también puede calcularse a partir de registros fotopletismográficos (PPG) de las ondas de pulso [15]. Por lo tanto, la creciente prevalencia de wearables con sensores de PPG integrados en la población podría hacer del análisis de la VFC basado en la PPG con dispositivos inteligentes disponibles en el mercado un enfoque prometedor en el futuro. Dos pequeños estudios en poblaciones sanas ya han demostrado la viabilidad general de los marcadores de VFC basados en smartwatches [16,17]. Sin embargo, se desconoce la precisión de la VFC basada en PPG derivada de un smartwatch en poblaciones más amplias con enfermedades cardio o cerebrovasculares que podrían beneficiarse de una monitorización continua del riesgo.
Por lo tanto, el objetivo de un estudio reciente era determinar la precisión de los marcadores de VFC estándar y no estándar calculados a partir de los registros de PPG de un smartwatch disponible en el mercado en comparación con las métricas de VFC derivadas del ECG en un número relevante de pacientes con enfermedades cardiovasculares y cerebrovasculares [1].
Diseño del estudio y participantes
El estudio incluyó tres cohortes diferentes que acudieron a una consulta externa de cardiología entre junio de 2021 y julio de 2022: Pacientes tras un infarto de miocardio con elevación del segmento ST (cohorte IAMCEST), pacientes tras un ictus isquémico (cohorte IAMCEST) y pacientes sin enfermedad cardiovascular estructural conocida (cohorte CONTROL).
Los criterios de inclusión para la cohorte de IAMCEST fueron pacientes con un primer IAMCEST tratados con una intervención coronaria percutánea primaria en las 24 horas siguientes al inicio de los síntomas. Los criterios de inclusión para la cohorte STROKE fueron pacientes con ictus isquémico agudo confirmado por tomografía computarizada o resonancia magnética con inicio de los síntomas en los 30 días anteriores al ingreso hospitalario. La cohorte CONTROL incluyó a pacientes sin antecedentes conocidos de enfermedad cardiovascular estructural manifiesta. Los criterios generales de inclusión incluían una edad ≥18 años y la presencia de ritmo sinusal. Se excluyó a los pacientes con latidos ventriculares prematuros frecuentes (>10% del total de latidos) o de mala calidad.
Grabaciones y procesamiento de señales
El ECG y el PPG se registraron simultáneamente durante 30 minutos en todos los sujetos. Los registros se realizaron en condiciones estandarizadas en posición supina y con respiración espontánea. Los estímulos externos (ruido, etc.) se redujeron al mínimo y se instruyó a los pacientes para que se relajaran.
De los 282 sujetos que disponían de registros simultáneos de ECG y PPG, 263 cumplían los criterios de inclusión y se inscribieron en el estudio. De ellos, 104 sufrieron un IAMCEST, 129 un ictus y 30 pertenecían a la cohorte CONTROL. La edad media de la cohorte total era de 61 años y 71 (27%) eran mujeres. La mediana del tiempo de grabación fue de 32,1 minutos. En las cohortes IAMCEST y IAMCEST, los registros se realizaron tres y cinco días después de los acontecimientos índice, respectivamente. Las medidas de la VFC fueron significativamente inferiores en las cohortes IAMEST y IAMCEST en comparación con la cohorte CONTROL (p <0,05 para todas excepto DF-α2).
Evaluación de la variabilidad de la frecuencia cardiaca
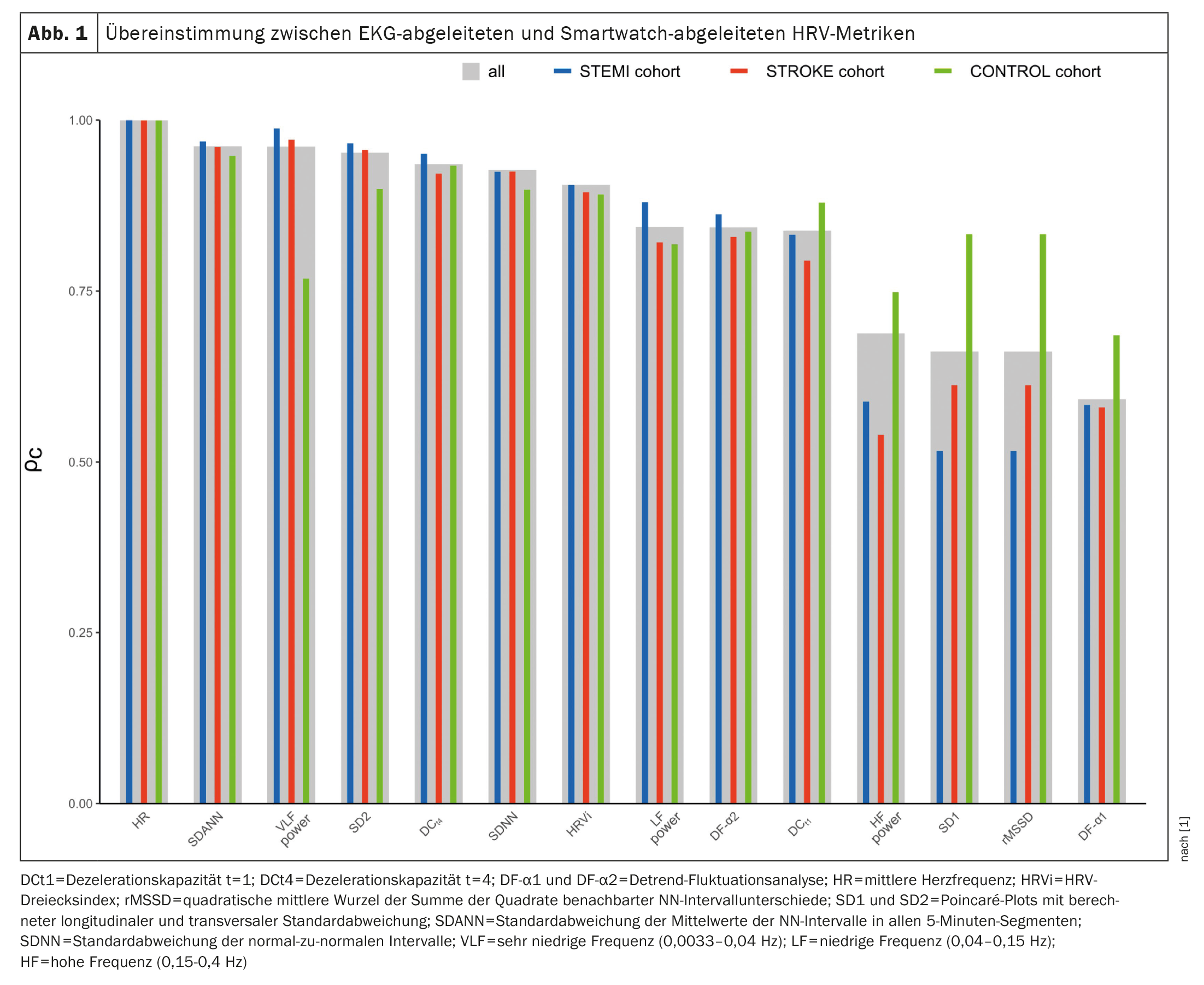
La concordancia entre las mediciones de PPG y ECG se evaluó mediante el coeficiente de correlación de concordancia de Lin (ρc), el coeficiente de correlación intraclase (ICC; modelo de efectos mixtos de dos vías), el error medio absoluto (MAE), el error medio porcentual absoluto (MAPE) y los gráficos de Bland-Altman con los sesgos calculados y los límites de concordancia (LoA). Las concordancias entre las métricas de VFC derivadas del ECG y del PPG se muestran en la figura 1 [1]. Las mayores concordancias se observaron en la frecuencia cardiaca media (ρc=0,9998), la SDANN (ρc=0,9617), la potencia VLF (ρc = 0,9613) y la SD2 (ρc=0,9523). Por el contrario, SD1 (ρc=0,6617), rMSSD (ρc=0,6617) y DF-α1 (ρc=0,5919) mostraron la menor concordancia. Para la potencia de RF, las concordancias SD1, rMSSD y DF-α1 fueron inferiores en las cohortes de IAMCEST y IAMCEST en comparación con los controles. Para el resto de marcadores, las concordancias fueron similares en las tres cohortes. Los coeficientes de correlación intraclase oscilaron entre 0,6318 para el DF-α1 y 0,9998 para la frecuencia cardiaca media. El acuerdo se calificó de excelente para siete (50%), bueno para tres (21%), moderado para cuatro (29%) y deficiente para ninguno de los marcadores. No pudo observarse ninguna desviación sistemática, con desviaciones cercanas a cero en todos los análisis. Se encontró una concordancia casi perfecta para VLF y SD2, mientras que DCt4, SDNN, SDANN, HRVi y DF-α2 mostraron una concordancia considerable. Por el contrario, sólo se encontró un bajo nivel de concordancia para el rMSSD y el SD1.
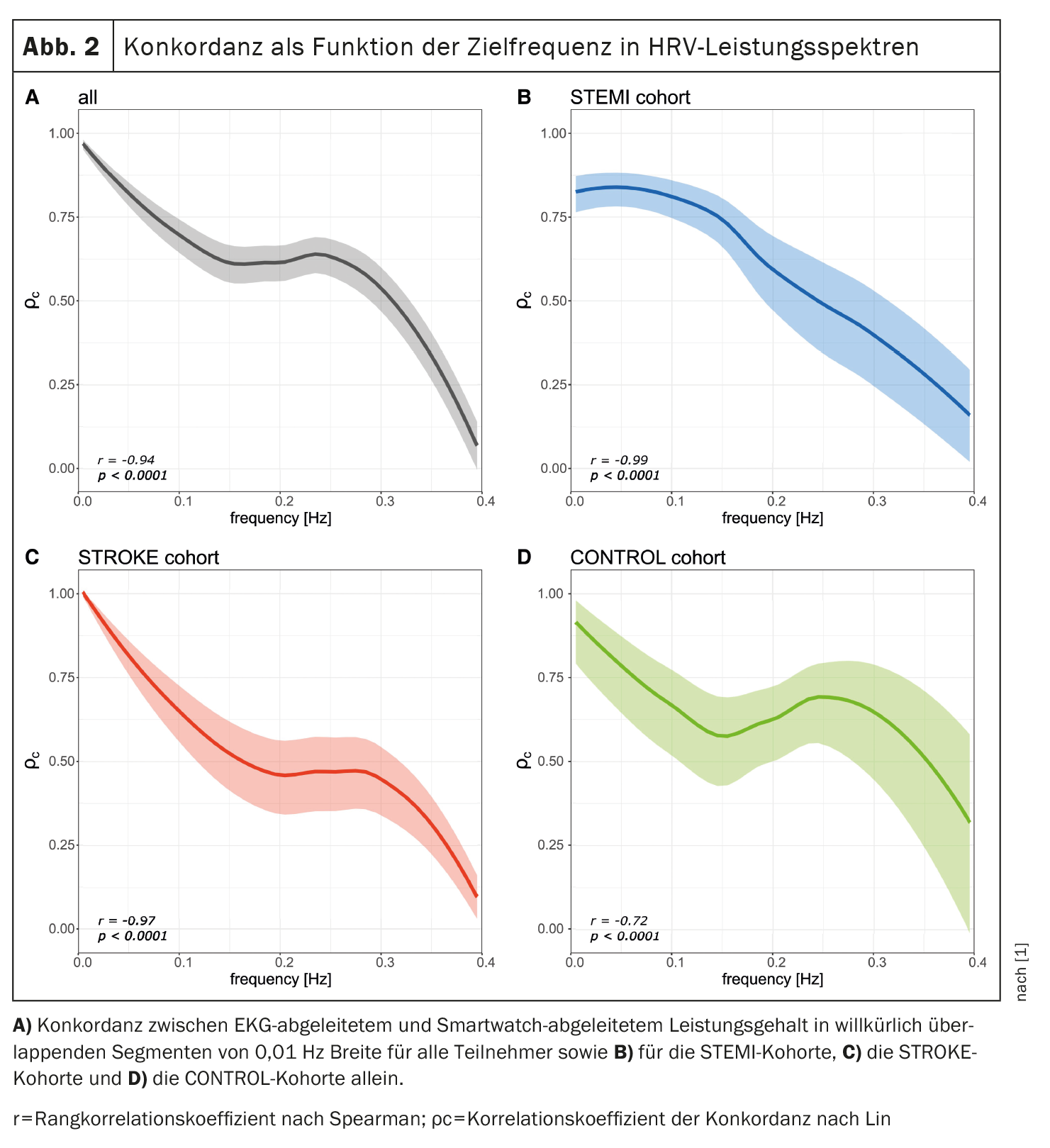
Además, se calculó la concordancia entre el contenido de potencia derivado del ECG y del PPG en bandas de frecuencia superpuestas arbitrariamente para evaluar una posible relación entre la frecuencia espectral de la VFC y la concordancia respectiva. Como se muestra en la figura 2 [1], se observó una relación inversa entre la frecuencia espectral de la VFC y la concordancia entre las métricas de VFC derivadas del ECG y del PPG (r=-0,94, p<0,0001). Esta tendencia se observó en las tres cohortes.
Los parámetros de FC derivados del smartwatch ofrecen una alternativa práctica
En resumen, el estudio aporta pruebas suficientes de que el cálculo de marcadores de VFC a partir de la señal de PPG de un smartwatch es posible en condiciones de reposo. La concordancia entre la VFC derivada del smartwatch y la VFC derivada del ECG de alta resolución es excelente para los parámetros de baja frecuencia, pero sólo moderada para las métricas de alta frecuencia, especialmente en pacientes con enfermedad cardiovascular o cerebrovascular conocida. Se necesitan estudios futuros para validar estos resultados en situaciones reales.
Literatura:
- Theurl F, et al.: Variabilidad de la frecuencia cardiaca derivada de los smartwatches: una comparación directa con el patrón oro en enfermedades cardiovasculares. European Heart Journal 2023; doi: https://doi.org/10.1093/ehjdh/ztad022.
- Grupo de trabajo de la ESC: Estándares de medición, interpretación fisiológica y uso clínico de la variabilidad de la frecuencia cardiaca. Circulation 1996; 93:1043-1065.
- Corr P, et al: Mecanismos que controlan la función autonómica cardiaca y su relación con la arritmogénesis. Nueva York: Raven Press; 1986.
- Lown B, Verrier RL: Actividad neuronal y fibrilación ventricular. N Engl J Med 1976; 294: 1165-1170.
- Kleiger RE, et al: Disminución de la variabilidad de la frecuencia cardiaca y su asociación con una mayor mortalidad tras un infarto agudo de miocardio. Am J Cardiol 1987; 59: 256-262.
- Adamson PB, et al: Evaluación autonómica continua en pacientes con insuficiencia cardiaca sintomática: valor pronóstico de la variabilidad de la frecuencia cardiaca medida mediante un dispositivo de resincronización cardiaca implantado. Circulation 2004; 110: 2389-2394.
- Gerritsen J, et al: El deterioro de la función autonómica se asocia a un aumento de la mortalidad, especialmente en sujetos con diabetes, hipertensión o antecedentes de enfermedad cardiovascular: el estudio Hoorn. Diabetes Care 2001; 24: 1793-1798.
- Yperzeele L, et al: Variabilidad de la frecuencia cardiaca y sensibilidad barorreceptora en el ictus agudo: una revisión sistemática. Int J Stroke 2015; 10: 796-800.
- Sassi R, et al: Avances en el análisis de señales de variabilidad de la frecuencia cardíaca: declaración de posición conjunta del Grupo de Trabajo de e-Cardiología de la ESC y la Asociación Europea de Ritmo Cardíaco coaprobada por la Sociedad de Ritmo Cardíaco de Asia-Pacífico. Europace 2015; 17: 1341-1353.
- Peng CK, et al.: Cuantificación de exponentes de escala y fenómenos de cruce en series temporales no estacionarias de latidos cardíacos. Chaos 1995; 5: 82-87.
- Richman JS, Moorman JR: Análisis fisiológico de series temporales utilizando la entropía aproximada y la entropía muestral. Am J Physiol Heart Circ Physiol 2000; 278: H2039-H2049.
- Huikuri HV, et al: Anomalías en la dinámica latido a latido de la frecuencia cardiaca antes de la aparición espontánea de taquiarritmias ventriculares potencialmente mortales en pacientes con infarto de miocardio previo. Circulation 1996; 93: 1836-1844.
- Bauer A, et al: Capacidad de desaceleración de la frecuencia cardiaca como factor predictivo de la mortalidad tras un infarto de miocardio: estudio de cohortes. Lancet 2006; 367: 1674-1681.
- Schmidt G, et al: La turbulencia de la frecuencia cardiaca tras los latidos ventriculares prematuros como factor predictivo de la mortalidad tras un infarto agudo de miocardio. Lancet 1999; 353: 1390-1396.
- Vescio B, et al.: Comparación entre la detección electrocardiográfica y la fotopletismografía del pulso del lóbulo de la oreja para evaluar la variabilidad de la frecuencia cardiaca en sujetos sanos en registros a corto y largo plazo. Sensors (Basilea) 2018; 18: 844.
- Hernando D, et al.: Validación del apple watch para mediciones de la variabilidad de la frecuencia cardiaca durante la relajación y el estrés mental en sujetos sanos. Sensores (Basilea) 2018; 18:2619.
- Miller DJ, Sargent C, Roach GD: Una validación de seis dispositivos portátiles para estimar el sueño, la frecuencia cardiaca y la variabilidad de la frecuencia cardiaca en adultos sanos. Sensores (Basilea) 2022; 22: 6317.
CARDIOVASC 2023; 22(3): 46-48