La radioterapia constituye un componente integral en el tratamiento del CPNM. Los recientes avances de la radioterapia en el CPNM se basan tanto en los avances técnicos como en la mejor comprensión de la biología de la radiación de las tolerancias de los tejidos normales y las dosis tumorales máximas tolerables. La radioterapia corporal estereotáctica es en la actualidad una opción de tratamiento aceptable para el CPNM en estadio temprano situado periféricamente en pacientes no aptos para someterse a cirugía definitiva. Otras estrategias recientes incluyen el aumento de la dosis de radiación, el uso de la planificación del tratamiento basada en PET-TAC, la radioterapia isotóxica y el uso de la radioterapia con haz de partículas.
El cáncer de pulmón es uno de los más frecuentes en todo el mundo. Según el GLOBOCAN 2012 [1], se estima que en todo el mundo, una incidencia del 16,7% convierte al cáncer de pulmón en el cáncer más frecuente en varones y también contribuye a la mayor mortalidad anual relacionada con el cáncer, del 34,2%. En las mujeres, la incidencia es del 8,8% con una mortalidad del 13,8%. Las incidencias de la tasa estandarizada por edad (TEA) para hombres y mujeres fueron de 34,2 por 100.000 y 8,8 por 100.000 respectivamente. Para ambos sexos combinados, el cáncer de pulmón fue la enfermedad más mortal, con una mortalidad del 19,4% de todas las neoplasias malignas.
En 2012, el Instituto Nacional de Epidemiología y Registro del Cáncer (NICER) informó de que en Suiza se detectan anualmente unos 2.500 y 1.200 nuevos casos en hombres y mujeres, respectivamente [2]. En consecuencia, el cáncer de pulmón representa el segundo y el tercer cáncer más frecuente en hombres y mujeres respectivamente en el país. Durante el periodo comprendido entre 1995-1999 y 2005-2009, el porcentaje de supervivencia relativa estandarizado por edad para hombres y mujeres combinados había mostrado una mejora para el primer año tras el diagnóstico del 37,8 al 44,5% y para el quinto año del 12,4 al 15,9%. Se observó que la supervivencia relativa fue sistemáticamente mejor en las mujeres que en los hombres durante estos dos periodos del calendario.
Alrededor del 85-90% de todos los cánceres de pulmón son cánceres de pulmón de células no pequeñas (CPCNP). El diagnóstico precoz y la mejora de las intervenciones terapéuticas mediante cirugía, radioterapia y quimioterapia, podrían haber contribuido sin duda a la mejora de los resultados evidenciada durante este periodo. La cirugía sigue considerándose la modalidad primaria para el tratamiento de los pacientes médicamente aptos con CPNM operable en estadios iniciales. La quimioterapia cuenta ahora con una serie de nuevos agentes quimioterapéuticos y varios compuestos dirigidos prometedores. La radioterapia, un componente clave en el tratamiento de estos cánceres, también ha experimentado considerables mejoras técnicas en los últimos años. Este artículo pretende presentar una visión general de las diversas indicaciones de la radioterapia en los distintos estadios del CPNM y discutir los últimos avances en el estado del arte de la radioterapia para el CPNM.
Opciones de radioterapia en el CPNM
Las distintas opciones de radioterapia utilizadas en el CPNM dependen del estadio de la enfermedad, del estado general del paciente y de la disponibilidad de instalaciones específicas de radioterapia en una institución determinada. Así pues, basándose en las directrices de la NCCN, la ESMO y la DEGRO, la radioterapia en el CPNM podría utilizarse en términos generales como se resume (Fig. 1) [3–5]:
– Radioterapia definitiva o radical sola:
- a) Con fotones: radioterapia conformada 3D (3D CRT), radioterapia de intensidad modulada (IMRT) o terapia de arco volumétrico modulado (VMAT) apoyada por radioterapia guiada por imagen (IGRT) y radioterapia corporal estereotáctica (SBRT). Todo ello podría llevarse a cabo con diversas técnicas de gating respiratorio, según se disponga en un centro determinado;
- b) Terapia con haz de protones
– Radioterapia preoperatoria o postoperatoria: utilizando la técnica adecuada según lo indicado anteriormente
– Radioterapia en combinación con quimioterapia: Quimiorradioterapia concomitante (CTRT) o uso secuencial de las dos modalidades.
– Radioterapia paliativa con radioterapia externa o braquiterapia intraluminal.

Los enfoques recientes en la radioterapia para el CPNM que incluyen la planificación del tratamiento con gating respiratorio, la planificación del tratamiento basada en PET-TAC, la escalada de dosis con estrategias de fraccionamiento alteradas, la radioterapia corporal estereotáctica (SBRT), los enfoques de radioterapia isotóxica y el uso de haces de partículas – protones e iones de carbono – se resumen en las siguientes secciones.
Planificación del tratamiento y gating respiratorio
La mayoría de los pacientes se someten a una evaluación detallada en las distintas juntas tumorales multidisciplinares para perfilar el enfoque terapéutico óptimo en función del tumor y de las características del paciente. Una vez considerada para la radioterapia, la paciente se somete a una serie de pasos para la planificación de la radioterapia dirigidos principalmente a minimizar la dosis en las estructuras críticas al tiempo que se administran dosis adecuadas al tumor y a las estaciones ganglionares adyacentes (Fig. 2).
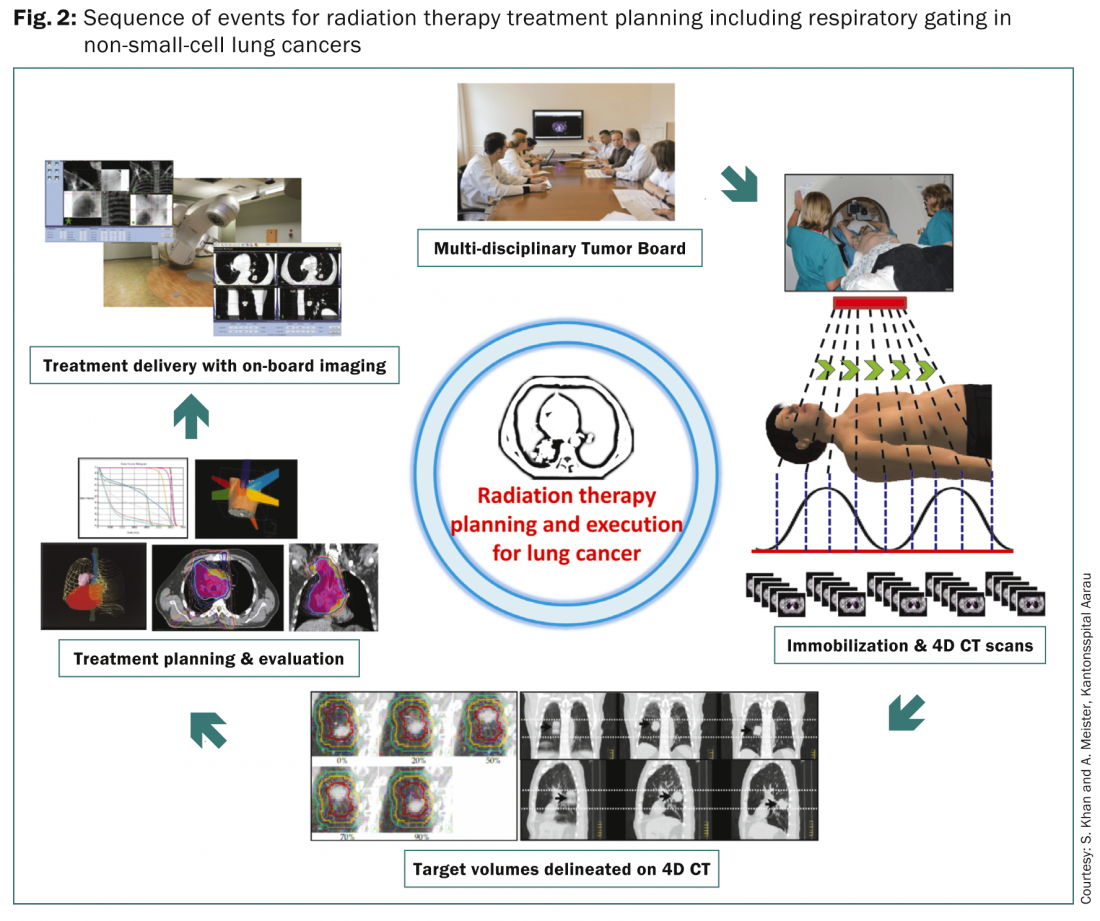
Dado que los tumores pulmonares siguen los movimientos respiratorios, es obligatorio tener en cuenta el movimiento respiratorio y los desplazamientos resultantes de la lesión primaria en el pulmón. Actualmente se dispone de varios métodos. Entre ellas se incluyen la respiración libre o el volumen objetivo no interno (non-ITV) mediante simulación de TC estándar sin TC 4D o fusión de exploraciones de inhalación o exhalación; el enfoque de contención de la respiración o gating non-ITV en el que se adquiere una única imagen de TC 3D a un nivel de respiración predeterminado; el uso de compresiones abdominales durante la TC; Enfoque de TC 4D, que implica la adquisición de al menos dos conjuntos de imágenes de TC 3D al final de la inspiración o al final de la espiración y hasta diez conjuntos de datos de TC 3D correspondientes a los distintos niveles del ciclo respiratorio. El TAC 4D se utilizaría para definir los volúmenes diana mientras se adquiere un TAC de respiración libre independiente para la planificación del tratamiento y el cálculo de la dosis. Los volúmenes objetivo resultantes suelen definirse según los informes 62 y 83 de la ICRU [6,7]. Un debate detallado sobre ellos queda fuera del alcance de este artículo y los lectores interesados pueden consultar los informes 62 y 83 de la ICRU para una revisión exhaustiva.
Una vez delineados los volúmenes diana y los órganos en riesgo, se procede a la planificación del tratamiento para optimizar la combinación de haces coplanares o no coplanares con diferentes ponderaciones, ángulos, formas y tiempos de encendido de los haces, en función de la técnica de tratamiento que se vaya a utilizar: CRT 3D, IMRT y VMAT. Se esbozan una dosis de radiación definida y el calendario de fraccionamiento con restricciones de dosis especificadas para varios órganos de riesgo, especialmente los pulmones, la médula espinal, el esófago, el plexo braquial y el corazón. Los distintos planes de tratamiento alternativos se someten a una cuidadosa evaluación y se selecciona el plan definitivo basándose en la evaluación de los histogramas dosis-volumen para las dosis a los volúmenes diana y los distintos órganos en riesgo. La administración del tratamiento suele realizarse bajo una cuidadosa supervisión y se lleva a cabo en modo de respiración libre, contención de la respiración o gating. Todos ellos necesitarían imágenes a bordo para minimizar los errores entre los planes de tratamiento y su ejecución diaria.
Planificación de la radioterapia basada en PET-TAC
La PET-TC con FDG es actualmente una de las modalidades de diagnóstico utilizadas de forma rutinaria para la estadificación del CPNM. También se utiliza para la planificación de la radioterapia debido a varias ventajas [8] (Fig. 3) .
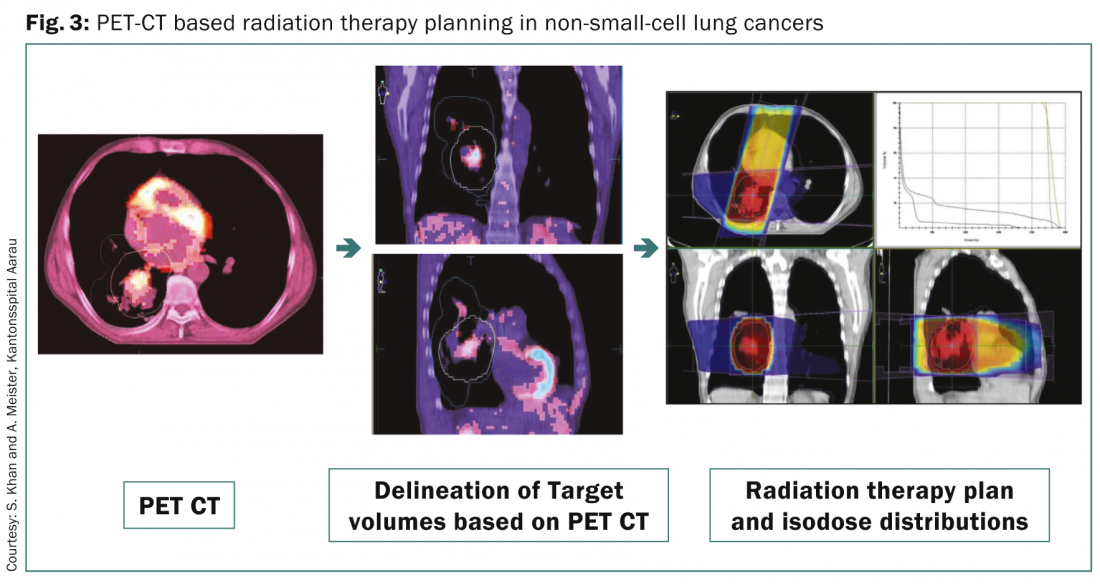
Entre ellas se incluyen la delimitación de los volúmenes diana macroscópicos en un pulmón colapsado; la asistencia en la identificación de los ganglios linfáticos regionales implicados para la irradiación y la planificación del CTV; la detección de cualquier propagación extratorácica de la enfermedad que pueda alterar el estadio de la enfermedad y el plan de tratamiento para el escalado de dosis a la enfermedad macroscópica basado en las imágenes anatomometabólicas obtenidas mediante FDG-PET. La PET-TAC 4D también ha demostrado su utilidad en la localización precisa de pacientes con tumores pequeños que precisan tratamiento y planificación de radioterapia con guía respiratoria.
Los resultados clínicos basados en la planificación por PET-TAC son bastante prometedores y parecen tener una baja incidencia de recidiva locorregional. En un estudio de 137 pacientes, con CPNM en estadio III, la recidiva loco-regional fue del 14,6% para los pacientes planificados mediante PET-TC [9]. Los resultados de un estudio piloto de 32 pacientes, informaron sólo de un paciente cada uno con fracaso regional y progresión tumoral local tras quimiorradioterapia concurrente basada en PET-CT [10]. En la actualidad, varios grupos de Europa y EE.UU. están explorando el uso de la FDG-PET para la radioterapia en el CPNM (ClinicalTrials.gov Identifier: NCT01024829 y 01507428). La aplicación de la planificación basada en PET-TAC podría ampliarse aún más en futuros estudios que incluyan el escalado de dosis a los tumores primarios. Esto podría llevarse a cabo con PET utilizando trazadores hipóxicos, como F-MISO, 18F-FAZA o 18F-HX4, que pueden identificar zonas hipóxicas radioresistentes que podrían beneficiarse especialmente de un aumento selectivo de la dosis [8].
Estrategias de escalada de dosis y fraccionamientos alterados
Se han realizado estudios de escalada de dosis en un intento de mejorar el control local y se había demostrado que mejoraba la mediana de supervivencia de 20 a 26 meses con dosis escaladas hasta 74 Gy en múltiples estudios de fase I/II de grupos cooperativos junto con quimiorradioterapia concurrente [11–13]. Sin embargo, los resultados recientemente comunicados del ensayo de fase III, RTOG 0617 en el que se aleatorizó a los pacientes a 74 Gy en 37 fracciones frente al estándar de 60 Gy en 30 fracciones con paclitaxel/carboplatino semanal con o sin cetuximab no lograron mostrar ningún beneficio con 74 Gy [14]. Sorprendentemente, los fracasos locales y loco-regionales fueron peores en el brazo de dosis más alta, aunque las toxicidades entre los dos grupos fueron comparables. Las posibles razones de ello podrían ser el aumento de la dosis cardiaca y la prolongación del tiempo total de tratamiento en el brazo de dosis alta. Se está investigando el informe final y las posibles razones de la falta de mejora con dosis más altas.
Los esquemas de fraccionamiento alterados que utilizan el hiperfraccionamiento (por ejemplo, CHART: 54 Gy en tres fracciones diarias de 1,5 Gy durante doce días continuos) también se han explorado en el CPNM y los ensayos aleatorizados han mostrado un beneficio en los resultados de supervivencia con respecto a los esquemas de fraccionamiento convencionales [15–17]. Sin embargo, el régimen es logísticamente difícil de aplicar aunque prometa mejorar los resultados de supervivencia.
Con la disponibilidad de la planificación del tratamiento basada en PET-TAC y las técnicas de tratamiento radioterápico de última generación, actualmente se están explorando esquemas de radiación hipofraccionada con administración de dosis superiores a la estándar de 2 Gy por fracción, que se han mostrado prometedores para los tumores en estadios tempranos y han dado como resultado una mediana de supervivencia de 38,5 meses [18]. Esto ha llevado a su uso en la radioterapia corporal estereotáctica en el CPNM temprano, especialmente en pacientes médicamente no aptos para la cirugía.
Radioterapia corporal estereotáctica (SBRT)
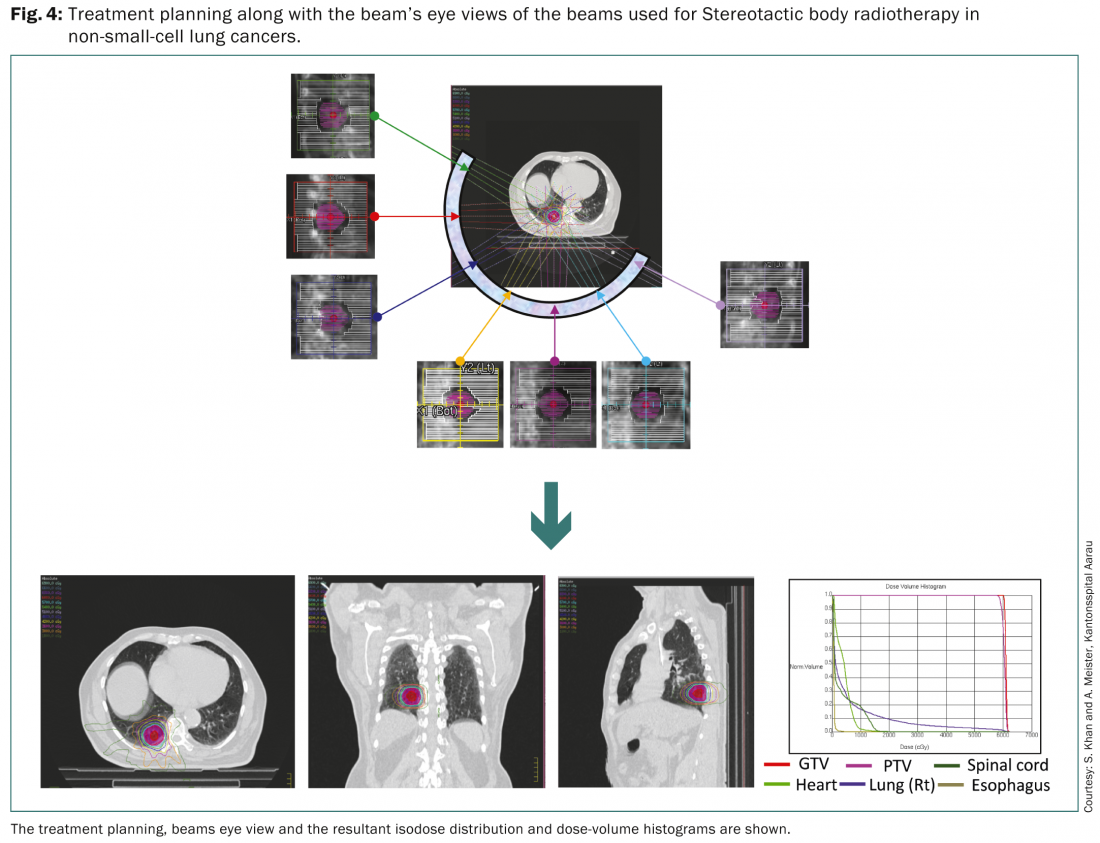
La SBRT permite administrar una dosis elevada de radiación a pequeños volúmenes tumorales con precisión y permite la práctica de una radioterapia hiperfraccionada de alta dosis. Según la Organización Europea para la Investigación y el Tratamiento del Cáncer (EORTC), la SBRT es un enfoque adecuado para pacientes con lesiones ganglionares negativas y periféricas de menos de 6 cm y podría utilizarse en pacientes de edad avanzada que no son aptos para la cirugía [19]. También podría aplicarse a pacientes que se hubieran sometido a una neumonectomía previa. Se recomienda el gating respiratorio junto con la planificación del tratamiento basada en la PET-TC con FDG para la delimitación de los distintos volúmenes diana.
Una revisión sistemática realizada por Soldà et al. comparó los resultados con una cohorte quirúrgica de una serie de 45 informes que comprometían a 3771 pacientes [20]. Se informó de una amplia gama de esquemas de fraccionamiento de dosis. Éstas oscilaron entre 30 Gy en una sola fracción y 45-72,5 Gy en tres a diez fracciones. La supervivencia a 2 años de 3201 pacientes con CPNM en estadio I con SBRT fue del 70% con un control local a 2 años del 91%. Esto se compara bien con la supervivencia a 2 años del 68% en 2038 pacientes en estadio I tratados con cirugía. No hubo diferencias en la supervivencia ni en la supervivencia libre de progresión local entre los pacientes tratados con las diferentes técnicas de radioterapia utilizadas para la SBRT.
Un metaanálisis reciente del que se acaba de informar, se llevó a cabo en 4850 pacientes de 40 estudios de SBRT y se comparó con los resultados quirúrgicos de 23 estudios que comprendían 7071 pacientes en estadio I de CPNM [21]. La edad media de los pacientes sometidos a SBRT fue inferior a la de los de la serie quirúrgica, 74 y 66 años, respectivamente. Al ajustar la proporción de pacientes operables y la edad, la supervivencia global, la supervivencia libre de enfermedad y el control local no difirieron significativamente entre la SBRT y la cirugía. Los autores concluyeron que los abordajes quirúrgicos seguían siendo la norma de tratamiento actual para los pacientes operables desde el punto de vista médico, pero a los que no son aptos desde el punto de vista médico o pueden rechazar la cirugía, debería ofrecérseles la SBRT como norma de tratamiento debido a su eficacia demostrada y su baja toxicidad.
La SBRT se suele recomendar para tumores periféricos y su uso en tumores de localización central es aún incierto debido a un mayor riesgo anticipado de toxicidad. Los resultados de la SBRT en 90 pacientes con CPNM estadio I de localización central (50%) y periférica (56%) se han comunicado a partir de una base de datos combinada de 13 centros académicos de radioterapia alemanes y austriacos [22]. Los tumores periféricos habían recibido una dosis biológicamente eficaz (BED10) más elevada (72 Gy para los tumores centrales frente a 84 Gy para los periféricos). La supervivencia global actuarial a 3 años fue del 29% en los tumores centrales frente al 51% en los periféricos (p<0,001), mientras que la correspondiente libertad de progresión local fue del 52% y el 84% respectivamente (p<0,001). No se registraron diferencias significativas en las toxicidades relacionadas con el tratamiento. Aunque estos resultados indican que los tumores centrales podrían tratarse con SBRT, sus resultados quizá se vean limitados por una dosis reducida en los tumores centrales.
Así pues, la SBRT para el cáncer de pulmón es un enfoque de tratamiento viable para los tumores periféricos de hasta 6 cm y podría considerarse una alternativa para los pacientes que de otro modo no son aptos médicamente para la cirugía [3–5]. Una BED de >100Gy, prescrita en la isodosis envolvente suele ser deseable para lograr los resultados óptimos.
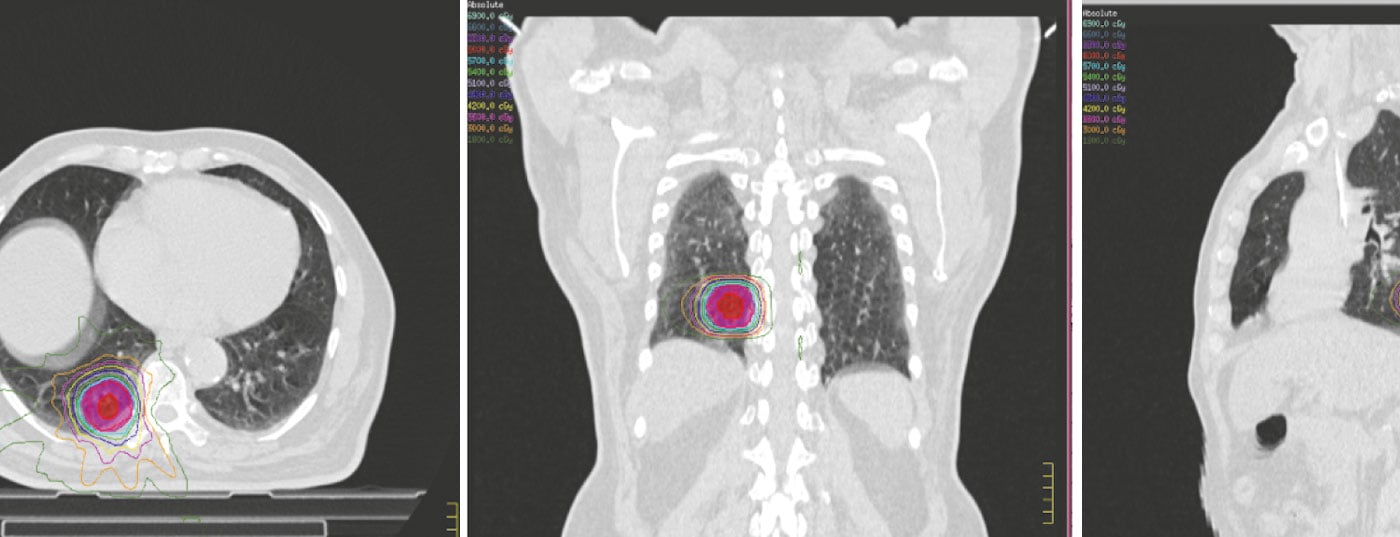
Radioterapia isotóxica o personalizada
La radioterapia isotóxica o personalizada implica la administración de dosis de radiación basadas en las limitaciones del tejido normal de cada paciente. La práctica actual de la radioterapia implica haces de radiación conformados individualmente a las dimensiones del tumor en cada paciente individual, lo que supone un paso adelante hacia la planificación individualizada del tratamiento con radiación. Sin embargo, el tratamiento individualizado también podría ampliarse para incluir la dosis tumoral total (TTD) más alta tolerable que pudiera administrarse y tolerarse en un paciente determinado respetando las limitaciones del tejido normal. Baardwijk et al. plantearon la hipótesis de que el mejor programa de radiación alcanzable incluiría la mayor TTD basada en las limitaciones individualizadas de la dosis en tejido normal administrada en un tiempo total de tratamiento inferior a cinco semanas [23]. Consiguieron demostrar su viabilidad y administraron una dosis tumoral media de 63 Gy (rango 46,8-79,2 Gy) en pacientes médicamente inoperables con CPNM localmente avanzado con una toxicidad tisular aguda y tardía aceptable. Consiguieron una respuesta metabólica completa en el 44% de los pacientes, con una supervivencia global a un año del 57,1%. Actualmente se están llevando a cabo varios ensayos en varios centros del Reino Unido y Europa.
Reymen et al. informaron recientemente de los resultados en los estadios T4N0-1 y estación ganglionar única IIIA-N2 de la radioterapia acelerada isotóxica individualizada (INDAR) y la quimioterapia en el CPNM [24]. Se trató a 83 pacientes con una dosis media de 65 Gy (43,5-72 Gy) en un tiempo medio de tratamiento global de 30 días (17-48 días). El tratamiento consistió en 30 fracciones de 1,5 Gy dos veces al día seguidas de 2 Gy por fracción hasta un TTD máximo limitado por las restricciones del tejido normal. 52 pacientes recibieron quimioterapia concurrente mientras que 31 fueron tratados con quimioterapia secuencial junto con INDAR. Las supervivencias globales para T4N0-1 a los 2 y 5 años fueron del 55 y el 25% respectivamente, mientras que las supervivencias correspondientes para IIIA-N2 fueron del 53 y el 24% respectivamente. El efecto secundario más grave observado fue una esofagitis de grado 3 en siete pacientes, pero todos se resolvieron con tratamiento conservador.
Estos resultados indican que la radioterapia isotóxica con prescripción individualizada de dosis podría mejorar aún más los resultados de estos tumores inoperables localmente avanzados y lograr una supervivencia a largo plazo con baja morbilidad. En futuros ensayos de radioterapia isotóxica podría explorarse sin duda un mayor aumento de la dosis con una mejor planificación y administración de la radioterapia, nuevos fármacos quimioterapéuticos o agentes biológicamente dirigidos o incluso una combinación con cirugía.
Terapia con haces de partículas – terapia con haces de protones y de carbono
El pico de Bragg característico (dosis baja a la entrada del haz y una caída rápida en la deposición de la dosis máxima) proporciona una ventaja dosimétrica única de los haces de protones y carbono sobre los fotones [25]. Desde el punto de vista radiobiológico, aunque se cree que los fotones son casi similares a los protones, las elevadas propiedades de transferencia de energía lineal de los iones de carbono confieren una ventaja radiobiológica a éstos sobre los protones y los fotones. Así, teóricamente las distribuciones de dosis de protones e iones de carbono podrían ser más conformes a los volúmenes diana con dosis integrales menores en comparación con la radioterapia basada en fotones.
Varios estudios de fase I/II con haces de partículas han resultado seguros y eficaces en el CPNM en estadio I. Un metaanálisis realizado por Grutters et al. ha estudiado la eficacia comparativa de protones, fotones y carbones [26]. La supervivencia global corregida a los 2 años fue del 53% para la radioterapia convencional con fotones, del 70% para la SBRT, del 61% para los protones y del 74% para el carbono. A los 5 años, la supervivencia global de la radioterapia convencional (20%) fue significativamente inferior a la de la SBRT (42%), la terapia de protones (40%) y la de iones de carbono (42%). Así pues, parece que aunque los resultados con las terapias de partículas son mejores que los del haz de fotones convencional, siguen siendo comparables a los de la SBRT. Se cree que la terapia de partículas podría ser quizá más beneficiosa en el CPNM en estadio III, en el que la supervivencia global a los 2 años desciende a un escaso 26-36% con la quimiorradioterapia convencional [26].
Un informe reciente de Chang et al. destacó la capacidad de la terapia de protones de intensidad modulada (IMPT) para ser viable junto con la gestión del movimiento respiratorio basada en TC 4D para el CPNM. En un estudio piloto en el que participaron 34 pacientes consecutivos, se observó que la IMPT con gating respiratorio producía una reducción significativa en todos los parámetros dosimétricos considerados que la IMRT estándar [27].
Con el auge de las instalaciones de haz de protones, la introducción de la terapia de haz de protones de intensidad modulada (IMPT) y la guía por imagen de volumen a bordo, cabría esperar una mejora de los resultados con la terapia de protones, aunque esto debe confirmarse mediante ensayos aleatorizados con SBRT.
Conclusiones
El CPNM sigue imponiendo a los oncólogos tratantes el reto de integrar las mejores opciones posibles de una combinación de cirugía, radioterapia y quimioterapia. Incluso con los últimos avances en cada una de estas modalidades, tanto el control local como la supervivencia global siguen preocupando a los oncólogos tratantes.
Los actuales avances tecnológicos en radioterapia, junto con la comprensión de las implicaciones radiobiológicas de los distintos esquemas de fraccionamiento de dosis, han permitido sin duda una administración más segura y precisa de la radioterapia. Esto ha abierto las diversas opciones como la SBRT, la radioterapia isotóxica, el haz de partículas, etc. como posible alternativa para un grupo selecto de pacientes. Sin embargo, la integración con otras modalidades como los agentes quimioterapéuticos y las terapias moleculares dirigidas recientemente desarrolladas necesita una mayor investigación basada tanto en la evidencia como en la medicina personalizada para producir los resultados deseados.
Prof. Dr. med. Niloy Ranjan Datta
Dr. med. Silvia Gómez Ordóñez
Prof. Dr. med. Stephan Bodis
Literatur:
- Ferlay J, et al: GLOBOCAN 2012 v1.0, Incidencia y mortalidad por cáncer en el mundo: IARC Cancer Base No. 11 [Internet]. Lyon, Francia: Centro Internacional de Investigaciones sobre el Cáncer; 2013. Disponible en: http://globocan.iarc.fr.
- Bordoni A, et al: Tendencias en la supervivencia del cáncer de pulmón en Suiza. Schweizer Krebsbulletin 2012; 3. Disponible en: www.nicer.org/assets/files/skb_3-2012_nicer_lung_cancer_survival_in_ch.pdf.
- Vansteenkiste J, et al.: Annl Oncol 2013; 24(suppl 6): vi89-vi98.
- Guías de práctica clínica en oncología de la NCCN: Cáncer de pulmón de células no pequeñas, versión 4. 2014. Disponible en: www.nccn.org/professionals/physician_gls/pdf/nscl.pdf.
- Sociedad Alemana de Oncología Radioterápica (DEGRO): Directrices para la radioterapia estereotáctica extracraneal. Disponible en: www.degro.org/dav/html/download/pdf/ESRT_Leitlinie.pdf.
- Comisión Internacional de Unidades y Medidas de Radiación: Prescribing, Recording and Reporting Photon Beam Therapy (Supplement to ICRU Report 50), ICRU Report 62, Bethesda, MD, 1999.
- Comisión Internacional de Unidades y Medidas de Radiación: Prescribing, Recording and Reporting Photon Beam Intensity Modulated Radiation Therapy, ICRU Informe 83, Bethesda, MD, 2010.
- Chi A, Nguyen NP: Front Oncol 2014 Oct 7; 4: 273.
- van Baardwijk A, et al.: Eur J Cancer 2012; 48: 2339-2346.
- Fleckenstein J, et al: Int J Radiat Oncol Biol Phys 2011; 81: e282-289.
- Bradley JD, et al: Int J Radiat Oncol Biol Phys 2010; 77: 367-372.
- Schild SE, et al: Int J Radiat Oncol Biol Phys 2006; 65: 1106-1111.
- Sociniski MA, et al: J Clin Oncol 2008; 26: 2457-2463.
- Bradley J, et al: J Clin Oncol 2013; 31(15): 7501.
- Belani CP, et al: J Clin Oncol 2005; 23: 3760-3767.
- Hatton M, et al: Int J Radiat Oncol Biol Phys 2011; 81: 712-718.
- Saunders M, et al: Lancet 1977; 350: 161-165.
- Bogart JA, et al: J Clin Oncol 2010; 28: 202-206.
- Ruysscher DD, et al.: J Clin Oncol 2010; 28: 5301-5310.
- Soldà F, et al: Radiother Oncol 2013; 109: 1-7.
- Zheng X, et al: Int J Radiat Oncol Biol Phys 2014; 90: 603-611.
- Schanne DH, et al.: Strahlenther Onkol 2014, doi: 10.1007/s00066-014-0739-5.
- van Baardwijk A, et al.: Int J Radiat Oncol Biol Phys 2008; 71: 1394-1401.
- Reymen B, et al: Radiother Oncol 2014; 110: 482-487.
- Grant JD, Chang JY: Biomed Res Int 2014: 389048. doi: 10.1155/2014/389048.
- Grutters JPC, et al.: Radiother Oncol 2010; 95: 32-40.
- Chang JY, et al: Int J Radiat Oncol Biol Phys 2014; 90: 809-818.
InFo ONKOLOGIE & HÄMATOLOGIE 2015; 3(1): 6-12