El prolapso de la válvula mitral (PVM) es un trastorno valvular frecuente que puede darse a todas las edades. Es la causa más frecuente de regurgitación mitral en los países desarrollados. El PVM se asocia a una morbilidad significativa en los pacientes sintomáticos, mientras que la forma no complicada del PVM tiene una historia natural benigna. La regurgitación mitral (RM) debida a un PVM puede repararse con un bajo riesgo de recurrencia de la regurgitación mitral y de reintervención. La cirugía precoz se asocia a riesgos quirúrgicos bajos y mejores resultados.
El prolapso de la válvula mitral (PVM) es un trastorno valvular frecuente que puede darse a todas las edades. Se asocia a un engrosamiento de la válvula, una dilatación del anillo y unas cuerdas tendinosas anormales [1]. El prolapso de la válvula mitral se reconoce como entidad clínica desde hace unos 60 años, cuando Barlow y Bosman utilizaron la cineangiografía. Antes de este periodo, la opinión general era que los chasquidos y soplos sistólicos estaban causados por adherencias pericárdicas, y la fase avanzada de la enfermedad con regurgitación mitral progresiva se diagnosticaba a menudo erróneamente con cardiopatía reumática. Sin embargo, con la llegada de la ecocardiografía bidimensional (2D) se pusieron de manifiesto la historia natural y la fisiopatología del PVM y sus complicaciones. El término PVM fue acuñado originalmente por Criley et al [2], y ahora se reconoce como la principal causa de regurgitación mitral en los países desarrollados. Si no se diagnostica y trata adecuadamente, el PVM puede ser causa de mortalidad prematura y de una morbilidad considerable.
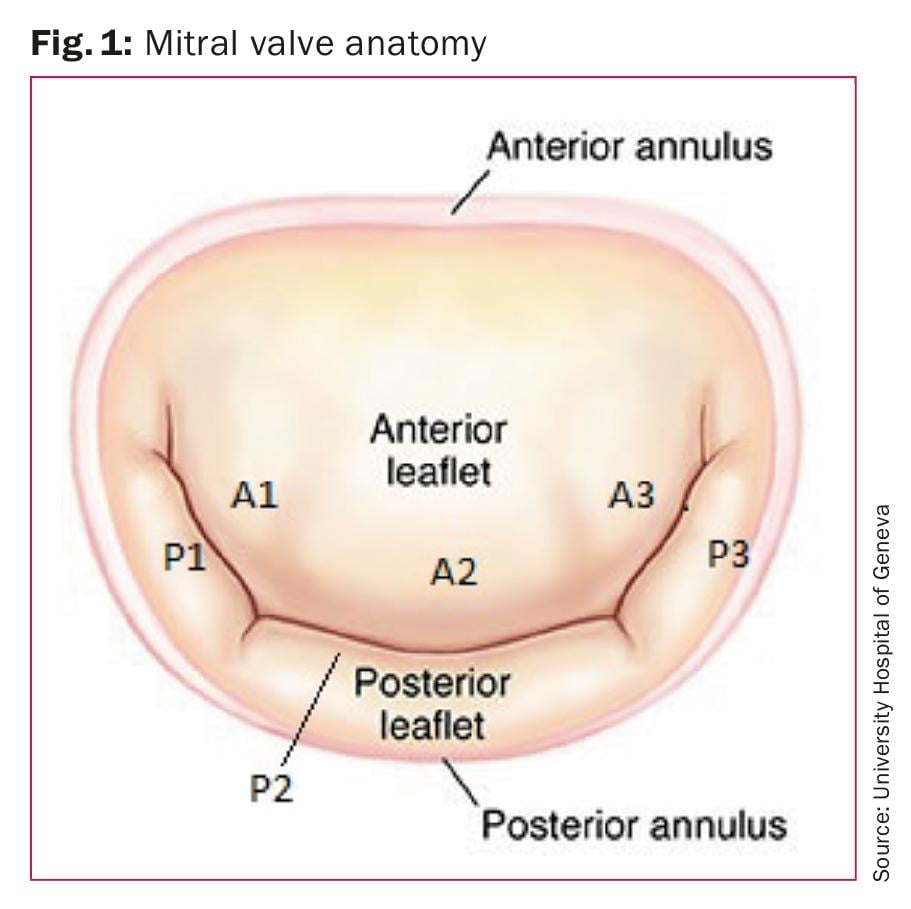
Anatomía de la válvula mitral
Un conocimiento básico de la anatomía de la válvula mitral normal (Fig. 1) es importante para comprender la presentación variable y el mecanismo del prolapso de la válvula mitral. La válvula mitral consta de valvas anteriores y posteriores unidas por sus bases a un anillo fibroso o fibromuscular, el anillo mitral. Las valvas están unidas a los dos músculos papilares (anterolateral y posteromedial) por cuerdas tendinosas. Una de las funciones de las cuerdas tendinosas es impedir la eversión o el prolapso de las valvas en sístole. La valva anterior suele ser mayor que la posterior, tiene una base más estrecha y es triangular. La valva posterior es más corta y está segmentada en tres festones o segmentos: lateral, medio y medial. Aunque la vieira mediana es la más grande, existe una variabilidad considerable. Las valvas anterior y posterior se unen en dos comisuras: posteromedial y anterolateral.
Clasificación de Carpentier: Alain Carpentier [3] ha propuesto una clasificación quirúrgica de la anatomía de la válvula mitral. En esta clasificación, los tres festones de las valvas posteriores se denominan P1 (anterolateral), P2 (medio) y P3 (posteromedial). Los segmentos correspondientes de la valva anterior están etiquetados como A1, A2 y A3 (Fig. 1).
Prolapso de la válvula mitral – Definición, clasificación
El prolapso de la válvula mitral (PVM) es un trastorno valvular frecuente que se define como el abombamiento sistólico de una o ambas valvas mitrales hacia la aurícula izquierda, con o sin regurgitación mitral. Es la causa más frecuente de regurgitación mitral en los países desarrollados y la causa primaria más común de disfunción que requiere reparación o sustitución de la válvula mitral [4,5].
El PVM está clasificado como un trastorno hereditario del tejido conjuntivo que se considera un trastorno autosómico dominante con penetrancia variable. Se divide en MVP primario y secundario [6]. El PVM primario se asocia generalmente a una degeneración mixomatosa de la válvula mitral (VM). El PVM secundario está causado por la rotura de las cuerdas tendinosas y/o un movimiento anómalo de la pared del ventrículo izquierdo (VI). Entre las causas potenciales del PVM secundario se incluyen la enfermedad arterial coronaria, la cardiopatía reumática, las miocardiopatías y la endocarditis infecciosa. El PVM también puede estar asociado a algunos trastornos hereditarios, como el síndrome de Marfan, el síndrome de Ehlers-Danlos o el síndrome de Loeys-Dietz.
Boudoulas et al. [7] propusieron una “clasificación clínica” del PVM y lo dividieron en dos grupos: PVM anatómico y PVM sindrómico.
Patología y fisiopatología
El PVM se caracteriza por el agrandamiento progresivo del anillo de la válvula mitral y el engrosamiento de las valvas y las cuerdas, lo que provoca el prolapso superior de las valvas hacia la aurícula izquierda más allá del anillo mitral en la sístole, dando lugar a la IM. Histológicamente, las valvas de la válvula mitral en la MVP presentan una degeneración mixomatosa con rotura del colágeno y producción de fibrillas de colágeno anormales.
Se sabe que hay genes especiales que desempeñan papeles importantes en la formación de las válvulas cardiacas: calcineurina, Wnt/beta-catenina, factor de crecimiento de fibroblastos (FGF)-4, Sox4 y TGF-β. Los defectos en uno o más de estos genes y sus cascadas de señalización pueden causar cambios mixomatosos y debilitamiento de las válvulas. Se ha informado de que la regulación al alza del TGF-β desempeña un papel importante en la patogénesis tanto del MVP anatómico o no sindrómico como del MVP sindrómico [8].
Historia natural y epidemiología
El PVM es la principal causa de regurgitación mitral en los países desarrollados, con una prevalencia de alrededor del 2,4% de la población. El MVP se ha detectado en muchos grupos de población de diferentes orígenes étnicos y raciales. Marks et al. [9] informaron de que los pacientes con válvulas engrosadas y redundantes tenían un mayor riesgo de endocarditis infecciosa, IM y sustitución de la VM.
La edad de aparición del PVM es variable. Las manifestaciones clínicas rara vez se producen antes de la edad adulta, y la intervención quirúrgica para la RM grave es más probable en la sexta o séptima década. El tiempo medio desde la detección de un soplo hasta la presentación sintomática es de unos 20-25 años [6,10].
La presencia de IM conduce a una IM progresivamente más grave, ya que el nivel inicial de IM provoca la dilatación del VI, lo que aumenta la tensión sobre el aparato mitral. Este estrés provoca más daños en el aparato valvular, lo que da lugar a una IM más grave y a una mayor dilatación del VI, procediéndose así a un ciclo perpetuo de volúmenes del VI y de IM cada vez mayores. Esta sobrecarga de volumen conduce a una disfunción irreversible del VI y a un mal pronóstico.
Síntomas
La mayoría de los pacientes con un PVM recién diagnosticado son asintomáticos, y el diagnóstico suele basarse en la auscultación cardiaca o por un hallazgo ecocardiográfico inesperado. Los síntomas habituales de los pacientes con PVM son la falta de aire, las palpitaciones, las molestias en el pecho y los síntomas de insuficiencia cardiaca cuando ya existe una IM importante. Algunos pacientes pueden presentar una aparición súbita de estos síntomas, que pueden deberse a una rotura aguda de la cuerda o a la perforación de las valvas o la disrupción de la válvula en una endocarditis.
Diagnóstico ecocardiográfico
La ecocardiografía 2D es una técnica diagnóstica estándar para el diagnóstico preciso del PVM y para determinar la presencia de IM y otros hallazgos que afectan al pronóstico y al riesgo de complicaciones. La ecocardiografía transesofágica (ETE) y la ecocardiografía tridimensional (3D) pueden aportar información complementaria sobre la evaluación del aparato valvular mitral. La ecocardiografía de estrés puede ayudar a diferenciar la IM moderada de la grave generando información diagnóstica y pronóstica adicional en pacientes seleccionados.
En la ecocardiografía 2D, el PVM se diagnostica cuando una o ambas valvas están desplazadas 2 mm o más en sístole por encima de una línea que une los puntos de articulación anular en vista paraesternal o apical de eje largo [5,11].
Complicaciones del PVM
El PVM se asocia a una morbilidad significativa en los pacientes sintomáticos, mientras que la forma no complicada del PVM tiene una historia natural benigna. Las complicaciones más frecuentes del PVM son la endocarditis, la muerte cardiaca súbita, las arritmias, los acontecimientos cerebrovasculares y la IM grave con indicación quirúrgica.
El riesgo de endocarditis infecciosa es cinco veces mayor en los pacientes con PVM que en la población general [12], pero el riesgo absoluto es pequeño, aproximadamente del 0,2% anual. Los factores de riesgo para el desarrollo de endocarditis infecciosa en pacientes con PVM incluyen el sexo masculino, la edad superior a 45 años, la presencia de un soplo sistólico, el grosor valvular.
Las arritmias cardiacas se detectan con frecuencia en pacientes con PVM. La fibrilación auricular es una de las complicaciones más frecuentes del PVM. La taquicardia supraventricular paroxística es la taquiarritmia más común. La mayoría de las arritmias que se identifican en pacientes con PVM son benignas; sin embargo, se han notificado algunos casos con arritmias ventriculares y muerte súbita cardiaca (MSC). Las arritmias ventriculares y la MSC son la complicación más grave del PVM. La tasa estimada de MSC en el PVM oscila entre el 0,2%/a y el 0,4%/a en diferentes estudios prospectivos [13,14]. Corrado et al. [15] estudiaron 200 casos consecutivos de muerte súbita (edad ≥35 años) y descubrieron que la mayoría de los pacientes con PVM (10% del total) eran mujeres asintomáticas sin regurgitación significativa de la válvula mitral. Basso et al. [14] examinaron el registro de 650 adultos jóvenes (edad ≤40 años) con MSC y descubrieron que el PVM es una causa importante de MSC arrítmica, sobre todo en mujeres adultas jóvenes (7% de todas las MSC, 13% de las mujeres).
El PVM es la causa más frecuente de regurgitación mitral, con desarrollo de IM en aproximadamente el 10% de los PVM aislados [6,7], como resultado de la degeneración mixomatosa progresiva de las valvas, la redundancia de las cuerdas tendinosas y el agrandamiento del anillo mitral. Sin embargo, la contribución general de estos factores no está clara. No todos los pacientes con PVM evolucionan a una IM grave, la progresión suele ser lenta a lo largo de una media de 25 años [10]. La MR grave puede tener un inicio agudo debido a la rotura de las cuerdas tendinosas o a una endocarditis infecciosa. Los hombres mayores de 45 años con PVM tienen un riesgo entre dos y tres veces mayor de desarrollar una IM grave que acabe requiriendo cirugía. Una vez establecida la IM grave, la sobrecarga de volumen conduce a un agrandamiento progresivo de la aurícula izquierda y las cavidades del VI, lo que provoca fibrilación auricular, hipertensión pulmonar e insuficiencia cardiaca congestiva [6,7].
Tratamiento del prolapso de la válvula mitral
Los pacientes asintomáticos con PVM o aquellos con sólo síntomas leves, sin arritmias, un ECG normal y sin evidencia de IM tienen un pronóstico excelente y, en general, una historia natural benigna. Los pacientes asintomáticos con IM moderada y función del VI preservada deben tener un seguimiento anual con control ecocardiográfico cada 1-2 años. Los pacientes asintomáticos con IM grave y buena función del VI (FEVI >60%) deben someterse a un seguimiento clínico y ecocardiográfico cada seis meses. Si alcanzan las indicaciones de las directrices para la cirugía de VM (Fig. 2), la cirugía precoz se asocia con riesgos quirúrgicos bajos y mejores resultados [16–18].
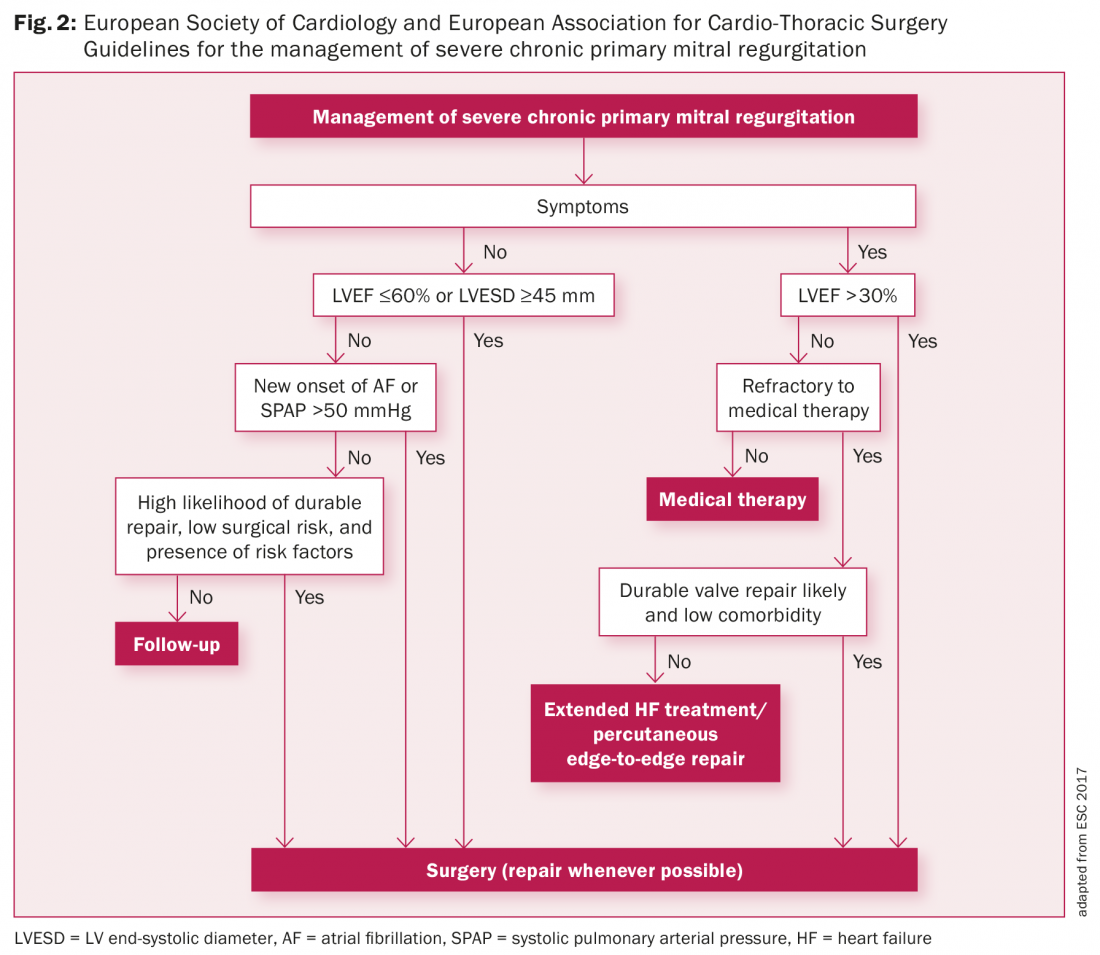
En el PVM sintomático se considera el tratamiento médico con inhibidores de la ECA, betabloqueantes y espironolactona (o eplerenona) en pacientes con síntomas de insuficiencia cardiaca que no son aptos para la cirugía o cuando estos síntomas persisten tras la cirugía. Los pacientes con arritmias ventriculares o palpitaciones asociadas a mareos y/o síncope deben someterse a una cuidadosa revisión de los antecedentes familiares de MSC. Se recomienda a estos pacientes una monitorización ambulatoria de 24 horas (Holter) y pruebas de esfuerzo para la posible detección de arritmias. A los pacientes con fibrilación auricular crónica o paroxística, se haya producido o no embolia arterial, se les recomienda un tratamiento anticoagulante (por ejemplo, Sintrom, Warfarina) si no está contraindicado.
Intervención quirúrgica
En la figura 2 presentamos las últimas directrices de la Sociedad Europea de Cardiología y la Asociación Europea de Cirugía Cardio-Torácica para el tratamiento de la regurgitación mitral primaria grave. Los pacientes sintomáticos con regurgitación mitral (RM) grave deben ser considerados para cirugía de VM [16]. Se ha informado de que la supervivencia a largo plazo tras la reconstrucción de la válvula mitral es menos favorable en pacientes con clase III o IV de la New York Heart Association (NYHA) que en pacientes con clase I o II de la NYHA [17,18]. La cirugía precoz se asocia a mejores resultados. Las indicaciones quirúrgicas para los pacientes con IM grave son una FEVI ≤60% o un diámetro telesistólico del VI (DSVI) ≥45 mm, fibrilación auricular de nueva aparición y una presión pulmonar sistólica ≥50 mmHg [16].
No existe una comparación aleatoria entre los resultados de la sustitución y la reparación de la válvula, pero está ampliamente aceptado que, cuando es factible, la reparación de la válvula es el enfoque preferido. La regurgitación mitral debida a un prolapso de la válvula mitral puede repararse con un bajo riesgo de recurrencia de la regurgitación mitral y de reintervención. La ecocardiografía transesofágica preoperatoria tiene un papel importante en el diagnóstico de la gravedad de la IM y puede aportar información complementaria sobre la evaluación del aparato valvular mitral. La ecocardiografía transesofágica intraoperatoria debe utilizarse para evaluar el resultado de la reparación de la VM.
Técnica quirúrgica – reparación de la válvula
Está ampliamente aceptado que la mayoría de los pacientes con prolapso de la válvula mitral y regurgitación grave pueden someterse a una reparación satisfactoria mediante diferentes técnicas. El análisis adecuado de todos los segmentos de la VM y del aparato subvalvular es importante para la reconstrucción de la VM. El objetivo de la reconstrucción valvular es lograr una función valvular normal duradera. Existen tres principios básicos en la reparación de la válvula mitral [19]: movimiento normal de la valva, gran superficie de coaptación de la valva y remodelación del orificio de la válvula mitral, así como estabilización del anillo mitral. El objetivo de la plastia de la VM para el PVM es corregir el prolapso y transformar la valva posterior en un contrafuerte liso, regular y vertical paralelo a la pared posterior del ventrículo izquierdo. Se han desarrollado muchas técnicas quirúrgicas para corregir el MVP. Debido a la gran variabilidad de las disfunciones y lesiones, y de la calidad del tejido del velo, es difícil recomendar técnicas estandarizadas para la reparación. La elección de la técnica depende de muchos factores, como la extensión del prolapso, su grado y las lesiones que lo producen. El “principio de una lesión, una técnica” propuesto por Carpentier [3,20] facilita la elección entre las distintas técnicas quirúrgicas. En todas las técnicas de reparación de la válvula mitral en las que interviene el aparato subvalvular, es necesario remodelar la válvula mitral con anuloplastia para reducir la tensión en las suturas [19].
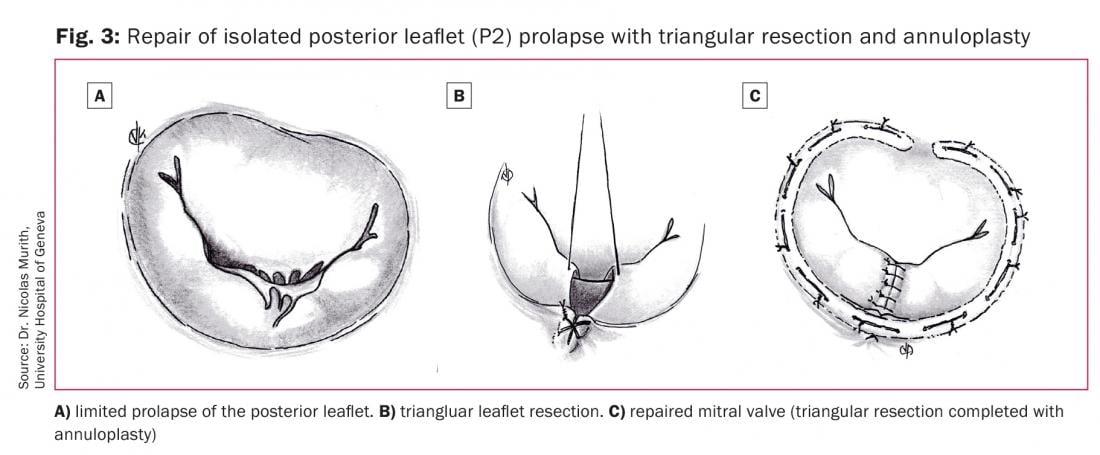
Un prolapso limitado de la valva anterior o posterior (Fig. 3A) puede tratarse mediante una resección triangular de la valva. Se identifica la zona prolapsada, se pasan dos ganchos o suturas alrededor de las cuerdas no alargadas en los límites de la zona prolapsada y, tras una suave tracción, se identifica el triángulo de tejido creado. Se coloca una sutura 5-0 en la parte superior del triángulo y a continuación se reseca el tejido (Fig. 3B). A continuación se suturan los dos nuevos bordes creados de la valva mediante suturas de poliéster 4-0 o 5-0 utilizando suturas evertidas o invertidas (Fig. 3C). Para el prolapso de la valva anterior, el área de resección no debe implicar más del 10% de la superficie de la valva [19].
Si hay una cuerda secundaria no alargada a menos de 5 mm del borde libre de un segmento prolapsado de la valva anterior, podría realizarse una fijación de la valva con dos suturas de monofilamento 5-0 que atravesaran la cuerda y luego el borde libre de la valva.
Para el prolapso de la valva posterior, la resección triangular está indicada cuando la longitud del borde libre del segmento prolapsado no es superior a un tercio de la longitud total de este segmento. Si más de un tercio de la longitud está afectado por un prolapso extenso de la valva posterior, puede realizarse una resección cuadrangular y una plicatura anular. La zona de resección no debe afectar a más del 40% de la superficie de la valva posterior. En caso de prolapso más extenso, puede utilizarse una técnica compuesta de resección parcial de la valva posterior asociada a la reparación de las cuerdas.
La plicatura de la valva triangular o la resección triangular pueden utilizarse en caso de prolapso limitado que afecte a ≤5 mm del borde comisural. En caso de prolapso comisural extenso causado por la rotura de las cuerdas, puede realizarse una resección cuadrangular. Si la comisura posterior está implicada, la resección cuadrangular se completa con una plicatura anular y la “puntada mágica” de Carpentier, cuando la zona prolapsada es de 5-10 mm. Si el prolapso es superior a 10 mm, la resección cuadrangular se completa con una plastia de valvas deslizantes [19]. En la comisura anterior, la resección cuadrangular suele completarse con una plastia de valvas deslizantes.
La regurgitación aguda de la VM puede producirse tras un infarto de miocardio o un traumatismo debido a la VM causada por la rotura del músculo papilar. Por lo general, esta afección requiere una intervención quirúrgica de urgencia, en la mayoría de los casos la reparación de la VM es difícil o imposible, por lo que es necesaria una sustitución valvular. Sin embargo, en algunos casos se puede realizar la reparación de la VM. Dependiendo del tipo de lesión, puede utilizarse la técnica de reimplantación del músculo papilar, la de reimplantación de la cabeza del músculo papilar o la de acortamiento muscular.
En caso de prolapso extenso de las dos valvas, debe utilizarse una combinación de estas técnicas para lograr un buen resultado.
En situaciones con prolapso extendido de las dos valvas, o presencia de chorros regurgitantes múltiples, cuando la reparación anatómica es difícil o no es posible, puede realizarse una técnica de reparación quirúrgica “de borde a borde”, que consiste en suturar juntas las porciones enfrentadas de las valvas anterior y posterior de la válvula mitral [21].
Ocasionalmente, después de haber realizado todas las correcciones importantes, puede quedar algún prolapso comisural en las uniones de las valvas. Esto puede corregirse a menudo con puntos laterales de tipo Alfieri o un “punto mágico” de Carpentier, o mediante una comisuroplastia lateral. El éxito quirúrgico y los resultados tardíos de la plastia de la válvula mitral vienen determinados por el empleo del abordaje quirúrgico correcto para una patología determinada. En todos los casos de reparación quirúrgica de la válvula mitral, el anillo de la válvula mitral se estabiliza mediante una anuloplastia con un dispositivo de anuloplastia cerrado rígido o semirrígido. No sujetar el anillo mitral con una anuloplastia aumenta la tasa de recurrencia de la IM.
Sustitución de la válvula mitral
La sustitución de la válvula mitral con prótesis biológicas o mecánicas puede realizarse cuando la reconstrucción no es satisfactoria o podría no dar lugar a un éxito duradero de la reparación.
Conclusión
El prolapso de la válvula mitral puede producirse a cualquier edad y es la principal causa de regurgitación mitral en los países desarrollados. La mayoría de los pacientes con prolapso de la válvula mitral y regurgitación grave pueden someterse a una reparación con éxito. La reparación de la válvula mitral para el prolapso de la válvula mitral es un procedimiento quirúrgico duradero y de bajo riesgo. Los resultados y la supervivencia a largo plazo tras la reparación de la válvula mitral son mejores si los pacientes son remitidos precozmente a cirugía.
Mensajes para llevar a casa
- El PVM es la causa más frecuente de regurgitación mitral en los países desarrollados.
- La ecocardiografía 2D es una técnica diagnóstica estándar para el diagnóstico preciso del PVM.
- La regurgitación mitral (RM) debida a un PVM puede repararse con un bajo riesgo de recurrencia de la regurgitación mitral y de reintervención.
- La cirugía precoz se asocia a riesgos quirúrgicos bajos y mejores resultados.
- Cuando es factible, la reparación de la válvula es el enfoque preferido.
Bibliografía:
- Otto MC, Bonow OR: Cardiopatía valvular.4ª ed. Filadelfia: WB Saunders; 2014.
- Criley SM, et al: Prolapso de la válvula mitral: Hallazgos clínicos y cineangiográficos. Br Heart J 1966; 28: 488-496.
- Carpentier A: Cirugía valvular cardiaca: la “corrección francesa”. J Thorac Cardiovasc Surg 1983; 86: 323-37.
- Braunwald E: Prolapso de la válvula mitral. En: Braunwald’s heart disease: a textbook of cardiovascular medicine, Filadelfia: WB Saunders 1997; 5(2): 1029-1035.
- Guy FC, et al.: El prolapso de la válvula mitral como causa de regurgitación mitral hemodinámicamente importante. Can J Surg 1980; 23: 166-170.
- Jacobs W, Chamoun A, Stouffer GA: Prolapso de la válvula mitral: Una revisión de la literatura. Am J Med Sci 2001; 321(6): 401-410.
- Boudoulas H, et al.: El prolapso de la válvula mitral y el síndrome de prolapso de la válvula mitra. Am Heart J 1989; 118: 796-818.
- Delling FN, Vasan RS: Epidemiología y fisiopatología del prolapso de la válvula mitral: New Insights into Disease Progression, Genetics, and Molecular Basis. Circulation 2014; 129(21): 2158-2170.
- Marks AR, et al.: Identificación de subgrupos de alto y bajo riesgo de pacientes con prolapso de la válvula mitral. N Engl J Med 1989; 320: 1031-1036.
- Cohen IS: Prolapso de la válvula mitral ecocardiográfico bidimensional: pruebas de la relación de la morfología ecocardiográfica con los hallazgos clínicos y con el tamaño del anillo mitral. Am Heart J 1987; 113: 859-868.
- Shah, PM: Conceptos actuales sobre el prolapso de la válvula mitral – Diagnóstico y tratamiento. J Cardiol 2010; 56(2): 125-133.
- Hickey RJ, MacMahon SW, Wileken DEL: Prolapso de la válvula mitral y endocarditis bacteriana: ¿cuándo es necesaria la profilaxis antibiótica? Am Heart J 1985; 109: 431-435.
- Nishimura RA, et al.: Prolapso de la válvula mitral documentado ecocardiográficamente: seguimiento a largo plazo de 237 pacientes. N Engl J Med 1985; 313: 1305-1309.
- Basso C, et al: Prolapso arrítmico de la válvula mitral y muerte súbita cardiaca. Circulation 2015; 132(7): 556-566.
- Corrado D, et al: Muerte súbita en jóvenes con prolapso aparentemente aislado de la válvula mitral. G Ital Cardiol 1997; 27: 1097-1105.
- Baumgartner H, et al.: 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017; 38(36): 2739-2791.
- Tribouilloy CM, et al.: Impacto de los síntomas preoperatorios en la supervivencia tras la corrección quirúrgica de la regurgitación mitral orgánica: razones para optimizar las indicaciones quirúrgicas. Circulation 1999; 99(3): 400-405.
- Mohty D, Enriquez-Sarano M. El resultado a largo plazo de la reparación de la válvula mitral para el prolapso de la válvula mitral. Curr Cardiol Rep 2002; 4(2): 104-110.
- Carpentier A, Adams D, Filsoufi F: Cirugía valvular reconstructiva de Carpentier. 1ª ed. Saunders; 2010.
- Carpentier A, et al.: Tratamiento conservador del prolapso de la válvula mitral. Ann Thorac Surg 1978; 26(4): 294-302.
- Maisano F, et al: La técnica de borde a borde: un método simplificado para corregir la insuficiencia mitral. Eur J Cardiothorac Surg 1998; 13(3): 240-245; discusión 245-246.
CARDIOVASC 2017; 16(6): 10-15