Un resumen de la situación actual de la farmacogenética en psiquiatría – con consejos prácticos para su aplicación, ya que desde principios de 2017 ha entrado en vigor una revisión de la lista de análisis. En determinadas condiciones, esto permite el reembolso de las pruebas farmacogenéticas.
La farmacogenética en psiquiatría podría celebrar pronto su 50 cumpleaños. Autores escandinavos ya habían descubierto en 1969 que, tras el tratamiento con nortriptilina, los niveles plasmáticos de este antidepresivo tricíclico noradrenérgico eran muy similares dentro de parejas de gemelos monocigóticos pero no dicigóticos, lo que llevó a la conclusión de que la variabilidad de los niveles plasmáticos tenía un trasfondo genético [1]. Al mismo tiempo, este trabajo también apuntaba ya a la aparición de interacciones farmacocinéticas que deben denominarse factores ambientales, en el sentido de que la similitud de las concentraciones de nortriptilina dentro de los pares no se observó en los gemelos monocigóticos tratados con fármacos adicionales.

El siguiente paso importante en 1977 fue la descripción de diferentes fenotipos, a saber, de metabolizadores “eficientes” (EM) o “normales” y “no metabolizadores” (n.m., hoy denominados “metabolizadores pobres”, PM) del fármaco antihipertensivo debrisoquina [2]. Se sospechó de una deficiencia genética de la debrisoquina hidroxilasa, que ahora se conoce como la enzima genéticamente polimórfica citocromo P-450 2D6, o CYP2D6, en los MP basándose en los datos farmacocinéticos. Gracias a las modernas técnicas de análisis del ADN, en 1988 se consiguió la presentación de los genotipos, es decir, la primera prueba biológica molecular de un polimorfismo genético, utilizando como ejemplo el CYP2D6 [3]. En 1981, se midieron niveles plasmáticos excepcionalmente elevados de nortriptilina en un paciente tratado con nortriptilina que era PM en la prueba farmacogenética debrisoquin. Además, la paciente sufría efectos secundarios graves a pesar de la dosis habitual (75 mg/día). La reducción de la dosis a 25 mg/día produjo una mejoría clínica y la resolución de los efectos secundarios [4]. Este estudio de caso histórico se considera la primera descripción psicofarmacogenética clínicamente relevante. Desde entonces, numerosos estudios han respaldado la hipótesis de que, además de los factores ambientales y los relacionados con el paciente como persona, los factores genéticos también son responsables de las diferencias interindividuales en la farmacocinética y la farmacodinámica de los psicofármacos (Fig. 1) [5]. En particular, se han identificado numerosas variantes genéticas en las enzimas implicadas en el metabolismo de estos fármacos y se ha caracterizado su influencia en la actividad enzimática [6,7]. Gracias a la colaboración entre el mundo académico y la industria en el campo de la farmacogenómica-farmacogenética, ya existen biomarcadores genéticos adecuados para aplicar la terapia personalizada en la práctica [7,8].
Este documento resume la situación actual de la farmacogenética en psiquiatría. Contiene consejos prácticos para su aplicación, ya que la farmacogenómica en Suiza ha experimentado recientemente una importante innovación: El 1 de enero de 2017 entró en vigor una revisión de la lista de análisis que permite que las pruebas farmacogenéticas sean reembolsadas por el seguro básico bajo ciertas condiciones.
Importancia general de la farmacogenómica farmacogenética
Se ha desarrollado una disciplina denominada farmacogenómica que investiga el efecto de las diferencias genéticas interindividuales sobre la farmacocinética, los efectos terapéuticos y los efectos secundarios de los fármacos [9]. Farmacogenómica y farmacogenética se utilizan a menudo como sinónimos. Los biomarcadores farmacogenéticos permiten estimar la respuesta terapéutica a un fármaco o su toxicidad en un paciente individual. A menudo se trata de variantes genéticas de enzimas del metabolismo de los medicamentos o de proteínas de transporte, de receptores responsables del efecto de los medicamentos, pero también del complejo mayor de histocompatibilidad (antígenos leucocitarios humanos, HLA; véase el siguiente ejemplo carbamazepina).
En la práctica clínica, se atribuyen las siguientes funciones a las pruebas farmacogenéticas [10]:
- Evitar sobredosis que provoquen reacciones adversas a los medicamentos
- Evitar subdosis que conduzcan a un efecto terapéutico insuficiente
- Evitar el uso de medicamentos en pacientes hipersensibles y expuestos a riesgos
- Mejora del diagnóstico diferencial, por ejemplo para establecer la causalidad de una reacción adversa a un medicamento.

El objetivo general es utilizar los conocimientos adquiridos gracias a la farmacogenómica para adaptar las terapias farmacológicas al perfil genético de cada paciente. Otros autores lo denominan “farmacoterapia estratificada” [11]. Para contribuir de forma significativa a su aplicación, pero también para promover la investigación, se ha fundado recientemente en este contexto el grupo suizo “Farmacogenómica y Terapia Personalizada” como sección de la Sociedad Suiza de Farmacología Clínica y Toxicología (SGKPT). (Recuadro “Grupo Suizo de Farmacogenómica y Terapia Personalizada”). Hay que precisar que la farmacogenética no suele estudiar los genes responsables del desarrollo de enfermedades [12]. La farmacogenómica estudia las variantes genéticas que influyen en las áreas de farmacocinética y farmacodinámica de un fármaco. Las dianas de los fármacos son, por ejemplo, los receptores o las proteínas transportadoras de neurotransmisores. Dependiendo de la variante genética presente, los fármacos interactúan con ellos de forma diferente en términos farmacológicos. Por lo tanto, los fármacos pueden diferir entre sí en su farmacodinámica debido a los distintos perfiles genéticos de los pacientes tratados. En este sentido, existen numerosos estudios sobre la importancia de las variantes genéticas de las proteínas transportadoras de neurotransmisores (por ejemplo, el transportador de 5-HT) y de las proteínas receptoras (por ejemplo, el receptor de dopamina) para el efecto clínico de los fármacos psicotrópicos [13,14]. Sin embargo, el genotipado en este ámbito no se recomienda actualmente en la práctica diaria debido a la insuficiencia de pruebas [15].
La situación es diferente en el ámbito de la farmacocinética-farmacogenómica, donde ya se está produciendo una tímida implantación. Muchos autores y comités recomiendan el genotipado de las enzimas metabolizadoras de fármacos y, más recientemente, de las proteínas transportadoras de fármacos en la práctica clínica. Las cuatro etapas del destino de un fármaco en el organismo son la absorción, la distribución, el metabolismo y la eliminación (“ADME”). En el pasado, se asumía que los fármacos se distribuían en el organismo mediante simple difusión. Entretanto, sin embargo, se han caracterizado proteínas transportadoras que aceleran el paso de sustancias activas a través de las barreras de membranas y células, por ejemplo, del intestino a la sangre y a través de la barrera hematoencefálica. La captación en el hígado, donde tiene lugar gran parte del metabolismo del fármaco, también está mediada por proteínas transportadoras. Entre ellas se encuentra la glicoproteína P (PgP), que, entre otras cosas, actúa como transportador de eflujo para garantizar que los fármacos y otros xenobióticos, en la medida en que sean sustratos de la PgP, se eliminen de nuevo rápidamente del SNC y, por tanto, no puedan alcanzar concentraciones intracerebrales relevantes. El gen ABCB1, que codifica la proteína PgP, presenta numerosas variantes genéticas. Como consecuencia de este polimorfismo genético, existen individuos en los que la función de la PgP como proteína transportadora de determinados sustratos sólo se ejerce de forma limitada o no se ejerce en absoluto, lo que influye en su farmacocinética y en su efecto clínico [16].
Como se mencionó al principio, el sistema enzimático del citocromo P-450 también desempeña un papel importante en el metabolismo de los productos farmacéuticos. Varias formas como CYP2B6, CYP2C9, CYP2C19 y CYP2D6 presentan un polimorfismo genético. A grandes rasgos, se distingue entre PM sin copia genética activa, EM con dos copias genéticas activas -ahora se denominan “metabolizadores normales” [17] -, metabolizadores intermedios (IM) con, por ejemplo, una sola copia genética activa y metabolizadores ultrarrápidos (UM) con más de dos copias genéticas activas como consecuencia de la multiplicación genética. En función del estado metabólico determinado genéticamente, se miden niveles plasmáticos de fármaco extremadamente altos (en PM), “normales” (en EM, IM) o extremadamente bajos (en UM). Por lo tanto, existe un mayor riesgo de reacciones adversas (en PM) o de falta de respuesta (en UM) a la medicación a las dosis habituales [18]. En el caso de los fármacos que se convierten de una forma inactiva al agente activo mediante una enzima con un polimorfismo genético, los grupos de riesgo se invierten (falta de respuesta en PM; riesgo de efectos secundarios en UM). Por ejemplo, el sustrato de CYP2D6 codeína es un precursor (un “profármaco”) de la morfina: en UM, el riesgo de intoxicación por morfina tras la administración de codeína aumenta [19].
Fuentes de información para las recomendaciones y directrices
El médico tratante basa su estrategia de tratamiento, entre otras cosas, en la información accesible en el “ Resumen de las características del producto “ (RCP). Contiene información sobre el metabolismo, la farmacocinética y los mecanismos de acción de los medicamentos. Para varios fármacos, ahora también hay pruebas de la influencia de las variantes farmacogenéticas. A pesar de las recomendaciones de la literatura científica, la realización de pruebas farmacogenéticas muy rara vez se recomienda explícitamente en la información sobre el medicamento. Los pares fármaco/gen carbamazepina/HLA-A*31:01 y carbamazepina/HLA-B*15:02 constituyen una excepción (en el espectro farmacodinámico). En los portadores de los alelos HLA-A*31:01 o HLA-B*15:02, el riesgo de efectos secundarios dermatológicos graves aumenta significativamente en comparación con los no portadores. Por lo tanto, en los pacientes en los que se planifique una terapia con carbamazepina, debe realizarse el genotipado para reducir, entre otras cosas, el riesgo de síndrome de Stevens-Johnson. Sin embargo, la frecuencia de estas variantes de riesgo difiere en los distintos grupos étnicos, razón por la cual, por ejemplo, sólo se recomienda el genotipado de HLA-A*31:01 para los individuos de origen europeo, como se describe detalladamente en el apartado “Carbamazepina” [20]. La variante HLA-B*15:02 , por otro lado, sólo es común en ciertas poblaciones asiáticas y el genotipado sólo se recomienda en pacientes de origen asiático.
Otra excepción se refiere a un genotipado farmacocinético-farmacogenético, a saber, el par CYP2D6/La atomoxetina, un fármaco prescrito para el tratamiento del TDAH (“Trastorno por déficit de atención con hiperactividad”), que es un sustrato de la enzima. La “Información sobre el medicamento” especifica: “Alrededor del 7% de todos los caucásicos tienen un genotipo correspondiente a una enzima CYP2D6 defectuosa (el llamado CYP2D6 “metabolizador pobre”). Los pacientes con este genotipo tienen una exposición mucho mayor a la atomoxetina en comparación con los pacientes con una enzima funcionante, por lo que los metabolizadores deficientes tienen un mayor riesgo de sufrir efectos secundarios. Para los pacientes con un genotipo conocido de “metabolizador pobre”, debe considerarse una dosis inicial más baja y una titulación más lenta.” A pesar de estas recomendaciones de actuación, el genotipado evidente antes de iniciar la terapia no se recomienda explícitamente en la información sobre el fármaco. Por otro lado, los datos farmacocinéticos del mismo fármaco permiten suponer que el riesgo de falta de efecto (falta de respuesta) a la atomoxetina es elevado en los pacientes UM (CYP2D6). [21].
En el caso de otros fármacos, como el aripiprazol, la información sobre el medicamento menciona que este antipsicótico se metaboliza por CYP2D6 y, por tanto, su biotransformación se ve fuertemente reducida en PM, pero no hay información ni medidas recomendadas sobre un posible beneficio del genotipado. Sin embargo, varios grupos de autores y organizaciones han publicado entretanto directrices con recomendaciones que ayudan al médico tratante en la interpretación de los resultados de las pruebas farmacogenéticas y en las decisiones sobre el tratamiento posterior con la inclusión de la información farmacogenética.
En este sentido, resultan muy útiles organizaciones como el Consorcio de Aplicación de la Farmacogenética Clínica (CPIC) y el PharmGKB albergado por la Universidad de Stanford. (La base de conocimientos sobre farmacogenómica). Recopilan y analizan las pruebas científicas en este campo, publican recomendaciones para la selección de fármacos y el ajuste de las dosis de los mismos basándose en los resultados de las pruebas farmacogenéticas e información sobre la relación entre genes y variantes genéticas específicas y el efecto clínico en el resultado del tratamiento farmacológico. PharmGKB también ofrece herramientas de interpretación en línea en las que, tras introducir el genotipo de un paciente, se muestran directamente las recomendaciones pertinentes para ese genotipo.
Esto demuestra que no sólo es necesario determinar para un grupo de fármacos con estructuras químicas similares o la misma indicación, sino para cada fármaco individual sobre la base de datos experimentales y estudios clínicos, hasta qué punto son relevantes determinadas variantes genéticas y si el genotipado es útil en absoluto. Por lo tanto, hay que definir pares fármaco/gen para los que el genotipado según determinados criterios proporcione información relevante para el tratamiento y orientadora desde el punto de vista clínico.
Niveles de evidencia
PharmGKB ha definido diferentes niveles de evidencia que reflejan la solidez de los datos científicos que apoyan una asociación entre las variantes genéticas y un resultado terapéutico específico (efecto, efectos secundarios) para pares gen/fármaco individuales (véase el recuadro).

Los estudios farmacogenéticos son difíciles de realizar porque, dependiendo de la frecuencia de los alelos investigados en una población o del efecto secundario investigado, debe incluirse en el estudio un número muy elevado de pacientes para obtener resultados estadísticamente relevantes. Por ello, PharmGKB ha definido cuatro niveles de evidencia diferentes [22,23]. De este modo, cada nota clínica (“anotación”) contiene información sobre el nivel alcanzado por el par fármaco/gen respectivo.
La tabla 1 muestra una recopilación de los fármacos más importantes para la psiquiatría, sus proteínas implicadas en el metabolismo y el transporte, y los niveles de evidencia clínica de las asociaciones. Lo ideal sería que los niveles de evidencia también se reflejaran en las recomendaciones de la información sobre el medicamento. Además, la Administración de Alimentos y Medicamentos de EE.UU. (FDA) ha publicado una lista de 200 fármacos cuya información sobre medicamentos proporciona datos sobre biomarcadores farmacogenómicos.
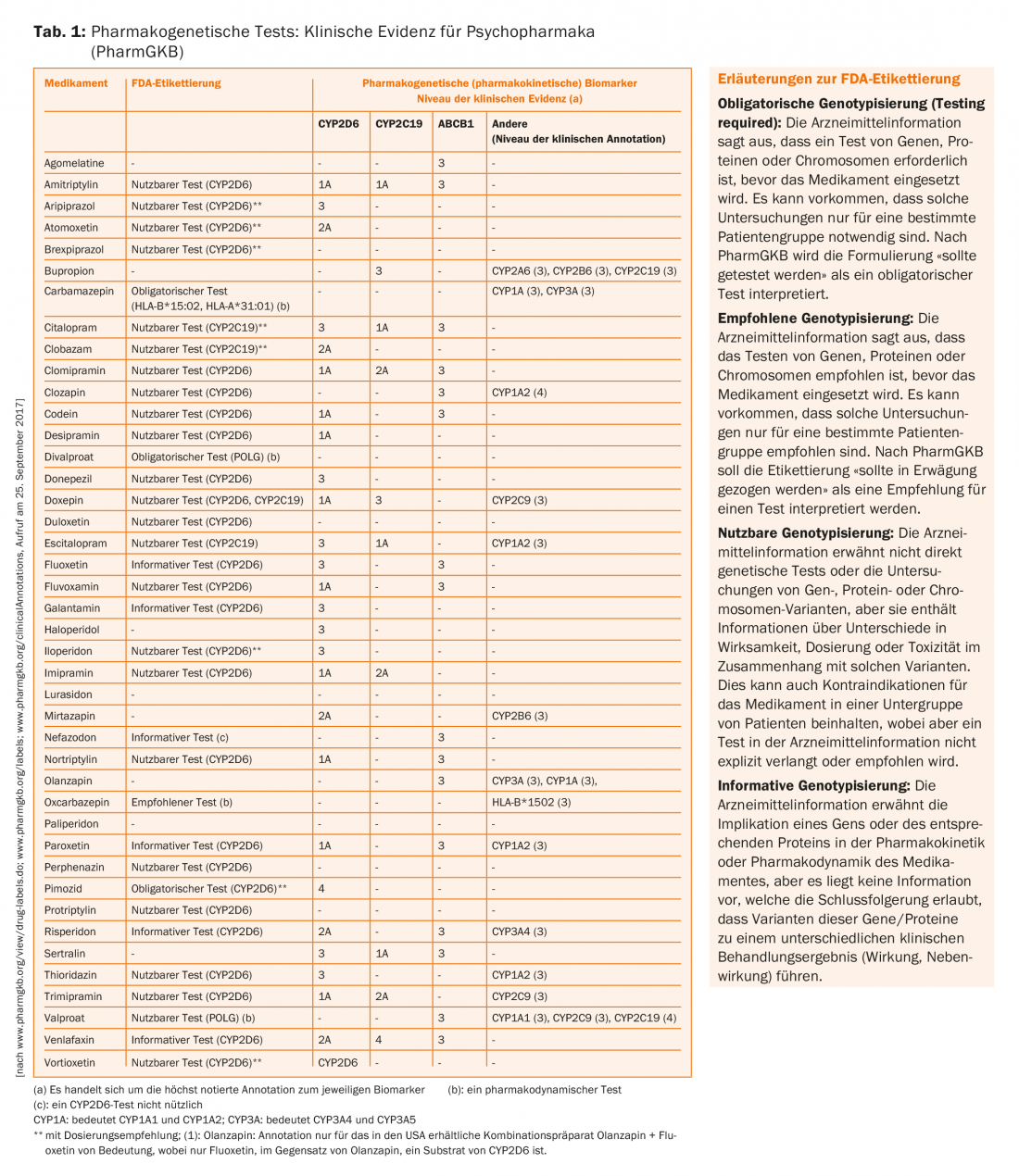
Con 26 biomarcadores, la psiquiatría ocupa el segundo lugar después de la oncología en términos de frecuencia (Tab. 1) [24]. Hay que destacar que, en oncología, la genética del tumor se examina muy a menudo para estimar el efecto de un fármaco (por ejemplo, ciertas mutaciones en el receptor EGF deben estar presentes en las células tumorales para que el gefitinib funcione), pero esto suele diferir de la genética del paciente. Por el contrario, las cuestiones farmacogenéticas en el metabolismo y el transporte, así como en el efecto de los fármacos no oncológicos, utilizan la información genética de las células corporales del paciente.
La tabla 1 también presenta anotaciones de la información de la FDA sobre fármacos psicotrópicos resumida por PharmGKB. También existen anotaciones correspondientes, pero menos completas y no presentadas aquí, de la Agencia Médica Europea (EMA), la Agencia Japonesa de Productos Farmacéuticos y Médicos (PMDA), Health Canada Santé Canada (HCSC) y otras agencias. De esta recopilación se puede resumir lo siguiente:
- Para los pares fármaco/gen como carbamazepina/HLA-A*31:01 alelo y carbamazepina/HLA-B*15:02 alelo, pero también para ciertos antidepresivos (por ejemplo, amitriptilina)/CYP2D6 y/o CYP2C19, existen recomendaciones al más alto nivel (1A)
- Los pares de fármacos/genes relacionados con proteínas transportadoras como la ABCB1 (PgP) (por ejemplo, citalopram/ABCB1) sólo alcanzan el nivel de evidencia 3.
- Para prácticamente todos los pares fármaco/gen, las pruebas farmacogenéticas se indican como “procesables”, es decir, utilizables o direccionales, pero no necesariamente obligatorias o clasificadas como obligatorias. Sólo para la carbamazepina, el divalproato (pero extrañamente no para el valproato – podría ser consecuencia de la falta de datos procedentes de ensayos clínicos para llegar a este nivel de recomendación) y el antipsicótico pimozida, que ya no está autorizado en Suiza, se designa una prueba farmacogenética como “obligatoria” por la FDA.
Recomendaciones para las pruebas farmacogenéticas en psiquiatría
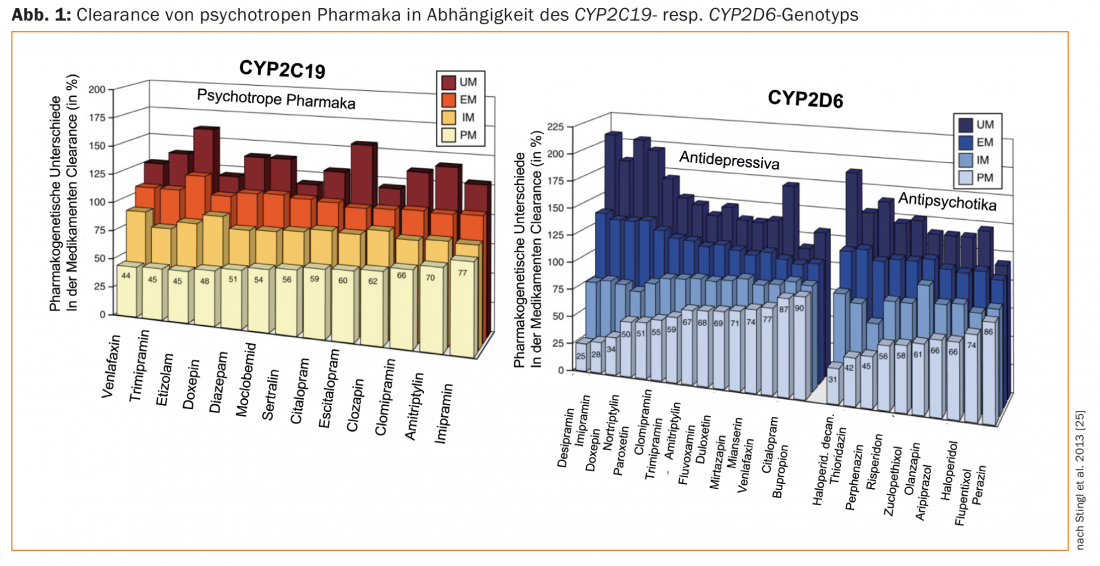
Las revisiones sobre la farmacogenética de los psicofármacos y las directrices para las pruebas farmacogenéticas en psiquiatría se refieren sobre todo al genotipado CYP2D6 y CYP2C19 de lospacientes tratados con antidepresivos y antipsicóticos [25–29]. Los fármacos difieren en sus propiedades como sustratos de estas enzimas. Esto explica las diferencias significativas en las recomendaciones de dosis entre los distintos fármacos, teniendo en cuenta los genotipos de los pacientes (UM, EM, IM, PM; Fig. 1; [25]). Por ejemplo, en el caso de la paroxetina, sustrato casi exclusivo del CYP2D, la dosis debe reducirse a sólo un 50% de la dosis habitual para un PM (CYP2D6), y aumentarse en más de un 50% para un UM. Por el contrario, esta enzima desempeña un papel menor en el citalopram, por lo que no es necesario un ajuste de la dosis en función del genotipo CYP2D6. Por otra parte, el CYP2C19 desempeña un papel importante en el metabolismo de este antidepresivo – dependiendo del genotipo CYP2C19, la dosis debe aumentarse (UM) o disminuirse (PM) (Fig. 1).
Especial atención merece la recomendación de renombrados autores suizos que, en nombre de la Sociedad Suiza para la Ansiedad y la Depresión (SGAD), la Sociedad Suiza de Psiquiatría Biológica (SGBP) y la Sociedad Suiza de Psiquiatría y Psicoterapia (SGPP), han recomendado el genotipado de ABCB1 Se recomienda en todos los pacientes deprimidos a los que se prescribe terapia con antidepresivos pero que experimentan un efecto terapéutico insuficiente. [30]. Esta recomendación tiene una importancia económica y de política sanitaria, ya que puede dar lugar a que miles de pacientes deprimidos sean genotipados cada año, sean o no tratados con un sustrato de PgP.
Algunos antidepresivos son sustratos de la PgP (citalopram), pero otros no (mirtazapina). En pacientes deprimidos tratados con antidepresivos, un estudio retrospectivo descubrió que en los tratados con los sustratos de la PgP amitriptilina, paroxetina, venlafaxina o citalopram, el polimorfismo genético del gen ABCB1se asociaba con la respuesta al tratamiento [31]. La distribución de los genotipos de la variante ABCB1(polimorfismo de nucleótido único, SNP) rs2032583 fue especialmente importante en este caso. Hubo un número significativamente menor de pacientes sin remisión entre los portadores del alelo C de esta variante (25%) que entre los pacientes que no eran portadores del alelo C (62%). Se observaron resultados similares en los cálculos relacionados con el SNP rs2235015. Entre los portadores del alelo T de esta variante, había un número significativamente menor de no portadores en comparación con los no portadores. Tales correlaciones no se observaron en un grupo de comparación de pacientes que no fueron tratados con sustratos de la PgP.
Hay que mencionar que a este grupo sólo se le prescribió un antidepresivo, la mirtazapina. En un metaanálisis, el mismo equipo concluyó que los SNP rs2032583 y rs2235015 están significativamente asociados con el efecto clínico [32], mientras que el análisis de otros SNP no mostró tal asociación. Al mismo tiempo, sin embargo, los investigadores concluyeron en otro estudio que mantener niveles plasmáticos terapéuticos de antidepresivos es una medida necesaria además de la determinación del genotipo ABCB1 [33].
Algunos autores del metaanálisis antes mencionado publicaron recientemente otro análisis mucho más completo de 32 estudios sobre la relación del polimorfismo ABCB1y el efecto clínico (efecto terapéutico, tolerancia) de los antidepresivos [32]: Las asociaciones más altas se obtienen cuando se analizan los rs2032583 y rs2235040, pero ya son más débiles cuando se tiene en cuenta el rs2032582, e incluso más débiles cuando se tienen en cuenta otros SNP como el mencionado rs2235015. En general, los autores del análisis concluyeron que los estudios realizados hasta la fecha no son suficientes para demostrar un beneficio clínico del genotipado ABCB1en el tratamiento farmacológico de la depresión [34].
Son necesarios más estudios clínicos, pero también aquellos que demuestren una importancia funcional de estas variantes del ABCB1situadas fuera de la región del gen que codifica la proteína. Esto podría investigarse con técnicas de imagen para averiguar si los pacientes con diferentes genotipos ABCB1 o combinaciones de variantes (haplotipos) experimentan una captación diferente de los fármacos en el cerebro tras la administración de antidepresivos. Un análisis independiente de la literatura confirma que en este momento la introducción generalizada del genotipado ABCB1en la práctica clínica es prematura [16]. A esta conclusión también llegaron recientemente los miembros de la Comisión de Medicamentos de la Profesión Médica Alemana [35].
Para el médico en ejercicio, esta disputa es confusa, sobre todo porque un grupo de autores duda, basándose en los resultados de sus investigaciones, de que la amitriptilina sea un sustrato de la Pgp en humanos en todos [36]. Tampoco es fácil saber qué variantes genéticas están investigando los laboratorios especiales que ofrecen análisis farmacogenéticos del ABCB1 . Por lo tanto, es evidente que en la actualidad no se recomienda el genotipado ABCB1 rutinario de la mayoría de los pacientes deprimidos tratados con fármacos, sobre todo porque tampoco se dispone de estudios sobre la sensibilidad y especificidad de la prueba.
Importancia del reglamento de 1. de enero de 2017 para las pruebas farmacogenéticas
El 1. El 1 de enero de 2017 entró en vigor en Suiza una ordenanza revisada, según la cual las pruebas farmacogenéticas están cubiertas por el seguro de enfermedad obligatorio si se cumplen determinadas condiciones (Ordenanza de la FDHA de 29 de enero de 2017). septiembre de 1995 sobre las prestaciones del seguro obligatorio de enfermedad (KLV, a partir del 1 de enero de 2017). Es de importancia práctica que estos análisis se incluyan ahora en la Lista Federal de Análisis (Anexo 3 del KLV). Las pruebas farmacogenéticas están cubiertas en la lista de análisis de 1 de julio de 2017 en las partidas 2150.10, 2250.10, 2271.01, 2547.01 (revisada el 14 de julio de 2017). Hay que distinguir entre dos condiciones:
- Un pequeño número de pruebas farmacogenéticas pueden ser prescritas por todos los médicos, independientemente de su título de especialista, y reembolsadas por las cajas de enfermedad. La Sociedad Suiza de Farmacología Clínica y Toxicología (SGKPT, recopilada el 9.6.2016, versión 1) proporciona una lista de estos análisis en relación con fármacos específicos (es decir, se trata de pares fármaco/gen en cada caso):
- Abacavir (HLA-B*57:01);
- Carbamazepina (HLA-A*31:01 y HLA-B*15:02);
- 6-mercaptopurina, azatioprina (TPMT);
- 5-fluorouracilo, capecitabina (DPYD);
- Irinotecán (UGT1A1).
Esta lista es actualizada anualmente por el SGKPT, basándose tanto en la literatura científica actual como en las pruebas obtenidas a través de la experiencia clínica a la hora de seleccionar los pares gen/fármaco. Para la psiquiatría y la neurología, es significativo que todo psiquiatra, neurólogo, pero también el médico generalista pueda (y deba) realizar un genotipado de HLA-A*31:01 y HLA-B*15:02 (en pacientes de origen asiático) en caso de un tratamiento con carbamazepina recién planificado y que las compañías de seguros sanitarios reembolsen al paciente los costes de la prueba.
2. para la prescripción de pruebas farmacogenéticas para pares fármaco/gen distintos de los indicados anteriormente, son especialmente importantes las dos limitaciones siguientes de la lista de análisis:
- Limitación 1: “Sólo en el caso de una indicación para la administración de un fármaco o en el caso de la aparición de un efecto secundario relacionado con el fármaco o una reducción o falta de eficacia terapéutica durante el tratamiento con un fármaco para el que exista una asociación científicamente probada entre efectos secundarios significativos relacionados con el fármaco (incluidos los efectos tóxicos) o una reducción o falta de eficacia terapéutica y las mutaciones genéticas investigadas”.
- Limitación 4: “Para los medicamentos que no figuren en la lista del SGKPT, prescripción de los análisis únicamente por médicos con un título federal de postgrado en farmacología clínica y toxicología de conformidad con la Ley Federal de 23 de junio de 2006 sobre las Profesiones Médicas Universitarias (Ley de Profesiones Médicas, MedBG; SR 811.11)”.
Desde un punto de vista ético, también cabe destacar la limitación 3, según la cual las pruebas no deben utilizarse para realizar un diagnóstico ni para buscar una predisposición a una enfermedad genética.
Consejos prácticos
Este documento muestra que la farmacogenómica tendrá cada vez más importancia en psiquiatría para la planificación y aplicación de la farmacoterapia. Debido a la revisión de la lista de análisis, las pruebas farmacogenéticas relevantes en psiquiatría están disponibles a cargo del seguro de enfermedad obligatorio si un especialista en farmacología clínica y toxicología ha determinado la necesidad de la prueba. Es necesario contar con los conocimientos adecuados para planificar las pruebas farmacogenéticas e interpretar sus resultados de forma óptima. Por lo tanto, este tema debería tenerse más en cuenta en la formación de especialistas en psiquiatría y psicoterapia, en la formación continua y en los programas de perfeccionamiento [37–39]. Las sesiones de enseñanza para el público también son necesarias para promover la comprensión general de la farmacogenómica y lograr de forma óptima su aplicación [40]. Se recomienda bibliografía especializada que no sólo resuma los principios genéticos, sino que también contenga consejos sobre procedimientos prácticos y ejemplos clínicos [11]. Dada la dificultad del tema y como consecuencia de la nueva normativa, la colaboración con farmacólogos clínicos y toxicólogos también resulta especialmente valiosa. También se recomienda la colaboración con profesionales de laboratorio formados en genética para su aplicación práctica.
Las indicaciones para las pruebas farmacogenéticas incluyen: Niveles plasmáticos de fármacos superiores o inferiores a los normalmente esperados a la dosis administrada, lo que sugiere que el paciente tiene una peculiaridad genética en su metabolismo. Por lo tanto, el fármaco debe ser un sustrato de la enzima citocromo P-450 genéticamente polimórfica que se va a probar. Cuando un paciente está comedicado con inhibidores, también debe tenerse en cuenta que los niveles plasmáticos elevados pueden simular una deficiencia metabólica genética como resultado de la interacción de fármacos. Del mismo modo, la medicación conjunta con un fármaco inductor de enzimas puede provocar una disminución del nivel plasmático, que no está determinada genéticamente. Por lo tanto, las pruebas farmacogenéticas deben considerarse generalmente como un complemento de la Monitorización Terapéutica de Medicamentos (TDM) (Fig. 2). Este enfoque también es recomendado por la Arbeitsgemeinschaft für Neuropsychopharmakologie und Pharmakopsychiatrie (AGNP), que actualmente está reeditando una “Guía de Consenso” para la TDM: describe el uso óptimo de la TDM sola, pero también en combinación con pruebas farmacogenéticas [41,42].
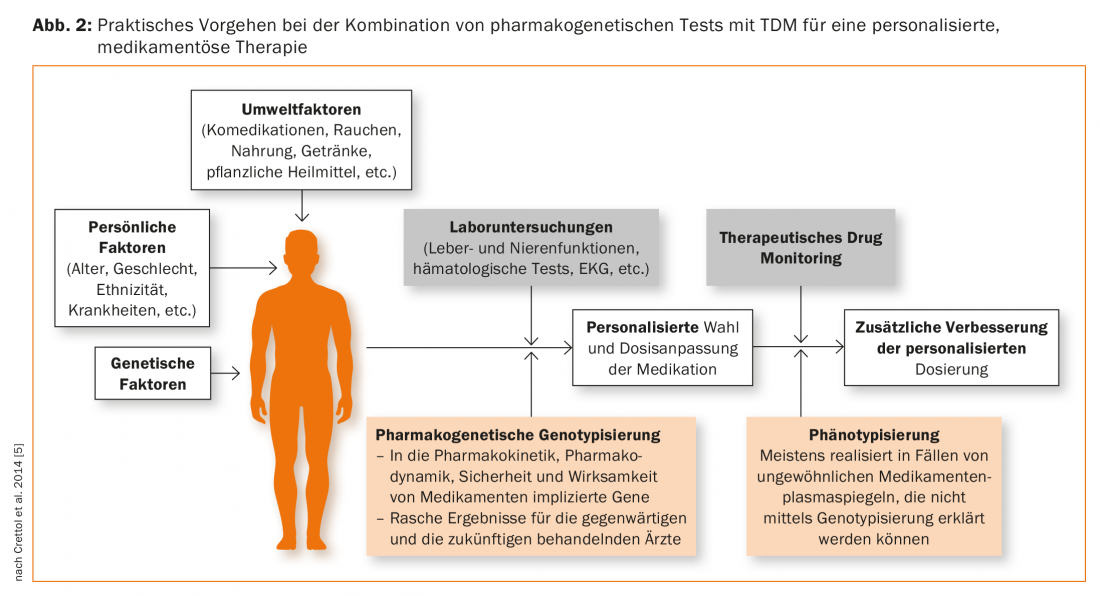
La genotipificación conduce a resultados que tienen validez de por vida y, por lo tanto, representan una especie de “marcador de rasgos”. En cambio, el resultado de un fenotipado, como la determinación de una tasa metabólica, debe considerarse un “marcador de estado”. Para ello, se administra al paciente una sustancia que es el sustrato de la enzima que se va a analizar, después se recoge sangre u orina en función del protocolo y, por lo general, se determinan la sustancia madre y el metabolito. La relación metabolito/sustancia madre proporciona un cociente metabólico, que es una medida de la capacidad de metabolización de la enzima analizada, como se ha ilustrado anteriormente con el ejemplo del debrisoquintest. El resultado puede proporcionar información sobre el perfil genético del paciente, ya que el EM y el PM difieren en el cociente metabólico. Sin embargo, si el paciente se encuentra bajo la influencia de fármacos u otras sustancias extrañas que inhiben o inducen la enzima, esta influencia ambiental enmascara el componente genético del metabolismo de la sustancia de ensayo. En psiquiatría, son frecuentes los siguientes fenotipos: CYP2D6 (dextrometorfano como sustancia de ensayo), CYP2C19 (omeprazol), CYP1A2 (cafeína), CYP2B6 (bupropión), CYP3A (midazolam) [43,44]. El fenotipado es especialmente útil para enzimas como CYP1A2 y CYP3A (CYP3A4), que muestran grandes diferencias interindividuales en su actividad, pero para las que no se conoce ningún polimorfismo genético clínicamente relevante y, por tanto, el genotipado no es útil. Se han sugerido la fexofenadina [44] o la digoxina [45] para el fenotipado de la actividad ABCB1. Dependiendo de la pregunta, pueden administrarse simultáneamente varias muestras de prueba para las diferentes enzimas o transportadores como un “cóctel” [44,45]. El fenotipado es, por tanto, un complemento del TDM y del genotipado (Fig. 2) [46], ya que el resultado proporciona información sobre el estado real de la actividad de la enzima o del transportador en el momento de la prueba [42].
Información como los niveles plasmáticos del fármaco, comedicaciones, comorbilidades, naturaleza de cualquier efecto secundario, información sobre la respuesta terapéutica a la medicación, es útil y necesaria para que el farmacólogo clínico justifique una prescripción. En el caso de las cuestiones farmacogenéticas, los Centros Suizos de Farmacología Clínica y Toxicología ofrecen consultas, y los pacientes pueden ser remitidos a pruebas farmacogenéticas con carácter consultivo.
Conclusiones
Ha llegado el momento de avanzar en la aplicación de las pruebas farmacogenéticas en psicofarmacoterapia. Pueden ser una herramienta valiosa para complementar las investigaciones clínicas, así como el TDM (Fig. 2) . Autoridades como la FDA y la EMA, así como organismos científicos como PharmGKB y CPIC, publican regularmente recomendaciones para el uso clínico de las pruebas farmacogenéticas. Así pues, en la actualidad existen directrices elaboradas por organismos independientes y adecuadas para su uso en la práctica clínica diaria. Promueven la correcta aplicación e interpretación de los resultados de las pruebas farmacogenéticas y, por tanto, una terapia optimizada en función del genotipo [48]. Es importante que el resultado genético se sitúe en el contexto global de la terapia del paciente, es decir, que se tengan en cuenta las influencias no genéticas, como la medicación conjunta, a la hora de ajustar la terapia. Sin embargo, ahora también son necesarias directrices adaptadas regionalmente para permitir una aplicación económica y clínicamente sensata adaptada a las condiciones locales tras la decisión política de hacer que las pruebas farmacogenéticas sujetas a ciertas condiciones estén sujetas al seguro sanitario obligatorio y, por tanto, sean más accesibles. Una aplicación incorrecta puede conducir a resultados decepcionantes y el médico en ejercicio perderá la confianza en la farmacogenómica y la terapia personalizada a medio plazo [49]. Como ya se ha mencionado, el tema de la “farmacogenómica en psiquiatría” debería considerarse cada vez más en la educación y formación de especialistas en psiquiatría y psicoterapia [37–39]. Por lo tanto, hay que esforzarse por fomentar la cooperación entre los psiquiatras y los médicos en ejercicio, por un lado, y los especialistas en farmacología clínica, por otro. Al mismo tiempo, aún quedan muchas cuestiones por resolver, por lo que siguen siendo necesarios estudios clínicos adecuadamente planificados y realizados sobre farmacogenética en particular.
Literatura:
- Alexanderson B, Evans DA, Sjöqvist F: Niveles plasmáticos en estado estacionario de nortriptilina en gemelos: influencia de factores genéticos y del tratamiento farmacológico. British Medical Journal 1969; 4(686): 764-768.
- Mahgoub A, et al: Hidroxilación polimórfica de la debrisoquina en el hombre. Lancet 1977: 584-6.
- González FJ, et al: Caracterización del defecto genético común en humanos deficiente en el metabolismo de la debrisoquina. Nature 1988; 331: 442-446.
- Bertilsson L, et al: Hidroxilación lenta de la nortriptilina y mala hidroxilación concomitante de la debrisoquina: implicaciones clínicas. Lancet 1981; i: 560-561.
- Crettol S, et al: Farmacogenómica en psiquiatría: de la monitorización de fármacos terapéuticos a la medicina genómica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Pratt V, et al: Resúmenes de genética médica. Bethesda (Md), EE.UU.: Centro Nacional de Información Biotecnológica; 2017. 416 p.
- Zhang G, Nebert DW: Medicina personalizada: Predicción genética del riesgo de respuesta a fármacos. Pharmacol Ther 2017; 175: 75-90.
- Relling MV, Evans WE: Farmacogenómica en la clínica. Nature 2015; 526(7573): 343-350.
- Patil J: Farmacogenética y farmacogenómica: una breve introducción. Revista de Farmacovigilancia 2015; 3: e139.
- Sim SC, Ingelman-Sundberg M: Biomarcadores farmacogenómicos: nuevas herramientas en la terapia farmacológica actual y futura. Trends Pharmacol Sci 2011; 32(2): 72-81.
- Dingermann T, Zündorf I: Farmacoterapia estratificada. Fundamentos genéticos, procedimiento práctico. Eschborn, Alemania: Govi; 2017. 339 p.
- Gandal MJ, et al: El camino hacia la psiquiatría de precisión: traducir la genética en mecanismos de enfermedad. Nat Neurosci 2016; 19(11): 1397-1407.
- Lohoff FW, Ferraro TN: Consideraciones farmacogenéticas en el tratamiento de los trastornos psiquiátricos. Expert Opin Pharmacother 2010; 11(3): 423-439.
- Budde M, et al: Aspectos farmacogenómicos del trastorno bipolar: Una actualización. Eur Neuropsychopharmacol 2017; 27(6): 599-609.
- Malhotra AK, Zhang JP, Lencz T: Farmacogenética en psiquiatría: trasladar la investigación a la práctica clínica. Mol Psychiatry 2012; 17(8): 760-769.
- Wolking S, et al: Impacto de los polimorfismos genéticos de ABCB1 (MDR1, glicoproteína P) en la disposición de los fármacos y posibles implicaciones clínicas: actualización de la bibliografía. Farmacocinética clínica 2015; 54(7): 709-735.
- Caudle KE, et al: Estandarización de términos para los resultados de pruebas farmacogenéticas clínicas: términos consensuados del Consorcio de Implementación de Farmacogenética Clínica (CPIC). Genet Med 2017; 19(2): 215-223.
- Hicks JK, et al: Directriz del consorcio de implementación de farmacogenética clínica (CPIC) para los genotipos CYP2D6 y CYP2C19 y la dosificación de antidepresivos tricíclicos: actualización de 2016. Clin Pharmacol Ther 2017; 102(1): 37-44.
- Gasche Y, et al: Intoxicación por codeína asociada a un metabolismo ultrarrápido del CYP2D6. N Engl J Med 2004; 351(27): 2827-2831.
- McCormack M, et al: HLA-A*3101 y reacciones de hipersensibilidad inducidas por carbamazepina en europeos. N Engl J Med 2011; 364(12): 1134-1143.
- de Leon J: Traslación de la farmacogenética a la práctica clínica: ¿necesitan los metabolizadores ultrarrápidos del citocromo P450 2D6 dosis más altas de atomoxetina? J Am Acad Child Adolesc Psychiatry 2015; 54(7): 532-534.
- Whirl-Carrillo M, et al: Conocimientos farmacogenómicos para la medicina personalizada. Clin Pharmacol Ther 2012; 92(4): 414-417.
- McDonagh EM, et al: De la adquisición de conocimientos farmacogenómicos a las aplicaciones clínicas: el PharmGKB como recurso de biomarcadores farmacogenómicos clínicos. Biomark Med 2011; 5(6): 795-806.
- Dickmann LJ, Ware JA: Farmacogenómica en la era de la medicina personalizada. Drug Discov Today Technol 2016; 21-22: 11-6.
- Stingl JC, Brockmoller J, Viviani R: Variabilidad genética de las enzimas metabolizadoras de fármacos: el doble impacto en la terapia psiquiátrica y la regulación de la función cerebral. Psiquiatría Mol 2013; 18(3): 273-287.
- Stingl JC, Brockmoller J: [Farmacogenética personalizada. Directrices basadas en la evidencia y aplicación clínica del diagnóstico farmacogenético]. Bundesgesundheitsblatt, Investigación sanitaria, Protección de la salud. 2013; 56(11): 1509-1521.
- Ravyn D, et al: Estrategias de tratamiento farmacogenético CYP450 para antipsicóticos: una revisión de las pruebas. Schizophr Res 2013; 149(1-3): 1-14.
- Fabbri C, et al: Progresos y perspectivas en la farmacogenética de los fármacos antidepresivos. Expert Opin Drug Metab Toxicol 2016; 12(10): 1157-1168.
- Spina E, de Leon J: Aplicaciones clínicas del genotipado CYP en psiquiatría. J Neural Transm (Viena) 2015; 122(1): 5-28.
- Holsboer-Trachsler E, et al: Traitement aigu des épisodes dépressifs. Foro Médico Suizo 2016; 16(35): 716-724.
- Uhr M, et al: Los polimorfismos en el gen transportador de fármacos ABCB1 predicen la respuesta al tratamiento antidepresivo en la depresión. Neuron 2008; 57(2): 203-209.
- Breitenstein B, et al: Variantes del gen ABCB1 y resultado del tratamiento antidepresivo: Un metaanálisis. Am J Med Genet B Neuropsychiatr Genet 2015; 168B(4): 274-283.
- Breitenstein B, et al: Asociación de variantes del gen ABCB1, concentración plasmática de antidepresivos y respuesta al tratamiento: Resultados de un estudio clínico aleatorizado. J Psychiatr Res 2016; 73: 86-95.
- Bruckl TM, Uhr M: Genotipado ABCB1 en el tratamiento de la depresión. Farmacogenómica 2016; 17(18): 2039-2069.
- Bschor T, et al:[Genetic tests for controlling treatment with antidepressants]. Neurólogo 2017; 88(5): 495-499.
- O’Brien FE, et al: La glicoproteína P humana afecta de forma diferencial al transporte de fármacos antidepresivos: relevancia para la permeabilidad de la barrera hematoencefálica. Int J Neuropsicofarmacol 2013; 16(10): 2259-2272.
- Baumann P, et al: Una propuesta para un catálogo psicofarmacológico-farmacoterapéutico de objetivos de aprendizaje y un plan de estudios en Europa. World J Biol Psychiatry 2017; 18(1): 29-38.
- Whirl-Carrillo M, et al: Novel Disease-Drug Database Demonstrating Applicability for Pharmacogenomic-Based Prescribing. Clin Pharmacol Ther 2016; 100(6): 600-602.
- Collins SL, Carr DF, Pirmohamed M: Avances en la farmacogenómica de las reacciones adversas a los medicamentos. Drug Saf 2016; 39(1): 15-27.
- Green ED, Guyer MS; National Human Genome Research I: Charting a course for genomic medicine from base pairs to bedside. Naturaleza 2011; 470(7333): 204-213.
- Hiemke C, et al: Directrices de consenso de la AGNP para la monitorización de fármacos terapéuticos en psiquiatría: Actualización 2011. Farmacopsiquiatría 2011; 44(6): 195-235.
- Hiemke C, et al: Directrices de consenso para la monitorización terapéutica de fármacos en neuropsicofarmacología: Actualización 2017. Pharmacopsychiatry 2017 Sep 14. doi: 10.1055/s-0043-116492. [Epub ahead of print]
- Hiemke C, Shams M: Fenotipado y genotipado del metabolismo de los fármacos para guiar la farmacoterapia en psiquiatría. Curr drug deliv 2013; 10(1): 46-53.
- Bosilkovska M, et al.: Cóctel de Ginebra para la evaluación de la actividad del citocromo p450 y de la glicoproteína P mediante manchas de sangre seca. Clin Pharmacol Ther 2014; 96(3): 349-359.
- Fuhr U, Jetter A, Kirchheiner J: Procedimientos adecuados de fenotipado de las enzimas metabolizadoras y transportadoras de fármacos en humanos y su uso simultáneo en el enfoque “cóctel”. Clin Pharmacol Ther 2007; 81(2): 270-283.
- Crettol S, et al.: Farmacogenómica en psiquiatría – de la TDM a la medicina genómica. Clin Pharmacol Ther 2014; 95(3): 254-257.
- Baumann P, et al: Crisis epileptiforme tras el tratamiento con sertralina en una adolescente que padecía un trastorno obsesivo compulsivo y presentaba un estado farmacogenético poco frecuente. J Clin Psychopharmacol 2006; 26(6): 679-681.
- Amstutz U, Carleton BC: Pruebas farmacogenéticas: ha llegado la hora de las guías de práctica clínica. Clin Pharmacol Ther 2011; 89(6): 924-927.
- de Leon J: Pruebas farmacogenéticas en psiquiatría: del miedo al fracaso al bombo publicitario. J Clin Psychopharmacol 2016; 36(4): 299-304.
- Mlakar V, et al: Farmacogenómica en oncología pediátrica: revisión de las asociaciones gen-fármaco para uso clínico. Int J Mol Sci 2016; 17(9): 1502.
InFo NEUROLOGÍA Y PSIQUIATRÍA 2017; 15(6): 21-30.