Como parte de Medidays, el programa de formación en medicina interna de una semana de duración del Hospital Universitario de Zúrich (USZ), también se dedicó una tarde a diversos temas oncológicos. En el caso del mieloma múltiple y del linfoma difuso de células B grandes, en los últimos años se han desarrollado nuevos principios activos y modalidades terapéuticas que han mejorado el pronóstico de los pacientes. El resultado del cribado del cáncer es menos positivo: mucho esfuerzo no significa automáticamente mucho éxito.
(ee) El Prof. Dr. med. Bernhard Pestalozzi, Médico Jefe de la Clínica de Oncología del USZ, habló sobre los aspectos contradictorios de las medidas para la detección precoz del cáncer.
Empezó con un caso práctico: usted recibe una llamada de un buen amigo que le cuenta emocionado que ha aparecido un hallazgo sospechoso en la mamografía de cribado de su mujer. ¿Cuál es el riesgo de que este hallazgo incidental corresponda realmente a un carcinoma de mama invasivo?
Reducción relativa y absoluta del riesgo en el cribado del cáncer de mama
Hubo un amplio abanico de opiniones entre el público: algunos dijeron que la probabilidad era del 90%, otros supusieron que del 1%.
De hecho, el riesgo ronda el 10%: De cada 1.000 mujeres que se someten a una mamografía de cribado cada dos años durante diez años, unas 200 tienen que aclarar un hallazgo anormal, lo que conlleva un estrés físico y psicológico. A unas 24 se les acaba diagnosticando cáncer de mama.
Sin embargo, el cáncer de mama tampoco se detecta entre cuatro y siete mujeres, por lo que una mamografía negativa no significa con un 100% de certeza que no haya cáncer de mama. En un grupo de 1000 mujeres no sometidas a cribado, cinco acaban muriendo de cáncer de mama, y en un grupo de 1000 mujeres sometidas a cribado, siguen siendo cuatro.
El riesgo relativo de morir de cáncer de mama se reduce así en un 20% gracias al cribado, pero la reducción del riesgo absoluto es sólo del 0,1% (sólo una de cada 1.000 mujeres cribadas se beneficia realmente de la reducción del riesgo). Las cifras que figuran aquí pueden consultarse en la hoja informativa de la Liga Suiza contra el Cáncer, que aboga por el cribado (https://assets.krebsliga.ch/downloads/1451.pdf).
Estas “malas” cifras de cribado mamográfico mejoran en el caso de las mujeres con un riesgo de cáncer de mama superior a la media y mediante el uso de mejores técnicas de cribado. Por ejemplo, la mamografía 3D detecta un 30% más de carcinomas y la tasa de retirada es un 30% inferior. La resonancia magnética mamaria, que se recomienda a las pacientes con mutaciones BRCA, también tiene una mayor sensibilidad (pero una especificidad aún menor).
Determinación del PSA y cribado del cáncer de intestino: ¿qué tiene sentido?
En el cribado del cáncer de próstata, el balance no parece mejor. De cada 1.000 hombres que se someten a un cribado de PSA cada uno o cuatro años durante diez años, entre 100 y 120 obtienen un resultado falso positivo, es decir, se someten a una biopsia y no tienen cáncer de próstata, pero los efectos secundarios de la biopsia, como el dolor y la ansiedad. Otros 110 son diagnosticados realmente de cáncer de próstata y la mayoría son tratados posteriormente, con los posibles efectos secundarios sobre la continencia urinaria y la función sexual. En conjunto, sin embargo, el cribado de 1000 hombres evita como máximo una muerte por cáncer de próstata. Por lo tanto, la Task Force estadounidense no recomienda el cribado general del PSA. La Sociedad Suiza de Urología recomienda la prueba del PSA sólo para pacientes con antecedentes familiares de cáncer de próstata (a partir de los 45 años) y con la correspondiente solicitud de un hombre informado (entre los 50 y los 70 años).
La situación es más favorable para el cribado del cáncer de colon, que está cubierto por el seguro básico desde junio de 2013. Se reembolsa un análisis de heces cada dos años y/o una colonoscopia cada diez años (para las personas de 50 a 69 años). Existen pruebas fehacientes de que tanto los análisis de heces como la sigmoidoscopia/colonoscopia reducen la incidencia y la mortalidad del cáncer colorrectal. En cuanto a la reducción de la mortalidad mediante el cribado por colonoscopia, hay que extrapolar a partir de los ensayos aleatorios de sigmoidoscopia. Para evitar una muerte por cáncer colorrectal son necesarias entre 300 y 600 colonoscopias de cribado.
Actualización sobre el linfoma difuso de células B grandes
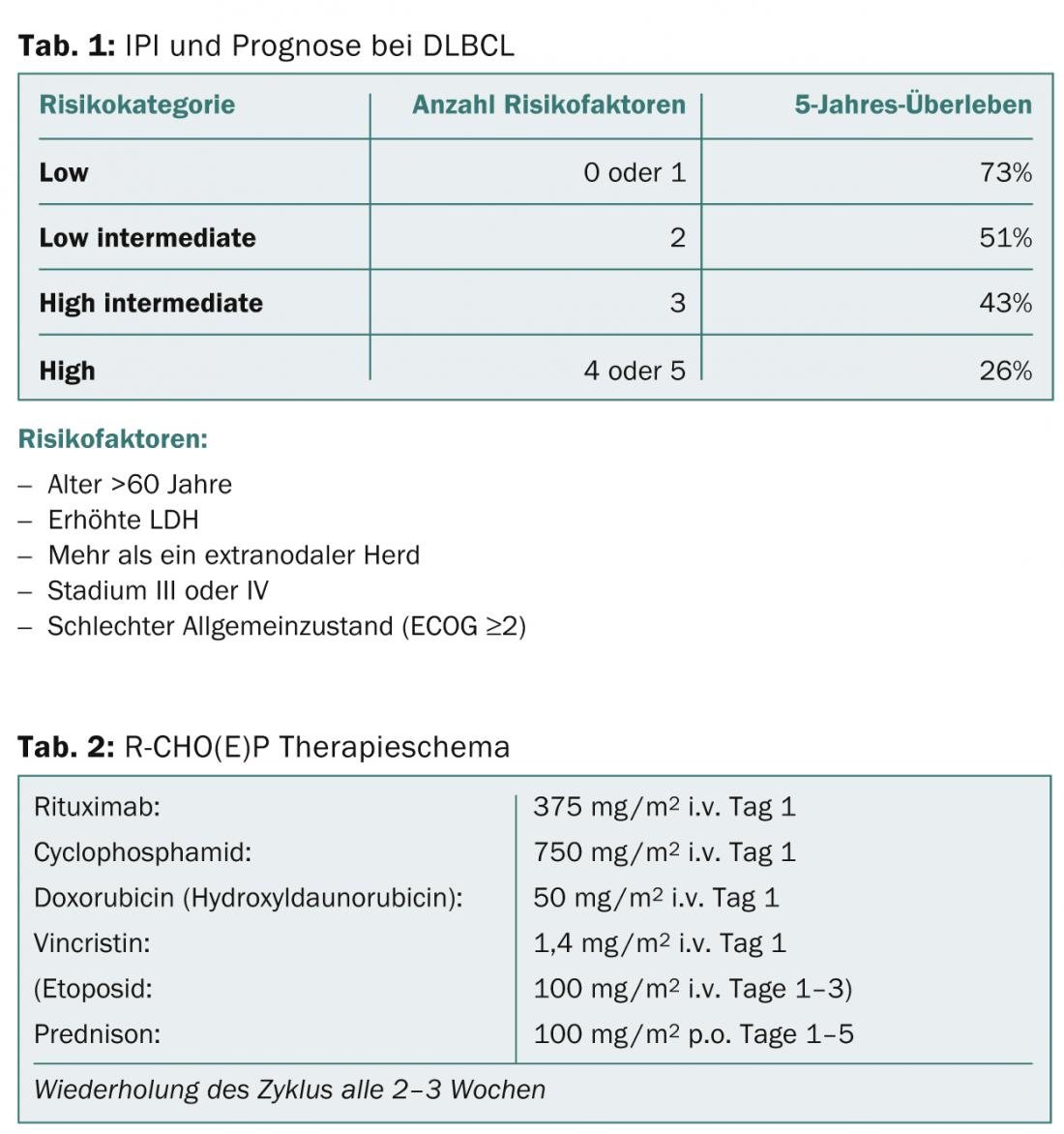
El doctor Panagiotis Samaras, médico jefe del Departamento de Oncología del USZ, ofreció una visión general de dos enfermedades hematológicas comunes: el linfoma difuso de células B grandes (DLBCL) y el mieloma múltiple (MM). El DLBCL es el linfoma más común de todos. El pronóstico y la terapia dependen en gran medida del número de factores de riesgo evaluados por el Índice Pronóstico Internacional (IPI) (Tab. 1). Los pacientes de entre 18 y 60 años con un IPI <2 se consideran jóvenes y de bajo riesgo. Sus tasas de supervivencia superan el 90%. En los pacientes menores de 60 años con un IPI ≥2, clasificados como de alto riesgo, las tasas de supervivencia se sitúan en torno al 50%. Los pacientes son tratados con el régimen R-CHOP (Tab. 2), dependiendo de la edad del paciente y de los factores de riesgo, con un número variable de ciclos (6-8 ciclos son estándar) y, si es necesario, con la adición de etopósido.
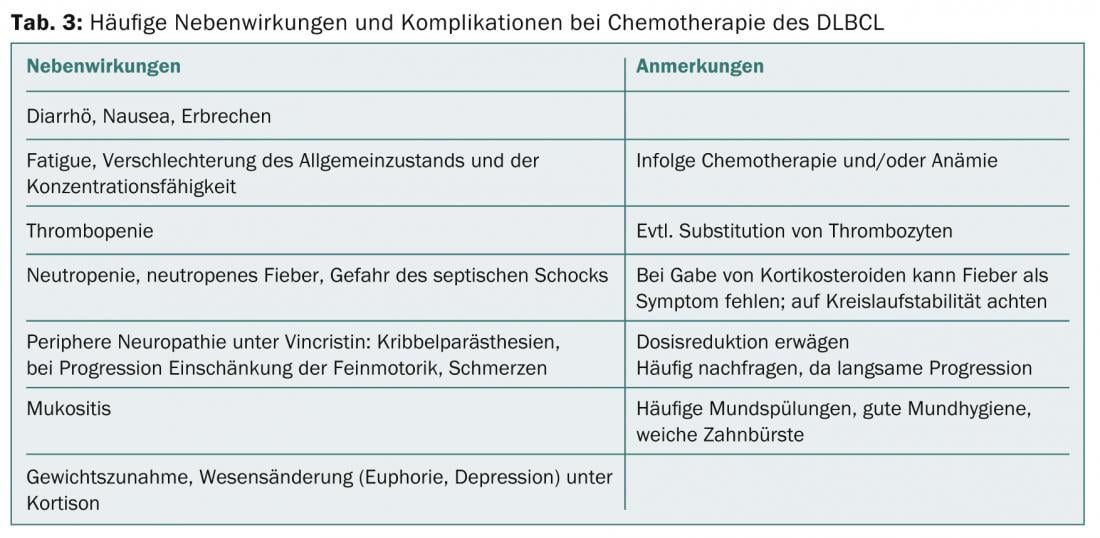
Durante la quimioterapia, cada semana se realiza un chequeo clínico y un control del recuento sanguíneo. En un régimen terapéutico de 14 días, los pacientes reciben antibióticos para controlar la infección y G-CSF para acortar la duración de la neutropenia. En caso de efectos secundarios (tab. 3), ambigüedades o complicaciones, debe informarse al paciente o al médico. el médico de cabecera puede establecer un contacto de bajo umbral con el oncólogo, incluso por la noche o durante el fin de semana. Si se produce una recaída del DLBCL, el trasplante autólogo de células madre es la siguiente opción tras la quimioterapia a dosis altas.
Mieloma múltiple: nuevas opciones de tratamiento
El mieloma múltiple (MM) es la segunda neoplasia más frecuente en hematología. Los hombres se ven afectados con una frecuencia ligeramente superior a la de las mujeres (proporción 1,4:1). Hoy en día, el MM es una enfermedad incurable, pero las terapias adecuadas pueden reducir los síntomas y detener la progresión de la enfermedad. En el MM asintomático (MM “latente”), no hay terapia activa, pero se vigila al paciente (“vigilar y esperar”). El tratamiento está indicado para el MM sintomático (Tabla 4) .

Los síntomas más frecuentes son anemia (73%), lesiones óseas (66%), dolor óseo (58%), insuficiencia renal (19%) e hipercalcemia (11%). Las proteínas monoclonales pueden detectarse en el 97% de los pacientes.
En terapia, se distinguen tres objetivos: Tratamiento agudo para prevenir daños potencialmente mortales (por ejemplo, plasmaféresis para el síndrome de hiperviscosidad o diálisis para la insuficiencia renal), alivio de los síntomas y mejora de la calidad de vida (por ejemplo, radioterapia para fracturas inestables, bifosfonatos, analgesia), y reducción de los síntomas y detención de la progresión (quimioterapia, trasplante de células madre). En los últimos años, las sustancias bortezomib (Velcade®) y lenalidomida (Revlimid®) han mejorado significativamente el pronóstico de los pacientes con MM. En los pacientes más jóvenes, menores de 70 años, existe la opción del trasplante de células madre, que sigue a la terapia de inducción con bortezomib o lenalidomida y la posterior quimioterapia a dosis altas. Posteriormente, se administran dos ciclos más del tratamiento inicial y, en pacientes con un perfil de alto riesgo, se administra una terapia de mantenimiento durante más de un año. En pacientes mayores, la quimioterapia que contiene bortezomib o lenalidomida se administra durante al menos 12-18 meses – la eficacia depende de la duración de la terapia.
Fuente: Medidays, Update Oncology, 3 de septiembre de 2014, Zúrich
InFo ONCOLOGÍA Y HEMATOLOGÍA 2014; 2(8): 32-34