El eje IL23/Th17 desempeña un papel importante en la fisiopatología de la psoriasis. Cada vez hay más pruebas de que los procesos inflamatorios están implicados en muchas enfermedades cardiovasculares y metabólicas asociadas a la psoriasis. Y existen pruebas de que la regulación al alza de la vía IL23/Th17 desempeña un papel importante en las comorbilidades cardiometabólicas de la psoriasis.
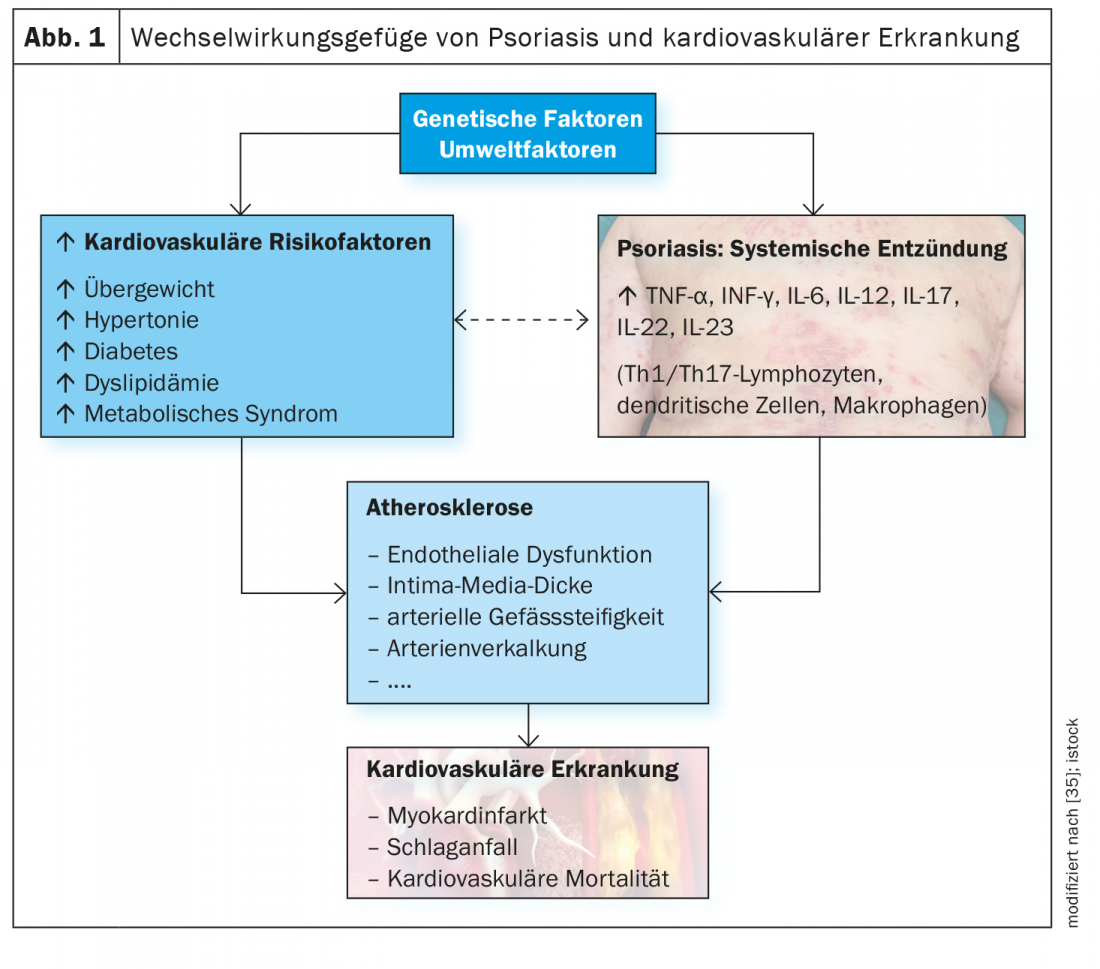
Las enfermedades cardiovasculares y metabólicas se encuentran entre las comorbilidades más comunes de la psoriasis en placas de moderada a grave y contribuyen a aumentar el riesgo de mortalidad [1]. Según datos epidemiológicos, las enfermedades cardiovasculares (ECV) son la causa más frecuente o la segunda causa de muerte en pacientes con psoriasis [2–4]. Especialmente en pacientes con psoriasis grave, el riesgo de episodios cardiovasculares aumenta considerablemente en comparación con la población general (infarto de miocardio: RR 1,70-3,04; ictus: RR 1,38-1,59; mortalidad cardiovascular: 1,37-1,39) [5–8]. Además de los perfiles lipídicos anormales y el estrés oxidativo, se cree que los procesos inflamatorios están implicados en el desarrollo de cambios ateroscleróticos y un aumento asociado del riesgo cardiovascular [9,10]. Cada vez hay más pruebas de que la inflamación crónica y la desregulación inmunitaria desempeñan un papel importante y de que la vía IL23/Th17, entre otras, está implicada.
Enfermedad coronaria
El riesgo de infarto de miocardio como manifestación de enfermedad coronaria (EC) aumenta hasta tres veces en comparación con los no psoriásicos [11–13]. Los polimorfismos genéticos de la IL23-R parecen estar asociados con el riesgo y la gravedad de la aterosclerosis [14,15]. Varios estudios muestran asociaciones entre la IL23 y el infarto de miocardio. Yan et al. pudieron demostrar que la IL23 aumenta fuertemente en los tres días siguientes a un infarto de miocardio, mientras que la IL23-R y la IL17-A están reguladas al alza hasta siete días y la IL17-R hasta 14 días. Basándose en estudios animales (modelo de ratón), se supone que la IL23 de macrófagos y neutrófilos sirve como regulador ascendente de la IL17-A y promueve la producción de células γδT. La IL17-A presumiblemente impulsa la infiltración por neutrófilos así como la fibrosis en el tejido miocárdico. La regulación al alza de la IL23 se asoció con un mayor tamaño del infarto, mayores niveles de biomarcadores típicos de lesión miocárdica (LDH y creatina quinasa), así como respuestas proinflamatorias (aumentos de IL17A, IL6 y TNF-α) y efectos proapoptóticos. Al activar JAK2/STAT3, la IL23 induce la liberación de IL17-A, que en última instancia amplifica la respuesta inflamatoria y el daño miocárdico [16,17]. También se descubrió que la neutralización de la IL23 mediante anticuerpos anti-IL23p19 provocaba una reducción de los niveles de IL17-A y una disminución del deterioro isquémico y de la lesión por reperfusión [16,18].
Enfermedad cerebrovascular
Está bien establecido que los procesos inflamatorios desempeñan un papel importante en la compleja fisiopatología del ictus isquémico, especialmente en la exacerbación del daño cerebral. La aparición de isquemia va acompañada de la activación de la microglía, lo que da lugar a la secreción de citoquinas proinflamatorias (especialmente IL23 e IL12) y mediadores neuroprotectores (IL10) [19]. Entre las células que infiltran el cerebro, los macrófagos participan principalmente en las fases tempranas de los infartos, mientras que los neutrófilos y los linfocitos lo hacen en las fases tardías [20]. La IL23 secretada por macrófagos y células dendríticas promueve la proliferación de células Th17 y γδT y la producción de IL17, lo que contribuye al daño cerebral tras el ictus [21,22]. En estudios experimentales en humanos, se ha demostrado un aumento de los niveles de IL23 acompañado de un aumento de la proporción de células productoras de IL17-A, así como un aumento de los niveles de IL17-A y otras citocinas, en varios momentos tras el ictus en comparación con un grupo de control [15]. Además, se encontró una correlación positiva entre los niveles de IL23 y el volumen de la lesión [15]. El hecho de que se produjera un aumento de los mediadores proinflamatorios simultáneamente con una reducción de las células TReg (células T reguladoras) y de los niveles de IL10 apoya la hipótesis de que el desequilibrio pro y antiinflamatorio es un mecanismo implicado en el ictus y las lesiones cerebrales [24].
El efecto del bloqueo de IL23/IL17 ha sido objeto de varios estudios. Los animales con deficiencia de IL23 tenían niveles significativamente más bajos de células γδT y, en consecuencia, menor secreción de IL17 y menor tamaño del infarto [23]. La supresión específica de la subunidad IL23p19 dio lugar a niveles más bajos de las citocinas proinflamatorias IL23 e IL17, acompañadas de una regulación al alza del factor de transcripción FoxP3 (“forkhead box protein P3”) expresado por la célula TReg. El bloqueo de la subunidad p19 se asoció, entre otras cosas, a una reducción de los infartos y de la disfunción neurológica [21].
Enfermedad oclusiva arterial periférica
La enfermedad arterial periférica (EAP) de las extremidades inferiores es una presentación clínica común en adultos, a menudo debida a la aterosclerosis. Según datos empíricos, el riesgo de PAVK es un 98% mayor en pacientes con psoriasis en comparación con un grupo de control (OR: 1,98; IC 95%: 1,32-2,82). [26] (Fig. 1). Aunque la base de pruebas sobre el papel de la inflamación en la PAOD es más bien escasa, un estudio de casos y controles sugiere una posible implicación de la IL23 al demostrar que los niveles de IL23 de los pacientes con PAOD eran significativamente más altos en comparación con un grupo de control. [27].
Hipertensión
Los estudios epidemiológicos demuestran que la prevalencia de la hipertensión aumenta en los pacientes con psoriasis (OR: 1,58; IC del 95%: 1,42-1,76) y tiene una correlación positiva con la gravedad de la psoriasis [1]. Además, los pacientes con psoriasis tienen una mayor vulnerabilidad a desarrollar hipertensión de difícil control, lo que significa que tienen entre 16,5 y 19,9 veces más probabilidades de necesitar tratamiento con tres o cuatro medicamentos en comparación con los pacientes hipertensos sin psoriasis [28]. Es bien sabido que los procesos inflamatorios desempeñan un papel importante en la patogénesis de la hipertensión, y también se sabe que las células inmunitarias activadas son un factor crítico dentro de esta estructura [29–31]. En particular, también se ha informado en este contexto de la implicación de la vía de señalización IL23/IL17. Las células T y los macrófagos se acumulan en el riñón y en las zonas perivasculares. Las células dendríticas activan las células T, que promueven la diferenciación Th17 mediante la secreción de IL6, TNF-α e IL23, entre otras. La producción de IL17-A estimulada por la activación Th17 parece ser un factor crítico en la disfunción vascular y el mantenimiento de la hipertensión [31–33]. Dado que un desequilibrio de Th17 y TReg es un factor fisiopatológicamente relevante para las enfermedades cardiovasculares, Liu et al. investigado si el uso de fármacos antihipertensivos tiene un efecto sobre esta vía [34]. Descubrieron que los pacientes tratados con una combinación de telmisartán y rosuvastatina mostraban una reducción sinérgica de los factores proinflamatorios séricos, como la IL23, las células Th17 y la IL17-A, y un aumento de los factores antiinflamatorios, como la TReg, la FoxP3 y la IL10 [34].
|
Resumen El eje IL23/Th17 desempeña un papel importante en la fisiopatología de la psoriasis. La regulación al alza de esta vía, junto con otras citocinas inflamatorias (por ejemplo, el TNF y el IFN de tipo I), contribuye al desarrollo de un “estado proinflamatorio” crónico en la psoriasis. Cada vez hay más pruebas que sugieren que los procesos inflamatorios, a través de diversos mediadores y vías, están implicados en varias enfermedades cardiovasculares (por ejemplo, cardiopatías coronarias, hipertensión) y trastornos metabólicos crónicos (por ejemplo, obesidad, hígado graso no alcohólico) que son prevalentes en la psoriasis. Los datos sugieren que la regulación al alza de la vía IL23/Th17 en combinación con un estilo de vida desfavorable es una posible explicación de muchas comorbilidades cardiometabólicas en la psoriasis. Aún quedan muchas preguntas abiertas sobre las implicaciones terapéuticas de estos hallazgos. En cuanto a la hipótesis de que los anticuerpos monoclonales altamente específicos utilizados para el tratamiento de la psoriasis también tienen un efecto sobre el curso de las comorbilidades, la base de pruebas es aún pequeña. Se necesitan más estudios para comprender mejor estas relaciones. Según los conocimientos actuales, las comorbilidades de los pacientes con psoriasis deben seguir tratándose con las respectivas terapias estándar. |
Literatura:
- Takeshita J, et al: Psoriasis y enfermedades comórbidas: epidemiología. J Am Acad Dermatol 2017; 76: 377-390.
- Salahadeen E, et al: Nationwide population-based study of cause-specific death rates in patients with psoriasis. J Eur Acad Dermatol Venereol 2015; 29: 1002-1005.
- Svedbom A, et al: Mayor mortalidad por causas específicas en pacientes con psoriasis leve y grave: un estudio de registro sueco basado en la población. Acta Derm Venereol 2015; 95: 809-815.
- Lee M-S, Yeh Y-C, Chang Y-T, Lai M-S: All-cause and cause-specific mortality in patients with psoriasis in Taiwan: a Nationwide Population-based Study. J Invest Dermatol 2017; 137: 1468-1473.
- Armstrong EJ, Harskamp CT, Armstrong AW: Psoriasis y principales acontecimientos cardiovasculares adversos: revisión sistemática y metaanálisis de estudios observacionales. J Am Heart Assoc 2013; 2: e000062.
- Samarasekera EJ, et al: Incidencia de la enfermedad cardiovascular en individuos con psoriasis: una revisión sistemática y metaanálisis. J Invest Dermatol 2013; 133: 2340-2346.
- Raaby L, Ahlehoff O, de Thurah A: Psoriasis y eventos cardiovasculares: actualización de las pruebas. Arch Dermatol Res 2017; 309: 225-228.
- Mehta NN, et al: Estimación del riesgo atribuible de la psoriasis grave sobre los principales eventos cardiovasculares. Am J Med 2011; 124: 775. e1-6.
- Zhou Q, Mrowietz U, Rostami-Yazdi M: El estrés oxidativo en la patogénesis de la psoriasis. Free Radic Biol Med 2009; 47: 891-905.
- Asha K, et al: Dislipidemia y estrés oxidativo en pacientes de psoriasis: factores de riesgo cardiovascular emergentes. Indian J Med Res 2017; 146: 708-713.
- Furue M, et al: Enfermedades cardiovasculares y metabólicas comórbidas con la psoriasis: más allá de la piel. Intern Med Tokyo Jpn 2017; 56: 1613-1619.
- Hjuler KF, et al: Mayor prevalencia de la enfermedad arterial coronaria en la psoriasis grave y la dermatitis atópica grave. Am J Med 2015; 128: 1325-1334.e2.
- Mahiques-Santos L, et al: Psoriasis and ischemic coronary artery disease. Actas Dermosifiliogr 2015; 106: 112-116.
- Zhang M, et al: Polimorfismos funcionales en el receptor de interleucina-23 y susceptibilidad a la enfermedad arterial coronaria. DNA Cell Biol 2014; 33: 891-897.
- Kave M, Shadman M, Alizadeh A, Samadi M: Análisis de la asociación entre el polimorfismo IL-23R rs11209026 y la incidencia de la aterosclerosis. Int J Immunogenet 2015; 42: 341-345.
- Hu X, Ma R, Lu J et al: La IL-23 favorece la lesión miocárdica por I/R al aumentar las respuestas inflamatorias y las reacciones de estrés oxidativo. Cell Physiol Biochem 2016; 38: 2163-2172.
- Liao Y, et: Los efectos favorecedores de la IL-23 sobre la isquemia miocárdica y la reperfusión se asocian a un aumento de la expresión de IL-17A y a la regulación al alza de la vía de señalización JAK2-STAT3. Mol Med Rep 2017; 16: 9309-9316.
- Zhu H, et al: El eje Hmgb1-TLR4-IL-23-IL-17A promueve la lesión por isquemia-reperfusión en un modelo de trasplante cardíaco. Trasplante 2013; 95: 1448-1454.
- Zhao S-C, et al: Regulación de la activación microglial en el ictus. Acta Pharmacol Sin 2017; 38: 445-458.
- Ma S, et al: Efecto inmunomodulador de las células estromales de médula ósea (BMSC) en el ictus isquémico mediado por interleucina (IL)-23/IL-17 en ratones. J Neuroimmunol 2013; 257: 28-35.
- Zheng Y, et al.: Papel fundamental de la interleucina-23 cerebral durante la lesión inmunológica en la isquemia cerebral retardada en ratones. Neurociencia 2015; 290: 321-331.
- Brait VH, et al: Importancia de los linfocitos T en la lesión cerebral, la inmunodeficiencia y la recuperación tras la isquemia cerebral. J Cereb Blood Flow Metab 2012; 32: 598-611.
- Gelderblom M, et al: Las células dendríticas convencionales productoras de IL-23 (interleucina-23) controlan la respuesta perjudicial de IL-17 (interleucina-17) en el ictus. Ictus 2018; 49: 155-164.
- Hu Y, Zheng Y, Wu Y, Ni B, Shi S: Desequilibrio entre las células productoras de IL-17A y las células T reguladoras durante el ictus isquémico. Mediadores Inflamm 2014; 2014: 813045.
- Jiang C, et al: Cambios en el sistema inmunitario celular y en los marcadores inflamatorios circulantes de los pacientes con ictus. Oncotarget 2016; 8: 3553-3567.
- Prodanovich S, et al: Asociación de la psoriasis con las enfermedades coronarias, cerebrovasculares y vasculares periféricas y la mortalidad. Arch Dermatol 2009; 145: 700-703.
- David A, et al: Niveles séricos de interleucina-23 en pacientes afectados por enfermedad arterial periférica. Clin Biochem 2012; 45: 275-278.
- Armstrong AW, et al: Psoriasis y gravedad de la hipertensión: resultados de un estudio de casos y controles. PLoS ONE 2011; 6: e18227.
- Coffman TM: Bajo presión: la búsqueda de los mecanismos esenciales de la hipertensión. Nat Med 2011; 17: 1402-1409.
- Kirabo A, et al. Las proteínas isoketales modificadas de la DC activan las células T y favorecen la hipertensión. J Clin Invest 2014; 124: 4642-4656.
- Dixon KB, Davies SS, Kirabo A: Células dendríticas e isolevuglandinas en la inmunidad, la inflamación y la hipertensión. Am J Physiol Heart Circ Physiol 2017; 312: H368-H374.
- Loperena R, et al: Hypertension and increased endothelial mechanical stretch promote monocyte differentiation and activation: roles of STAT3, interleukin 6 and hydrogen peroxide. Cardiovasc Res 2018; 114: 1547-1563.
- Madhur MS, et al: La interleucina 17 favorece la hipertensión y la disfunción vascular inducidas por la angiotensina II. Hypertens Dallas Tex 1979; 2010; 55: 500-507.
- Liu Z, et al: El tratamiento con la combinación telmisartán/rosuvastatina tiene un efecto sinérgico beneficioso en la mejora del desequilibrio funcional Th17/Treg en pacientes hipertensos con aterosclerosis carotídea. Aterosclerosis 2014; 233: 291-299.
- Torres T, Bettencourt N: Psoriasis: el asesino visible. Rev Port Cardio 2014; 33 : 95-99.
Para saber más:
- Egeberg A, et al: El papel de la vía interleucina-23/Th17 en la comorbilidad cardiometabólica asociada a la psoriasis. JEADV 2020; 34(8): 1695-1706, https://onlinelibrary.wiley.com/doi/10.1111/jdv.16273
PRÁCTICA DERMATOLÓGICA 2020; 30(6): 30-32