En el Congreso de la ESMO celebrado en Ámsterdam se presentaron estrategias prácticas para la gestión del tratamiento del carcinoma de células renales metastásico (CCRm). Se debatieron las actualizaciones de los ensayos clínicos actuales y los beneficios de las nuevas opciones de tratamiento a la luz de las modalidades de tratamiento actuales, que aún necesitan mejoras. Se presentaron diferentes mecanismos de acción.
(ag) El Dr. Christian Kollmannsberger, de la Universidad de Columbia Británica (Canadá), inauguró el simposio con una visión general del tratamiento actual del carcinoma metastásico de células renales (mRCC): “Hemos avanzado mucho en la terapia de esta enfermedad. Comprendemos mejor los procesos biológicos subyacentes y podemos así dirigirnos a las vías pertinentes [1]. Sin embargo, el enfoque terapéutico actual no es curativo, es decir, no podemos curar la enfermedad [2]. La mediana de supervivencia libre de progresión es de 8-12 meses en el escenario de primera línea. Tras la administración de inhibidores del VEGF, la mediana es de cuatro a cinco meses en el escenario de segunda línea. Por ello, en estos momentos se están desarrollando nuevas estrategias para optimizar la terapia basadas en una mejor comprensión de las vías moleculares implicadas en la resistencia a los fármacos.”

¿Cuál debe ser el objetivo de la terapia?
El carcinoma de células renales claras (CCRc) es, con diferencia, la forma más común de todos los CCR y representa alrededor del 75% de los casos. A su vez, esta enfermedad presenta casi siempre (90% de los CCRm) una característica genética, a saber, una mutación en el gen supresor de tumores Von Hippel-Lindau (VHL) [3]. El eje VHL/HIF parece ser crucial en el ccRCC: la proteína VHL inactivada (pVHL) ya no puede desempeñar correctamente sus funciones. En ocasiones, esto desregula la expresión de HIFα, que a su vez estimula diversos factores de crecimiento (FCR) y contribuye así de manera fundamental a la patogénesis del CCRm. Un factor de crecimiento conocido desde hace mucho tiempo es el VEGF [4].
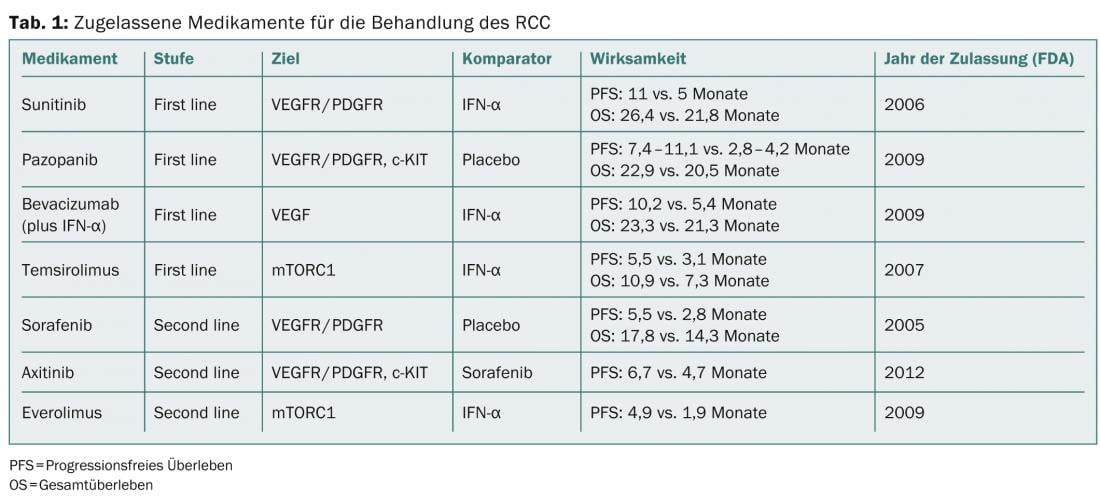
Los agentes que interfieren con uno o más mecanismos de la sobreexpresión de HIFα o sus efectos, por ejemplo inhibiendo un FG, se han investigado en diversos estudios y también están aprobados en Suiza. En la tabla 1 se muestra una lista de los fármacos actualmente disponibles en el tratamiento del CCR.
Resistencia
“Sin embargo, con los fármacos antiangiogénicos se produce tarde o temprano una resistencia adaptativa o intrínseca. La primera forma se desarrolla en el curso del tratamiento, mientras que la segunda ya existía desde el principio”, explicó Kollmannsberger. “Así que o bien los pacientes experimentan primero un beneficio y sólo después la progresión de la enfermedad. Este es el caso de aproximadamente el 80% de los pacientes. O no responden en absoluto a la terapia y se enfrentan a un rápido deterioro y a un mal pronóstico. Esto le ocurre a alrededor del 20% de los pacientes”.
La resistencia adaptativa (evasiva) puede observarse con mayor frecuencia en la práctica clínica diaria. Los mecanismos de estas resistencias están cada vez más claros. Varios procesos parecen estar implicados en la forma intrínseca:
- Es posible que el tumor tenga vías de señalización proangiogénicas supernumerarias desde el principio. Éstas podrían mantener aún más la angiogénesis, incluso tras la inhibición de la señalización del VEGF.
- Además, la presencia de células mieloides productoras de factores proangiogénicos podría contribuir a la resistencia intrínseca.
Si los tumores se vuelven progresivos tras el éxito inicial del tratamiento (resistencia adaptativa), interviene la regulación al alza de los factores proangiogénicos, por ejemplo a través de nuevas vías de señalización o el uso de ligandos alternativos del VEGF. El tumor se adapta a la inhibición de la angiogénesis, lo que también puede significar que utilice la vasculatura normal de los tejidos circundantes para depender menos de la señalización del VEGF.
Las posibilidades para contrarrestar la resistencia son las siguientes [5]:
Ajuste de la dosis: Se está debatiendo si el aumento gradual de la dosis es una terapia opcional de segunda línea. Sin embargo, parece observarse un beneficio sólo en aquellos pacientes que toleran las dosis más altas.
Terapia combinada: En el futuro, podría ser posible combinar diferentes fármacos dirigidos a las diversas vías implicadas en la angiogénesis, como VEGFR, PI3K y mTORC1/2 [6]. Sin embargo, podrían producirse problemas de toxicidad.
Cambio a un principio activo diferente: Se estudia la posibilidad de cambiar a un principio activo que tenga el mismo mecanismo de acción o uno diferente. Porque: la resistencia cruzada no siempre es de esperar.
¿Y ahora qué?
“La respuesta terapéutica en el CCRm no es duradera, por lo que los pacientes acaban recayendo con los tipos de tratamiento dirigido disponibles en la actualidad”, resumió Kollmannsberger. “Esto hace que sea aún más importante disponer de una lógica de secuencia adecuada en la administración de los fármacos aprobados. Esto puede aumentar el éxito de la terapia. Actualmente se están investigando nuevos agentes activos dirigidos a diferentes vías que intervienen en esta enfermedad y en su elevada resistencia.
“Los tumores desarrollan vías de señalización alternativas para reiniciar la angiogénesis, por ejemplo la vía del FGF. Si esto se aborda eficazmente, por ejemplo con un inhibidor de la tirosina quinasa (TKI), el resultado pueden ser unas tasas de supervivencia más prolongadas. Los estudios muestran un posible beneficio de la terapia de tercera línea para los pacientes con progresión. Se están llevando a cabo nuevas investigaciones en este ámbito. También se están investigando las inmunoterapias en relación con la resistencia a las terapias”, concluyó la serie de conferencias el Dr. med. Viktor Grünwald, de la Facultad de Medicina de Hannover.
Fuente: Congreso de la ESMO, del 27 de septiembre al 1 de octubre de 2013, Ámsterdam
Literatura:
- Rini BI: Nuevas estrategias en el cáncer renal: avances terapéuticos a través de la comprensión de las bases moleculares de la respuesta y la resistencia. Clin Cancer Res 1 de marzo 2010; 16: 1348-1354; Publicado OnlineFirst 23 de febrero 2010; doi:10.1158/1078-0432.CCR-09-2273.
- Sonpavde G, Choueiri TK: Biomarcadores: el próximo obstáculo terapéutico en el carcinoma metastásico de células renales. Br J Cancer 2012 Sep 25; 107(7): 1009-1016. doi: 10.1038/bjc.2012.399. Epub 2012 Sep 4.
- Audenet F, et al: Vías genéticas implicadas en la carcinogénesis del carcinoma de células renales de células claras: genómica hacia la medicina personalizada. BJU Int 2012 Jun; 109(12): 1864-1870. doi: 10.1111/j.1464-410X.2011.10661.x. Epub 2011 Oct 28.
- Shen C, Kaelin WG: El eje VHL/HIF en el carcinoma renal de células claras. Semin Cancer Biol 2013 feb; 23(1): 18-25. doi: 10.1016/j.semcancer.2012.06.001. Epub 2012 Jun 13.
- Ravaud A, Gross-Goupil M: Superación de la resistencia a los inhibidores de la tirosina cinasa en el carcinoma de células renales. Cancer Treat Rev 2012 dic; 38(8): 996-1003. doi: 10.1016/j.ctrv.2012.01.003. Epub 2012 Feb 12.
- Figlin RA, et al: Targeting PI3K and mTORC2 in metastatic renal cell carcinoma: new strategies for overcoming resistance to VEGFR and mTORC1 inhibitors. Int J Cancer 2013 Ago 15; 133(4): 788-796. doi: 10.1002/ijc.28023. Epub 2013 Feb 12.
InFo Oncología y Hematología 2014; 2(1): 42-44











