La rotura de un aneurisma de aorta abdominal (rBAA) puede tratarse de forma abiertamente quirúrgica o mínimamente invasiva, es decir, endovascular. Las entusiastas historias de éxito sugieren que la nueva técnica endovascular ha supuesto por fin un gran avance en la reducción de la mortalidad estancada. Sin embargo, un análisis más detallado muestra que se pueden conseguir resultados igual de buenos con ambas técnicas. Así pues, el pronóstico de la rBAA parece estar determinado principalmente por factores relacionados con la constitución del paciente y el tratamiento perioperatorio. Dos ventajas clave de la sustitución aórtica abierta son que puede realizarse en cualquier lugar en el que se disponga de un equipo cualificado y que no depende de una infraestructura especializada. Además, puede utilizarse independientemente de las condiciones anatómicas. Por lo tanto, la sustitución aórtica abierta debe seguir siendo la norma de referencia para la rBAA mientras no se haya demostrado la superioridad de una técnica concreta de forma científica limpia y sin prejuicios, o no se disponga de conocimientos especializados.
El aneurisma aórtico abdominal (AAB) es una enfermedad del varón que envejece y suele desarrollarse en la base de la aterosclerosis. El aumento de tamaño suele ser gradual (3 mm/año de media), por lo que la mayoría de los BAA permanecen asintomáticos durante mucho tiempo, aunque la tensión de la pared aumenta con el incremento del diámetro y la pared del vaso se adelgaza. La consecuencia temida es la rotura, que se asocia a una elevada mortalidad. Los estudios epidemiológicos sugieren que la prevalencia del BAA ha ido disminuyendo lentamente desde 1999 (actualmente se sitúa en torno al 2,2% en hombres mayores de 65 años ) [1]. Paralelamente, la incidencia de la rotura está disminuyendo, principalmente porque cada vez menos personas fuman y los pacientes cada vez más mayores se someten a cirugía electiva antes de que estalle el BAA [2]. Por el contrario, la mortalidad perioperatoria en caso de rotura apenas ha disminuido (sigue siendo del 30-50% de media) [3, 4], lo que resulta sorprendente teniendo en cuenta otros avances en los cuidados perioperatorios de los pacientes.
Sustitución aórtica abierta y endovascular: dos alternativas de tratamiento
Hoy en día, los BAA intactos se tratan prácticamente en todas partes de una de estas dos maneras: La sustitución aórtica abierta mediante una prótesis de plástico (Dacron o ePTFE) se realiza desde hace unos 60 años y es una técnica probada con una excelente durabilidad a largo plazo. La sustitución aórtica endovascular (EVAR) mediante una prótesis stent-graft está disponible como alternativa mínimamente invasiva desde hace unos 15 años.
Los primeros ensayos aleatorizados han demostrado sistemáticamente que la EVAR puede reducir la mortalidad perioperatoria hasta en un factor de 3 en comparación con la cirugía abierta [5–7]. Sin embargo, ninguno de estos estudios mostró un beneficio de supervivencia a largo plazo y, por su naturaleza, los resultados de los estudios sólo se aplican a los aneurismas que presentan una morfología favorable en las imágenes. A pesar de estas limitaciones, los resultados electivos sugieren que un beneficio de supervivencia perioperatoria de la EVAR puede ser particularmente importante en los BAA rotos. Y, de hecho, esta suposición parece confirmada por metaanálisis de series de casos (principalmente no controlados) que sugieren una reducción de la mortalidad de una media del 40% al 20% [8]. Sin embargo, en primer lugar, los pacientes de estas series se seleccionaron de forma diferente y, en segundo lugar, las comparaciones aleatorias (que, por cierto, ¡sólo examinaron a pacientes aptos para la EVAR!) no han mostrado hasta ahora diferencias de mortalidad entre la sustitución aórtica abierta y la endovascular. En el primer ensayo aleatorizado, muy pequeño, la mortalidad fue idéntica, del 53% [9]; en el ensayo más amplio AJAX (tratamiento endovascular agudo para mejorar los resultados de los aneurismas aortoilíacos rotos), aparentemente no hubo diferencias estadísticamente significativas en ninguno de los dos [10]. Sin embargo, la publicación de este estudio aún está pendiente.
La EVAR electiva difiere fundamentalmente de la EVAR de urgencia en caso de rotura en al menos tres aspectos. En primer lugar, ésta, por su propia naturaleza, no puede planificarse de antemano. Esto significa la provisión permanente de experiencia, infraestructura y un surtido de injertos de endoprótesis. Dado que sólo el 50-60% de los BAA rotos son anatómicamente aptos para la EVAR [8], no puede ahorrarse el respaldo quirúrgico abierto. En segundo lugar, a veces es necesario un balón aórtico suprarrenal para controlar una hemorragia aguda, lo que puede provocar una isquemia visceral cuyas consecuencias deletéreas pasan fácilmente desapercibidas. En tercer lugar, el lugar de la rotura aórtica impide que la compartimentación del saco del aneurisma provoque que las arterias lumbares que vuelven a sangrar causen un síndrome compartimental abdominal [11]. En este contexto, las dudas sobre una relación causal entre el método (técnico) de tratamiento y el riesgo de mortalidad perioperatoria son apropiadas.
Este artículo pretende ilustrar la importancia de otras estrategias de tratamiento (independientes) que han recibido poca atención hasta ahora. Es importante que los conceptos sean independientes de una infraestructura técnica compleja, para que puedan aplicarse en todas partes, al menos en teoría.
Factores clave del éxito del tratamiento rBAA
La importancia pronóstica de los distintos aspectos del tratamiento se investigó recientemente en una serie homogénea de pacientes consecutivos de un único centro que garantizaba la atención de aproximadamente 1,5 millones de habitantes [8, 12, 13]. La cohorte estaba predestinada a este tipo de análisis en la medida en que prácticamente todos los pacientes fueron tratados de la misma manera (es decir, mediante cirugía abierta). Esto reduce la influencia perturbadora de la selección del método y la selección del paciente. En concreto, todos los pacientes tratados por rBAA entre enero de 2001 y diciembre de 2012 fueron incluidos en un registro prospectivo de datos [8, 12, 13].
Se analizaron sin seleccionar todos los aneurismas en los que se detectó sangre en las imágenes o se encontró intraoperatoriamente fuera de la pared del vaso (es decir, aneurismas verdaderos, pseudoaneurismas y aneurismas micóticos, cada uno de ellos localizado yuxta o infrarrenal y/o ilíaco). Los pacientes de la primera década (2001-2010) se han estudiado con más detalle en varios trabajos(Fig. 1) [8, 12, 13]. Casi todas (97%) se sometieron a cirugía abierta, y las supervivientes fueron seguidas durante un periodo medio de 3,2 años (rango intercuartílico [iqr] 1,1-5,4 años).

Fig. 1: El diagrama muestra el flujo de pacientes desde enero de 2001 hasta finales de 2012. Utilizando datos de la década de 2001 a finales de 2010 (n=248 pacientes), se realizaron análisis por separado para estimar la influencia de diversos factores preoperatorios en la supervivencia de los pacientes con un AAB roto.
La mortalidad perioperatoria (definida como la mortalidad a los 30 días; esta información se conocía en todos los pacientes) de toda la serie (n=293) fue del 14,7%. Sólo al 10% de los pacientes no se les había ofrecido el tratamiento por diversas razones. Esto significa que los resultados de esta serie de pacientes no seleccionados son al menos tan buenos como los de la mejor serie de EVAR publicada [14], sobre todo teniendo en cuenta que esta última sólo informa de pacientes cuidadosamente seleccionados. En los 248 pacientes de la primera década, que se describen con más detalle a continuación, la tasa de mortalidad a los 30 días se situó en un rango comparable, con un 15,3%. Las características del paciente y del aneurisma, así como la información quirúrgica y perioperatoria se registran en la tabla 1.
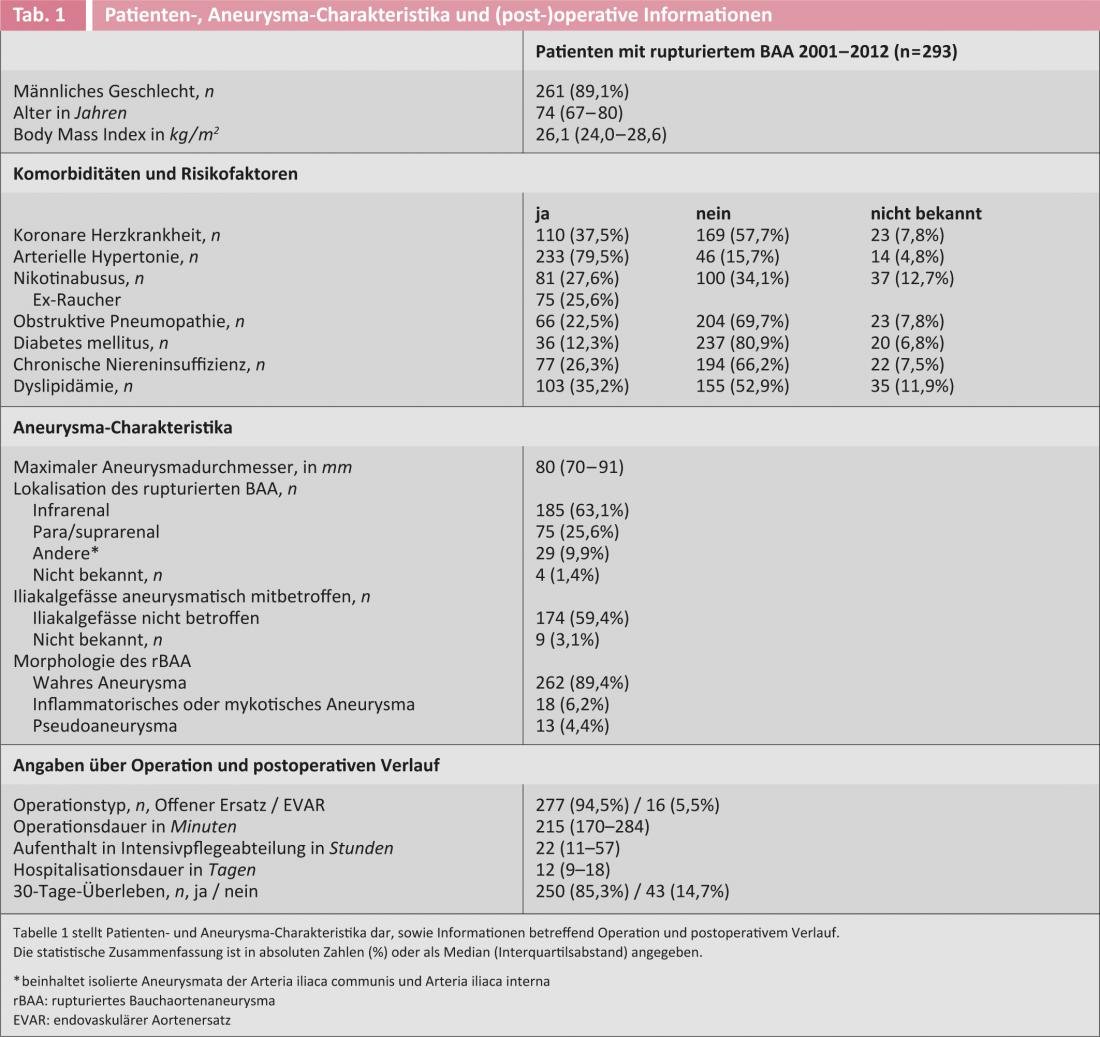
¿”Anatomía aórtica favorable” como explicación?
Mientras no se demuestre un efecto causal en experimentos aleatorios, el beneficio de supervivencia de la EVAR observado en los metaanálisis puede explicarse básicamente de dos maneras:
- o bien (a) la EVAR es efectivamente conceptualmente superior en la rBAA (=efecto causal),
- o (b) en los pacientes que reúnen los requisitos para una EVAR de urgencia, existe una ventaja de supervivencia independiente (= sesgo de selección).
Si la variante (b) fuera correcta, los pacientes aptos para la EVAR también deberían obtener mejores resultados tras la sustitución aórtica abierta que los pacientes no aptos para la EVAR. En la cohorte de rBAA anterior, todos los casos fueron clasificados como “elegibles para EVAR”, “no elegibles para EVAR” o “no evaluables” por dos investigadores independientes según criterios predefinidos [8]. El resultado fueron las siguientes categorías ordinales y una categoría adicional: (1) “EVAR-apta” (cuando ambos investigadores estaban de acuerdo), (2) “cuestionablemente apta” (cuando no estaban de acuerdo), (3) “EVAR-no apta” (cuando ambos estaban de acuerdo) y (4) “no categorizable”. En consonancia con informes anteriores, (¡de estos pacientes operados abiertamente!) el 54% (n=133) se clasificaron como aptos para EVAR (28% “aptos para EVAR” y 26% “cuestionablemente aptos”) y el 40% (n=100) como “no aptos para EVAR”. El 6% restante (n=15) no pudo clasificarse, por ejemplo, debido a que faltaban TC.
La mortalidad a 30 días siguió las categorías ordinales de forma impresionante [8]: los pacientes “EVAR-elegibles” tenían un riesgo de muerte del 4%, los “cuestionablemente elegibles” del 16% (odds ratio [OR] 4,73 [95% Konfidenzintervall [KI] 1,13-19,77; p=0,033]) y los “EVAR-no elegibles” del 24% (OR 8,03 [IC 95% 2,06-31, 34; p=0,003]) como categoría de referencia. Los resultados se corrigieron en función de los posibles factores de confusión y se mantuvieron sin cambios en los análisis de sensibilidad, por ejemplo, cuando los pacientes no categorizables se asignaron sucesivamente a cada categoría. Por lo tanto, el efecto positivo de una anatomía favorable parece ser realmente independiente de la técnica de tratamiento y de otros factores influyentes y muy sólido. Así pues, la anatomía explica al menos parte de la diferencia observada entre la EVAR (selección de pacientes anatómicamente favorables) y la sustitución aórtica abierta (según el centro, los pacientes tienden a no ser aptos para la EVAR, ya que los pacientes anatómicamente favorables son tratados mediante EVAR).
Pacientes quirúrgicos de “alto riesgo
Los modelos tradicionales de estratificación del riesgo quirúrgico, como la puntuación de Hardmann, sugieren que los pacientes mayores con rBAA (por ejemplo, mayores de 75-80 años) presentan un riesgo quirúrgico prohibitivamente alto y deben ser rechazados para una sustitución aórtica abierta de urgencia. En teoría, la EVAR podría ofrecer una ventaja decisiva en estos pacientes. Sin embargo, sabemos por el estudio de la EVAR (¡electiva!) 2 que la EVAR no es beneficiosa en pacientes inoperables quirúrgicamente [15]. En la cohorte de rBAA estudiada, se abordó la cuestión de si la edad avanzada per se tiene un impacto tan negativo en la mortalidad perioperatoria como para justificarla como motivo de rechazo.
El 24% de los pacientes (n=60) eran mayores de 80 años. Como era de esperar, la mortalidad a los 30 días en el análisis bivariante fue mayor en estos pacientes (26,7% frente a 11,7%; p=0,007). Sin embargo, en los análisis multivariantes que corrigieron el resultado en función de los factores de confusión, la edad avanzada perdió su desventaja estadísticamente independiente (la OR para morir perioperatoriamente fue de 2,1 [IC 95%: 0,9-5,2; p=0,099]). El efecto negativo de la edad se debió principalmente a que los pacientes de más edad también padecían con más frecuencia enfermedades coronarias, lo que a su vez se asoció a una mayor mortalidad. Esto también concuerda con el hecho de que, dentro del grupo de pacientes de mayor edad, un índice de shock >1 (en el sentido de reserva cardiaca limitada) fue el factor predictivo más importante de una mayor mortalidad [12]. Curiosamente, los pacientes que sobrevivieron a los primeros 30 días tenían el mismo pronóstico de supervivencia que la población general ajustada por edad, sexo y año natural – e independientemente de la edad en el momento de la cirugía de rBAA [12].
Por lo tanto, la edad avanzada por sí sola no es un criterio válido de exclusión de la sustitución aórtica de urgencia. En pacientes de edad avanzada por lo demás sanos, los resultados de la cirugía abierta pueden muy bien ser equivalentes a los de la EVAR. Sin embargo, la sustitución aórtica abierta no beneficia a los pacientes mayores con enfermedad coronaria que ya están asignados en estado de shock. Que la EVAR pueda dar mejores resultados en este caso es hipotéticamente posible, pero aún no se ha demostrado.
Gestión del volumen perioperatorio
El factor pronóstico más importante -aparte de una rápida intervención de urgencia- puede ser el volumen y la gestión hemodinámica entre el diagnóstico y la hemostasia quirúrgica. Se sabe por estudios de traumatismos y experimentos con animales que la restricción de volumen y la hipotensión arterial permisiva hasta la hemostasia quirúrgica salvan más vidas en el shock hemorrágico que la “estabilización” de la circulación asistida por volumen [13]. La tolerancia al estado de shock, especialmente en los pacientes con rBAA que suelen ser más polimórbidos y mayores que los pacientes traumatizados, parece contraintuitiva a primera vista, pero es convincente en teoría. La menor presión hemorrágica y la reducción de la coagulopatía dilucional favorecen la coagulación y el taponamiento del retroperitoneo, lo que reduce la pérdida de sangre. Además, la restricción de volumen reduce el riesgo de hipotermia y desequilibrio ácido-base.
Curiosamente, basándose en estas consideraciones, el concepto de “restricción de volumen hasta la hemostasia quirúrgica” también se recomienda repetidamente en pacientes con rBAA, pero nunca se ha investigado de forma sistemática. Por lo tanto, se exploró este concepto en la cohorte estudiada. La información sobre la cantidad de volumen suministrado en el preoperatorio y la tasa de suministro de volumen (en l/h) antes de pinzar la aorta se recogió de los registros de traslado y anestesia y se correlacionó con la mortalidad a los 30 días tras la sustitución aórtica abierta de urgencia una vez corregidos los posibles factores de confusión [13].
Tanto la tasa de volumen como el volumen absoluto administrado tuvieron un efecto negativo independiente y estadísticamente significativo sobre el riesgo de morir en los primeros 30 días . En concreto, cada litro adicional de volumen por hora aumentaba el riesgo de mortalidad en 1,57 veces (IC 95%: 1,1-2,3; p=0,026). Esto fue independiente del estado del paciente, la presión arterial media y otros factores del paciente o medidas terapéuticas. El efecto estuvo determinado principalmente por la tasa de volumen y menos por el volumen total [13].
Por el contrario, esto significa que la restricción constante del volumen a lo largo de toda la cadena de rescate, es decir, desde el diagnóstico hasta la intervención de urgencia, es un concepto pronósticamente importante y eficaz en los pacientes con rBAA que contribuye a garantizar su supervivencia. Por consiguiente, todos los actores deben recibir formación en este sentido. El control de la sustitución de volumen en el paciente despierto depende principalmente del estado de conciencia. En los pacientes opacificados, la tensión arterial sistólica debe mantenerse pero no elevarse por encima de 70-80 mmHg durante periodos prolongados. Aunque estos análisis se aplican a los pacientes de cirugía abierta, no hay razón para no suponer un efecto positivo similar de la restricción de volumen en los pacientes de EVAR.
Conclusión
Factores como (1) una cadena de rescate eficaz con diagnóstico y transporte rápidos al hospital tratante, (2) una restricción de volumen constante con hipotensión permisiva, (3) una evaluación radiológica rápida y sistemática, (4) una selección de riesgos ética y con sentido pronóstico, y (5) la presencia constante de un equipo de tratamiento competente y con experiencia salvan muchas más vidas de pacientes con rBAA que una técnica de tratamiento o un implante concretos. Para obtener resultados óptimos, el equipo de tratamiento debe hacer lo que mejor sabe hacer y para lo que la infraestructura es adecuada, teniendo en cuenta estos factores.
Dra. Regula von Allmen
Prof. Dr. med. Jürg Schmidli
PD Matthias Widmer, MD
PD Florian Dick, MD
Literatura:
- Svensjo S, et al: Circulation 2011; 124: 1118-1123.
- Anjum A, et al: The British journal of surgery 2012; 99: 637-645.
- Bown M.J, et al: The British journal of surgery 2002; 89: 714-730.
- Holt PJ, et al: The British journal of surgery 2010; 97: 496-503.
- Greenhalgh RM, et al: Lancet 2004; 364: 843-848.
- Blankensteijn JD, et al: The New England journal of medicine 2005; 352: 2398-2405.
- Lederle FA, et al: JAMA : la revista de la Asociación Médica Americana 2009; 302: 1535-1542.
- Dick F, et al: The British journal of surgery 2012; 99: 940-947.
- Hinchliffe RJ, et al: European journal of vascular and endovascular surgery: the official journal of the European Society for Vascular Surgery 2006; 32: 506-513; discusión 14-15.
- Balm R.: Presentación oral en el simposio de Charing Cross, Londres, 15 de abril de 2012.
- Mayer D, et al: Revista de cirugía vascular 2009; 50: 1-7.
- Opfermann P, et al: Revista europea de cirugía vascular y endovascular : la revista oficial de la Sociedad Europea de Cirugía Vascular 2011; 42: 475-483.
- Dick F, et al: Revista de cirugía vascular 2013.
- Veith FJ, et al. Ann Surg 2009; 250: 818-824.
- Greenhalgh RM, et al: The New England journal of medicine 2010; 362: 1872-1880.











