Entre otras cosas, se presentaron nuevos hallazgos sobre la terapia del linfoma difuso de células B grandes. El ensayo de fase III FLYER comparó la terapia estándar (6xR-CHOP) con el tratamiento reducido en dos ciclos de quimioterapia. Otro estudio ha logrado desarrollar un nuevo método genético molecular como base para una estrategia de terapia personalizada.
El linfoma difuso de células B grandes (DLBCL) es el linfoma no Hodgkin más frecuente en todo el mundo y pertenece a los denominados linfomas no Hodgkin agresivos. La terapia estándar hasta ahora es la inmunoquimioterapia 6xR-CHOP. El 6xR-CHOP combina anticuerpos monoclonales (R) con fármacos citostáticos (CHOP) en seis ciclos [1]. La base empírica de este régimen de tratamiento procede del ensayo MINT [3]. En pacientes con una puntuación del índice pronóstico ajustado a la edad (aaIPI) de 0 y sin masa tumoral, seis ciclos de terapia dieron como resultado una SSE a 3 años del 89% y una SLP a 3 años del 95%, y una SG a 3 años del 98% [3].
En el ensayo FLYER se demostró que pueden omitirse dos ciclos de quimioterapia sin que ello tenga un efecto negativo en la evolución de la enfermedad. Una duración más corta de la quimioterapia significa que los pacientes pueden volver a una rutina diaria normal y al trabajo más rápidamente, como explica la primera autora del estudio, la Dra. Viola Poeschel, de la Facultad de Medicina de la Universidad del Sarre en Homburg/Saar (Alemania) [1].
Estudio multicéntrico FLYER: reducción de la quimioterapia sin efectos negativos
El estudio internacional, prospectivo y multicéntrico FLYER (n=588) investigó cómo afecta una reducción de los ciclos de tratamiento citostático de la terapia estándar a los parámetros relevantes para la enfermedad. Para ello, se comparó 6xR-CHOP (n=295) durante un periodo de once años (2005-2016) con la terapia según el régimen 4xR-CHOP+2xR (n=293) en un diseño de no inferioridad aleatorizado y equilibrado. Los pacientes de entre 18 y 60 años presentaban un LDCBG en estadio I o II sin masa tumoral y fueron asignados aleatoriamente a uno de los dos brazos del estudio (seis frente a cuatro ciclos de CHOP y seis dosis de rituximab cada uno). Los ciclos de R-CHOP se realizaron a intervalos de 21 días. El criterio de valoración primario fue la no inferioridad en la supervivencia libre de progresión (SLP). Los criterios de valoración secundarios fueron diversos parámetros relevantes para la enfermedad. 4xR-CHOP+2xR demostró no ser inferior al estándar 6xR-CHOP; la eliminación de células cancerosas y la prevención de recaídas fueron comparativamente eficaces con cuatro ciclos de quimioterapia que con seis ciclos. En cuanto a la tolerabilidad, la reducción de la quimioterapia en dos ciclos tuvo un efecto favorable [1].
La tasa de SLP a 3 años (criterio de valoración primario) tras una mediana de seguimiento de 66 meses fue del 94% (IC del 95%, 91-97) en el grupo 6xR-CHOP (n=295) y del 96% (IC del 95%, 94-99) en el grupo 4xR-CHOP+2xR (n=293). Los resultados también difirieron sólo ligeramente en cuanto a la tasa de SG a 3 años tras una mediana de seguimiento de 67 meses 98% (IC 95%, 96-99) con seis ciclos frente a 99% (IC 95%, 98-100) con cuatro ciclos [1].
En cuanto a la tolerabilidad, los resultados fueron los siguientes: En comparación con la condición 6xR-CHOP (1295 EA), el número total de EA en la condición 4xR-CHOP+2xR (835 EA) fue aproximadamente un tercio inferior [1]. El número total de acontecimientos adversos (AA) no hematológicos de grado 3 y 4 fue mayor en el brazo de tratamiento 6xR-CHOP (70 AA) en comparación con el brazo de 4 ciclos (46 AA) [1,4]. En cuanto a los EA hematológicos, en la condición de 6 R-CHOP, el número de individuos afectados fue mayor en comparación con 4xR-CHOP+2xR: leucopenia de grado 3 ó 4 (110 frente a 80), anemia (8 frente a 2) y trombocitopenia (7 frente a 5). Además, en la condición 6xR-CHOP, más pacientes se vieron afectados por parestesias de grado 3 y 4 (14 frente a 12), náuseas (12 frente a 6), infección (23 frente a 20), vómitos (7 frente a 1) y mucositis (3 frente a 1). Para poder afirmar si la reducción del número de ciclos de R-CHOP influye en los efectos negativos a largo plazo de la quimioterapia, es necesario realizar un seguimiento durante un periodo adicional de cinco años [1].
Personalización del tratamiento: nuevos análisis genéticos moleculares
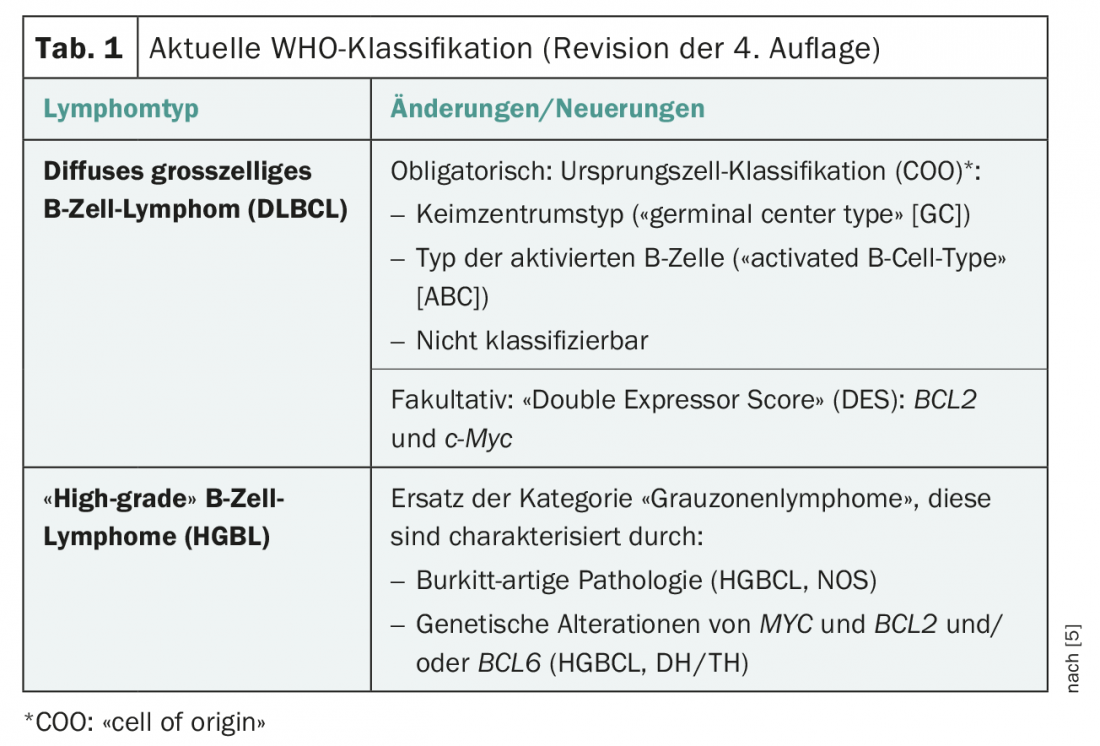
Los linfomas difusos de células B grandes pueden subdividirse según criterios morfológicos (centroblásticos, inmunoblásticos, anaplásicos), según la expresión génica (“germinal-centre B-cell (GCB)-like”, “activated B-cell (ABC)-like”), según las características inmunohistoquímicas (en particular CD5, CD30, MYC, BCL2, BCL6, GCB-like, non-GCB-like) y según las anomalías genéticas (en particular translocación de MYC, BCL2 y/o BCL6). En la edición más reciente de la clasificación de la OMS, se revisó la definición de los tipos de linfoma para incluir los resultados de los nuevos métodos de análisis molecular, como la “secuenciación de próxima generación” (Tab. 1) [5].
La identificación de subgrupos moleculares es una posible base para personalizar el tratamiento. Un estudio presentado en la ASH, que apareció paralelamente en el Journal of Oncology, retoma este enfoque [2]. Dentro de la variante de DLBCL similar al de células B de centro germinal (GCB) (GCB-DLBCL), se identificó un subgrupo que difiere clínica y biológicamente en una firma de expresión génica HGBL-DH/TH-BCL2. El trasfondo de este estudio fue el hallazgo de que los linfomas de células B de alto grado con MYC y BCL2 y/o BCL6 (HGBL-DH/TH) responden mal a la terapia estándar (quimioinmunoterapia). Para analizar las características moleculares del HGBL-DH/TH con BCL2 (HGBL-DH/TH-BCL2), así como la morfología del DLBCL, se desarrolló una firma de 104 genes de doble golpe (DHITsig) como característica distintiva entre el HGBL-DH/TH-BCL2 de otros GCB-DLBCL.
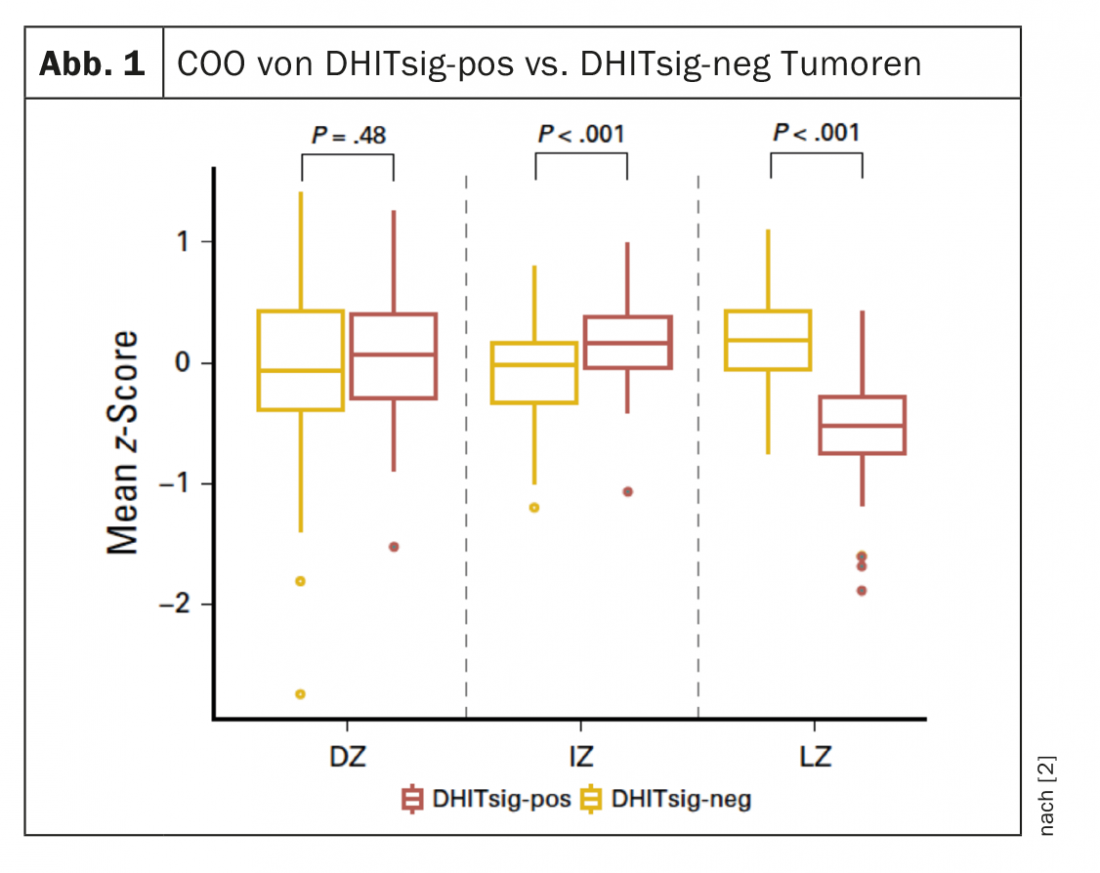
DHITsig identifica tumores que difieren en características biológicas que pueden ser relevantes para la progresión y la terapia. Los tumores DHITsig-pos se caracterizan por un COO de la zona intermedia/oscura del tipo centro germinal (GC) y tienen una expresión significativamente menor de los genes de la zona clara en comparación con los tumores DHITsig-negativos (p<0,001) (Fig. 1). Se demostró que los pacientes DHITsig-positivos tenían un peor resultado tras la inmunoquimioterapia R-CHOP en comparación con los pacientes DHITsig-negativos (tasa de supervivencia libre de progresión a 5 años, 57% y 81%, respectivamente; p<0,001), independientemente del estado HGBL-DH/TH-BCL2.
La expresión de MYC en las células normales del centro germinal está restringida a las células situadas dentro de la ZL para su reentrada en la ZD. Los autores del estudio sugieren que estas células de reciclaje representan la contrapartida fisiológica de las células tumorales DHITsig-pos. Además de una alta incidencia de mutaciones dentro de los genes modificadores de la cromatina, tienen una alta incidencia de baja expresión de MHC-I y MHC-II y un alto nivel de expresión de genes asociados a la fosforilación oxidativa.
Según los autores, estas características biológicas pueden proporcionar una base para el desarrollo de sustancias activas dirigidas más allá del enfoque actual sobre los inductores de BCL2. Los posibles enfoques terapéuticos que pueden derivarse de ello están relacionados con la diferenciación celular (“inhibidores del potenciador de zeste homólogo 2”), la reducción de la evasión inmunitaria (“inhibidores de la histona deacetilasa”), el aumento de la activación de las células T (anticuerpos anti-CD20 de última generación), así como la fosforilación oxidativa y el proteasoma. Los altos niveles de expresión de ciertos genes también indican que los inhibidores específicos pueden ser beneficiosos (por ejemplo, los inhibidores de la araquidonato 5-lipoxigenasa).
El análisis de subgrupos mediante la firma de expresión génica DHITsig desarrollado en este estudio puede utilizarse para investigaciones de muestras de biopsia en un contexto clínico.
Fuente: 60ª Reunión de la ASH, 1-4 de diciembre de 2018, San Diego (EE.UU.)
Literatura:
- Poeschel V, et al: Excelentes resultados de pacientes jóvenes (18-60 años) con linfoma difuso de células B grandes (LDCBG) de pronóstico favorable tratados con 4 ciclos de CHOP más 6 aplicaciones de rituximab: resultados de los 592 pacientes del ensayo FLYER del Dshnhl/GLA. Resúmenes orales y de póster, Resumen nº 781: Sesión: 626. Presentado en: ASH Annual Meeting and Exposition; 4-8 de diciembre de 2018; San Diego, California. Resumen 781, https://ash.confex.com/ash/2018/webprogram/Paper112403.html
- Ennishi D, et al: La firma de expresión génica de doble impacto define un subgrupo distinto de linfoma difuso de células B grandes similar a las células B de centro germinal. Revista de Oncología Clínica 2018; dic 3:JCO1801583. doi: 10.1200/JCO.18.01583. [Epub ahead of print], Presentado en la 60ª Conferencia Anual de la Sociedad Americana de Hematología, San Diego, CA, del 1 al 4 de diciembre de 2018.
- Pfreundschuh M, Truemper L, Osterborg A, et al: Quimioterapia tipo CHOP más rituximab en comparación con quimioterapia tipo CHOP sola en pacientes jóvenes con linfoma difuso de células B grandes de buen pronóstico: ensayo controlado aleatorizado del Grupo del Ensayo Internacional Mabthera (MInT). Lancet Oncology 2006; 7(5): 379-391.
- NIH: Instituto Nacional del Cáncer. División de Tratamiento y Diagnóstico del Cáncer. Common Terminology Criteria for Adverse Events, https://ctep.cancer.gov/protocolDevelopment/electronic_applications/ctc.htm#ctc_40, último acceso 19.12.2018.
- Menter T, Dirnhofer S: OMS 2017: ¿Progreso, retroceso o paso atrás? Switzerland Med Forum 2018; 18(03): 52-54 DOI: https://doi.org/10.4414/smf.2018.03150.
InFo ONcOLOGíA & HEMATOLOGíA 2019; 7(1): 30-31