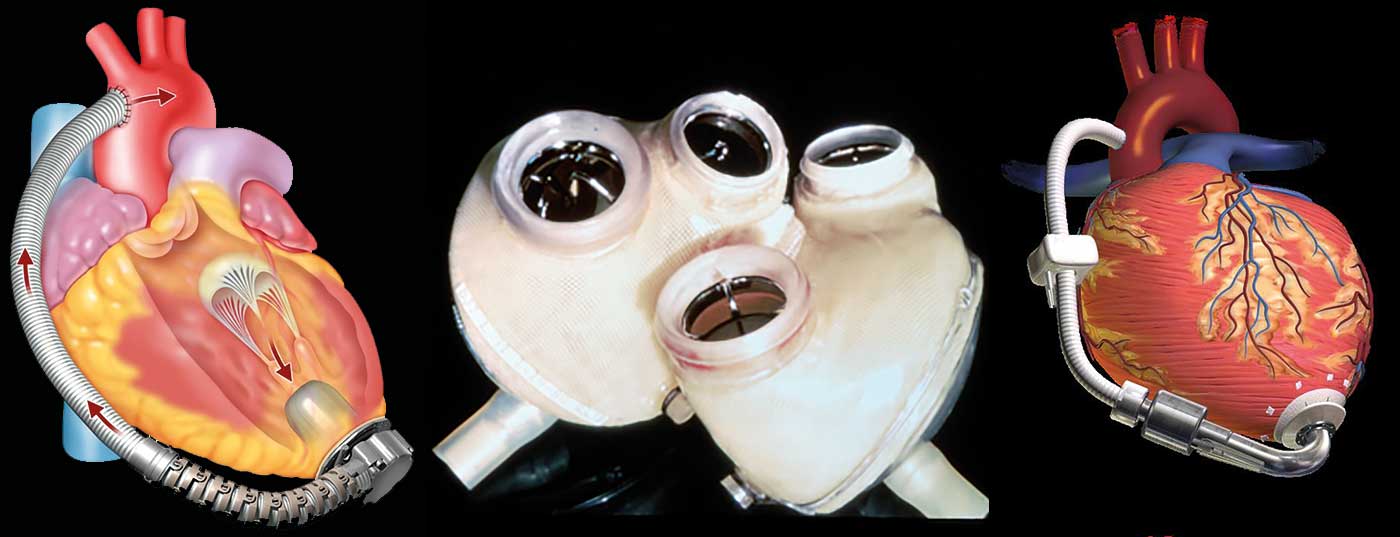
El número de pacientes con cardiopatías clínicamente avanzadasLa insuficiencia está aumentando en todo el mundo. Si se han agotado las opciones terapéuticas convencionales, debe evaluarse si se cumplen los criterios para un trasplante de corazón. Los sistemas de asistencia cardiaca artificial (“corazones artificiales”) pueden servir de puente hasta el trasplante de corazón, pero también se utilizan cada vez más como solución definitiva. Los corazones artificiales totales (“TAH”) sustituyen al corazón que ya no funciona; con los dispositivos de asistencia ventricular (“VAD”), el corazón biológico que ya no funciona se deja en su lugar y una bomba suele sostener el ventrículo izquierdo. Con los dispositivos de asistencia cardiaca de la generación actual, más del 80% de los pacientes sobreviven al primer año de la implantación, y el 75% siguen vivos después de tres años.
Ludwig Rehn (1849-1930) trata por primera vez una herida punzante del ventrículo derecho con tres puntos de sutura el 9 de septiembre de 1896. En el XXVI Congreso de la Sociedad Alemana de Cirugía, concluyó la presentación de su caso con las siguientes palabras: “Probablemente, ahora no debería dudarse de la viabilidad de la sutura cardiaca”. Espera que su caso inspire nuevos trabajos en el campo de la cirugía cardiaca. Esta afirmación debe verse en relación con una cita de Theodor Billroth (1829-1894): “El cirujano que alguna vez intentara suturar una herida del corazón puede estar seguro de que perdería para siempre el respeto de sus colegas”. En círculos especializados se duda de que Billroth dijera realmente esta frase, pero no se puede descartar. Porque se pueden encontrar paralelismos muchas veces en la historia de la medicina cuando se realiza un trabajo pionero y se reprende a los colegas por falta de comprensión o incluso por mala voluntad.
Reacciones muy similares acompañaron al rápido desarrollo de la asistencia circulatoria mecánica, hoy indispensable. El 21. En marzo de 1986, el semanario “Die Zeit” publicó el siguiente párrafo bajo el título “Sensación mortal – el macabro juego con el corazón artificial”: “Sin embargo, en lo que respecta a los corazones artificiales, el profesor debía saber lo problemática que es esta técnica a juicio de los expertos. Sólo dos pacientes han sobrevivido con corazones artificiales en Estados Unidos. Según los informes, su estado es atroz e inhumano. Incluso suponiendo que el cirujano berlinés hubiera elegido un “caso desesperado” para su estreno, debió de pasarle por la cabeza que la ley protege la dignidad humana incluso y especialmente al morir”. 20 años después, la asistencia circulatoria mecánica a largo plazo es una opción terapéutica en parte igual al trasplante de corazón y en algunas situaciones incluso superior.
Cada vez más pacientes con insuficiencia cardíaca
Se calcula que unas 200.000 personas en Suiza viven con insuficiencia cardiaca. El 5%, es decir, unos 10.000 pacientes, se encuentran en un estadio clínicamente avanzado con disnea correspondiente a la clase funcional NYHA III a IV. Como expresión del progreso de una asistencia médica eficaz, la mortalidad de las enfermedades cardiovasculares se ha reducido en las dos últimas décadas, mientras que al mismo tiempo la incidencia y prevalencia de la insuficiencia cardiaca han aumentado notablemente [1]. El tratamiento de la insuficiencia cardiaca recomendado por las sociedades profesionales sigue un esquema específico paso a paso. Si se han agotado las opciones terapéuticas con fármacos, marcapasos e intervenciones quirúrgicas convencionales, es necesario evaluar si se cumplen los criterios para realizar un trasplante de corazón (TxC) [1].
Corazón artificial total y bomba de apoyo cardiaco
Debido a la antigua y últimamente creciente discrepancia entre el número de órganos de donantes necesarios y el número de pacientes en las listas de espera, desde hace varias décadas se trabaja en sistemas artificiales de asistencia cardiaca (“corazones artificiales”). Por un lado, pretenden servir de puente hasta que se pueda salvar un trasplante de corazón y, por otro, con la ayuda de sofisticados sistemas, la dependencia de los corazones de donantes pasará a ser historia en el futuro. De hecho, ya se han desarrollado varios corazones artificiales y otros están siendo sometidos a pruebas técnicas.

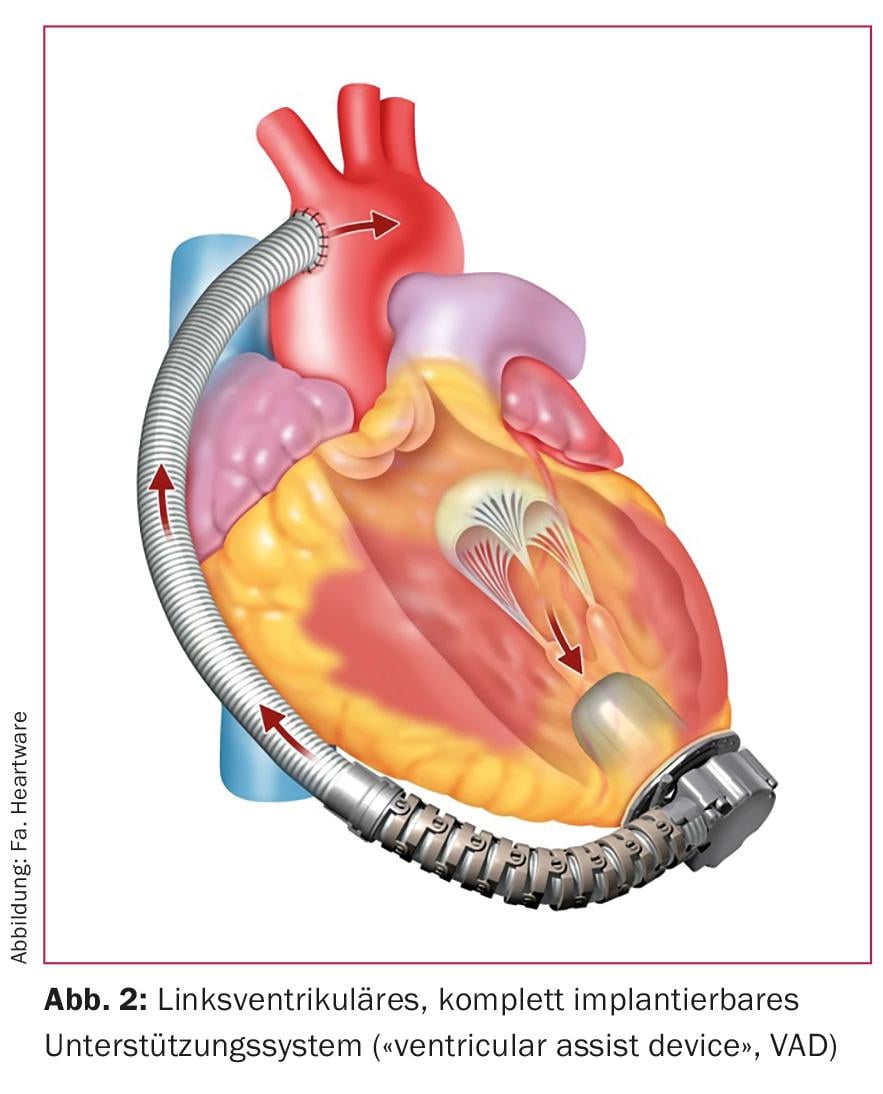
Con los corazones artificiales totales, el corazón que ha dejado de funcionar se sustituye por dos bombas mecánicas interconectadas (Fig. 1) . Éstos asumen la función del ventrículo izquierdo y derecho extirpados (“corazón artificial total”, TAH). Hoy en día, los corazones artificiales totales rara vez se utilizan en la práctica clínica diaria. Esto contrasta con el dispositivo de asistencia ventricular (DAV) utilizado habitualmente. Con estos dispositivos, el corazón biológico que ya no funciona se deja en su lugar (Fig. 2). Una bomba suele sostener el ventrículo izquierdo. Sin embargo, el ventrículo derecho debe seguir siendo lo suficientemente fuerte para ello. La distinción entre corazón artificial total y bomba de asistencia cardiaca es importante, aunque ambos conceptos se denominen popularmente “corazón artificial”.
Jarvik-7: el primer corazón artificial permanente
Al principio de la historia está el corazón artificial total. Poco después del primer trasplante de corazón, el cirujano estadounidense Denton Cooley realiza la primera implantación de corazón artificial en el Texas Heart Institute de Houston el 4 de abril de 1969. El paciente de 47 años recibió un corazón artificial desarrollado por Domingo Liotta, que fue sustituido por un corazón natural al cabo de 65 horas. Poco después del trasplante de corazón, el paciente falleció como consecuencia del rechazo inmunológico del tejido.

Se considera que el primer implante cardiaco permanente fue el Jarvik-7 (Fig. 3) de Robert Jarvik, que fue insertado el 2 de diciembre de 1982 en una operación de siete horas en Utah por William DeVries en el dentista jubilado Barney Clark. Clark sobrevivió 112 días y sufrió varias trombosis antes de morir. El 25 de noviembre de 1984, al estadounidense William J. Schroeder también se le implantó un Jarvik-7. Sobrevivió 620 días y murió de un derrame cerebral el 6 de agosto de 1986. Tras varias modificaciones, el corazón Jarvik se utiliza ahora con el nombre de CardioWest, principalmente en EE UU. Hasta ahora se han implantado más de 1250 corazones CardioWest. El sistema consta de dos cámaras cardíacas artificiales mecánicas separables, accionadas neumáticamente, y dos válvulas mecánicas cada una. El sistema fue aprobado por la FDA en 2004 como el primer y hasta ahora único corazón artificial para puentes temporales (hasta el trasplante) y en 2012 como corazón artificial permanente.
Del corazón artificial al DAV
En Europa, el cardiocirujano Emil Bücherl también trabajó en un corazón artificial en Berlín a partir de los años sesenta. Tras experimentos con animales, la primera implantación de este sistema berlinés tuvo lugar en 1986 en un paciente que, sin embargo, estaba gravemente enfermo, sin éxito. Apenas un año después, el tiempo que faltaba hasta un trasplante de corazón pudo salvarse con éxito en otro paciente.
Desde un punto de vista técnico, el “corazón artificial Bücherl” se diseñó de forma similar al corazón artificial CardioWest. Sin embargo, no se siguió desarrollando porque el concepto de “corazón artificial total” se abandonó en Berlín en favor de la asistencia cardiaca mediante DAV. Las bombas de apoyo más flexibles y pequeñas ofrecerían los mismos índices de éxito clínico, si no mejores. Según sus responsables, también sería ventajosa la posibilidad de una “copia de seguridad biológica” mediante la permanencia del corazón en el organismo, lo que por supuesto es imposible con los corazones artificiales totales. Una recuperación cardiaca también seguiría siendo posible de este modo.
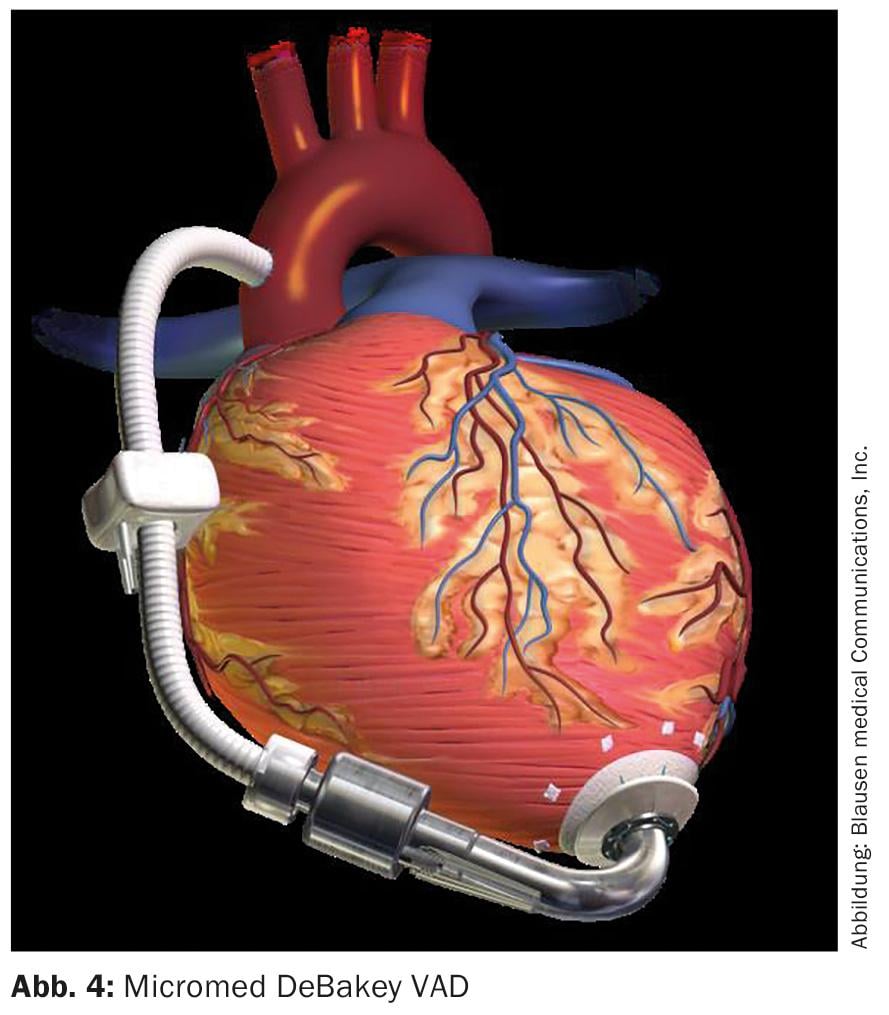
La primera implantación mundial de un sistema de DAV axial no pulsátil en el Centro Alemán del Corazón de Berlín el 13 de noviembre de 1998 puede considerarse un gran avance en la asistencia cardiaca mecánica moderna. El “Micromed DeBakey VAD” (Fig. 4), fruto de la colaboración entre Michael DeBakey y la NASA, abrió el camino a un concepto completamente nuevo de asistencia cardiaca. Hizo posible una reducción de la mortalidad y la morbilidad que antes parecía imposible, así como una miniaturización de los sistemas. Éstas podrían estar conectadas directamente al ápex cardíaco del ventrículo izquierdo y encontrar espacio intratorácico en el pericardio. Un cable transcutáneo permitía el suministro de energía y el control a través de una práctica unidad de control.
El éxito clínico se reflejó principalmente en el alta domiciliaria a largo plazo de los pacientes. Se han aprobado varios sistemas de DAV para terapia de destino, es decir, como solución definitiva para el paciente, lo que contrasta con la terapia puente hacia el trasplante como medida de transición hasta que se obtenga un órgano adecuado.
Sistemas VAD modernos: totalmente implantables
La sustitución completa de la función cardiaca fue históricamente el inicio de los conceptos de sustitución de órganos, pero la TAH no se puso de moda debido a las dificultades técnicas. Los DAV anteriores eran extracorpóreos simplemente por su tamaño y, por tanto, tenían una mayor tasa de complicaciones debido a las cánulas percutáneas. La terapia VAD de la llamada segunda y tercera generación se lleva a cabo exclusivamente mediante agregados que generan un flujo continuo (no pulsátil) y son totalmente implantables a excepción del cable de control.
Otro paso fue la miniaturización de los sistemas. Las bombas centrífugas actuales son impulsores electromagnéticos e hidrodinámicos combinados que alcanzan caudales de hasta 8-10 l/min, en función de las cargas aguas arriba y aguas abajo. Estas bombas también pueden producir cierta pulsatilidad, lo que debería proteger contra las complicaciones hemorrágicas y las fugas de la válvula, especialmente durante periodos muy largos de soporte. Los principales representantes son el sistema HeartWare® y ahora también el Thoratec HeartMate® III (Fig. 5).

En la mayoría de los pacientes, el dispositivo de asistencia ventricular izquierda (DAVI) por sí solo es suficiente. Sin embargo, debido a la miniaturización progresiva del sistema, ahora también es posible la implantación completa sin problemas en el caso del soporte biventricular.
Resultados del trasplante de corazón
Si nos fijamos en la epidemiología, los tiempos de espera en las listas de trasplantes y el suministro de órganos, vemos que en el futuro sólo un grupo muy circunscrito de personas podrá recibir un trasplante de corazón. Dado que los resultados de los trasplantes se verán afectados por la proporción de pacientes en estado de alta urgencia, se plantea la cuestión de hasta qué punto en los próximos años la generación actual y venidera de sistemas de apoyo competirá con el trasplante. Se considera que el objetivo mínimo al que hay que aspirar es una supervivencia a un año de más del 80% de los pacientes tras un trasplante de corazón, algo que se ha conseguido de forma constante en las estadísticas internacionales de los últimos años [2]. Hay que destacar aquí que las estadísticas de EE.UU. -con una gran reserva de donantes y tiempos de espera cortos- tienen una influencia positiva significativa en los resultados. En cambio, si se observan los datos alemanes, se aprecia un deterioro aterrador de los resultados, con menos del 80% de supervivientes en el primer año tras el trasplante. Este deterioro se debe, por un lado, al peor estado general de los pacientes (proporción desproporcionadamente alta en estado de alta urgencia) y, por otro, también al porcentaje cada vez mayor de corazones de donantes más viejos y en parte ya no completamente indemnes.
Los resultados de los trasplantes suizos se sitúan justo en el límite “mágico” del 80%, por lo que también empiezan a estar por detrás de la comparación internacional [3]. Tenemos que preguntarnos cómo y con qué podemos detener esta tendencia. ¿Cómo se comparan los pacientes con corazones artificiales modernos de tercera generación con los trasplantes de corazón? Aquí es útil destacar los resultados a largo plazo, pero también los impresionantes resultados a corto plazo.
VAD: tasa de supervivencia superior al 80%
En los pacientes con corazones artificiales de primera generación y de segunda generación temprana, los traumatismos quirúrgicos, incluidas las complicaciones hemorrágicas, provocaron una morbilidad y una mortalidad bastante elevadas. Los estudios actuales demuestran que la implantación ya no presenta problemas, al menos con los dispositivos de tercera generación. El ensayo de registro del HeartMate® III, recientemente finalizado, puede citarse como ejemplo: De 50 pacientes que recibieron este corazón artificial de última generación como terapia puente o de destino, el 92% sobrevivió a los seis primeros meses. Esto se debe en parte a las opciones de implantación mínimamente invasiva mediante una toracotomía anterolateral con esternotomía parcial, que puede reducir enormemente el traumatismo quirúrgico.
Los resultados a 1, 3 y 5 años con sistemas de la segunda generación más joven y principios de la tercera también son prometedores. Al cabo de un año, más del 80% de los pacientes están vivos, a los tres años el 75% y a los cinco años el 61%. Para poder hablar de competitividad real, son sobre todo las generaciones actuales de dispositivos las que tendrán que medirse con la supervivencia a largo plazo, puesto que estos pacientes pertenecen naturalmente a los más viejos y enfermos ya debido a su exclusión del trasplante de corazón [5,6].
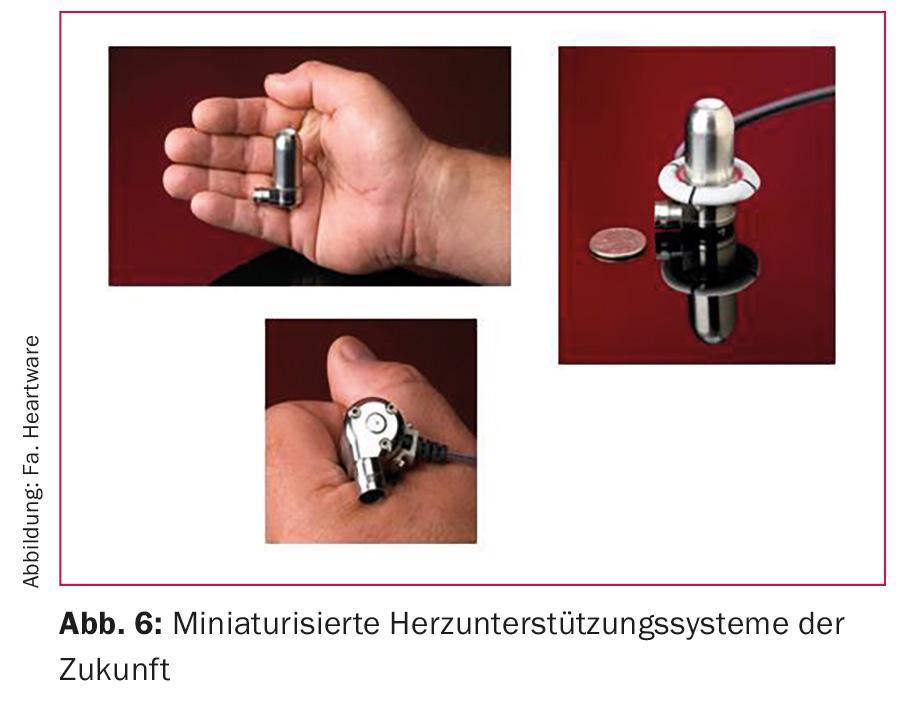
Nuevos objetivos: mejores baterías, funcionamiento inalámbrico
Con la última generación de corazones artificiales se ha alcanzado un nivel de implantabilidad difícilmente superable. Está prevista una mayor miniaturización, pero también se ve con ojos críticos. La generación actual (Fig. 6) es ciertamente seductoramente pequeña. Sin embargo, debido a las velocidades de rotación extremadamente altas y a la complejidad técnica, estos dispositivos también conllevan un riesgo de mayor susceptibilidad a los errores en el uso a largo plazo, un área en la que quedará claro si la terapia con corazones artificiales modernos puede convertirse en una alternativa al patrón oro del trasplante de corazón. Las principales áreas de mejora son el desarrollo de las baterías para aumentar la autonomía del paciente y la eliminación del cable de accionamiento como fuente importante de infección. Aquí, la transmisión inalámbrica de datos y energía es un objetivo importante.
Literatura:
- McMurray J, et al: Directrices de la ESC para el diagnóstico y tratamiento de la insuficiencia cardiaca aguda y crónica 2012. Eur Heart J 2012; 33: 1787-1847.
- Informes trimestrales del Registro de Trasplantes ISHLT para corazón: Tasas de supervivencia de los trasplantes realizados entre el 1 de abril de 2010 y el 31 de marzo de 2014, basadas en datos de UNOS/ISHLT a 27 de marzo de 2015.
- Informe anual del Estudio suizo de cohortes de trasplantes (mayo de 2008-dic de 2012), agosto de 2013.
- Netuka I, et al: Sistema de asistencia ventricular izquierda totalmente levitado magnéticamente para el tratamiento de la IC avanzada: un estudio multicéntrico. Am Coll Cardiol 2015 dic; 66(23): 2579-2589.
- Takeda K, et al: Resultados a largo plazo de los pacientes con asistencia ventricular izquierda de flujo continuo. J Thorac Cardiovasc Surg 2014; 148: 1606-1614.
- Sabashnikov A, et al: Resultados tras la implantación de 139 dispositivos de asistencia ventricular izquierda de flujo continuo de soporte completo como puente al trasplante. Eur J Cardiothorac Surg 2014; 46: e59-66.
CARDIOVASC 2016; 15(3): 19-21