El diagnóstico del derrame pleural es muy complejo, ya que diversas afecciones médicas pueden causarlo. La distinción más importante es entre derrames transudativos y exudativos y sus causas. Los parámetros químicos de laboratorio y los exámenes citológicos ayudan en este sentido. Dependiendo de la causa, puede iniciarse una terapia adicional. Para ello existen numerosos métodos, desde la simple punción descompresiva hasta el drenaje pleural y la toracoscopia.
Como piel serosa sobre los pulmones, la pleura es una parte importante en la mecánica respiratoria de todo el sistema. Es necesaria una fina capa de líquido para que las láminas pleurales se deslicen fácilmente unas sobre otras y, por tanto, los pulmones dentro del tórax. Esto permite una rápida transmisión de la fuerza de los músculos respiratorios y la excursión torácica a los pulmones. El propio pulmón está acoplado a la pared torácica por este fluido. Las células mesoteliales de la pleura tienen, por un lado, un papel pasivo en la lubrificación del sistema respiratorio y, por otro, un papel activo en la formación de macromoléculas, citocinas inflamatorias, factores de crecimiento y péptidos quimiotácticos. Una función importante es el transporte activo de proteínas, líquido linfático y células a través de la serosa, así como la absorción de líquidos acoplada a electrolitos.
Cambio en la permeabilidad pleural debido a procesos patológicos
En caso de inflamación de la pleura y/o de las estructuras pulmonares adyacentes, se produce una pérdida de proteínas hacia el espacio pleural debido a cambios en las células mesoteliales y en la estructura de la superficie pleural. Las fuerzas impulsoras del aumento de la acumulación de líquido son el aumento de la presión hidrostática, la disminución de la presión oncótica y la alteración de la eliminación de líquido linfático. La permeabilidad pleural cambia por el contacto con bacterias, lipopolisacáridos, trombina [1]. Este contacto aumenta la secreción de VEGF en las células mesoteliales, que es un potente mediador del aumento de la permeabilidad [2].
Clínica y presentación
Los síntomas típicos del derrame pleural son dolor torácico, tos y disnea. El dolor pleurítico se origina en la pleura parietal porque ni la pleura visceral ni los pulmones tienen receptores del dolor. Normalmente, se trata de un dolor intenso de aparición rápida con irradiación al hombro y a la parte superior del abdomen. A medida que aumenta el derrame pleural, el dolor suele disminuir. La tos en las enfermedades pleurales es un síntoma inespecífico, más bien seco y persistente y asociado a la falta de aire. La disnea resulta inicialmente de la fiebre y el dolor y con el rápido aumento de los derrames debido a la compresión de los pulmones. Normalmente, la disnea depende de la posición [3].
Diagnóstico por imagen
El derrame pleural y las enfermedades pleurales pueden detectarse y aclararse con todos los procedimientos radiológicos. Las radiografías posteroanteriores de tórax pueden mostrar derrames de más de 200 ml, aunque a menudo pueden pasar desapercibidos derrames mayores en las radiografías de tórax. La TC ya puede detectar un derrame significativamente menor y puede lograr diagnosticar una gran variedad de patologías concomitantes del pulmón y la pleura. Pueden diagnosticarse adecuadamente enfermedades subyacentes como la neumonía, la embolia pulmonar, las neoplasias torácicas, las enfermedades pulmonares intersticiales, las enfermedades pleurales, así como las patologías cardiacas y abdominales superiores adyacentes. La diferenciación de superposiciones benignas y estructuras malignas se consigue con una sensibilidad del 90% [4].
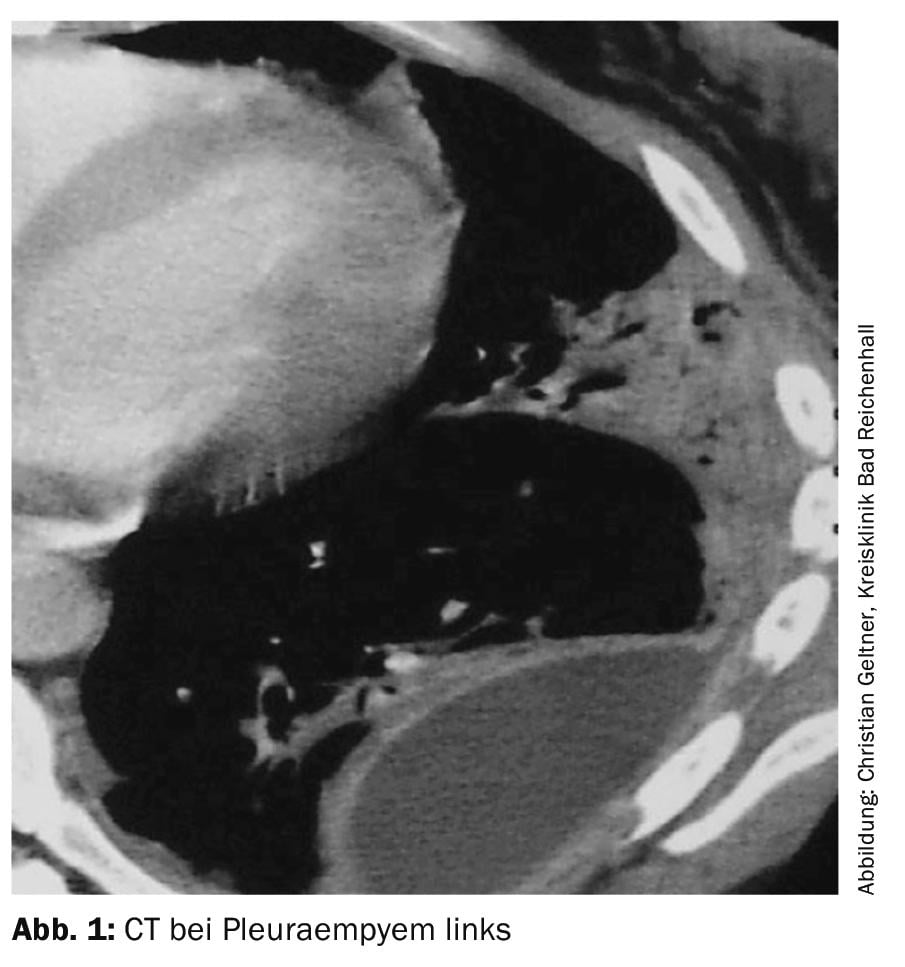
Debe realizarse un TAC con realce de contraste y una pequeña cantidad de líquido residual (Fig. 1) . Los derrames de gran volumen deben drenarse primero [4].
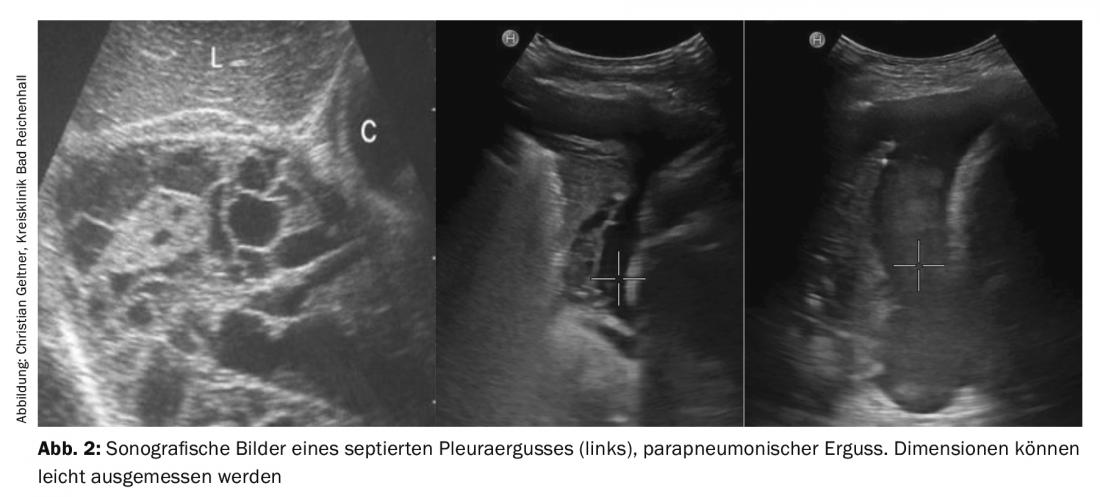
La ecografía torácica y pleural es un método seguro e inocuo para diagnosticar y cuantificar los derrames y para mostrar las enfermedades concomitantes (Fig. 2) . También puede distinguir entre derrames paraneumónicos simples y complicados, sobrecrecimientos malignos e infiltrados pulmonares. La resonancia magnética no debe realizarse de forma rutinaria. La única mejora diagnóstica se encuentra en la estadificación del mesotelioma pleural probado [5].
Diagnósticos invasivos
La punción pleural (toracocentesis) es necesaria para el diagnóstico diferencial en todos los derrames pleurales tras descartar las causas más importantes de trasudado [6]. Los derrames transsudativos no deben puncionarse si la causa es clara. En este caso, la causa debe tratarse primero con medicación. Un examen ecográfico antes de la punción es útil, ya que puede estimarse el lugar de punción y la cantidad de punción. La punción pleural es un método invasivo de diagnóstico muy seguro. El neumotórax se produce en un 3-10% aproximadamente. Un examen químico del líquido pleural suele explicar la causa. La citología conduce a un diagnóstico definitivo en el 60% de los casos de tuberculosis y sólo en el 25% de los casos de malignidad. Una citología negativa no descarta un derrame pleural maligno.
Existen varias técnicas de biopsia pleural a ciegas para obtener muestras histológicas de la pleura. Se han desarrollado diversas agujas para la biopsia de la pleura pariental, que permiten la extracción de tejido para su examen histológico. Los riesgos en este caso son hemorragias importantes, neumotórax y lesiones en el diafragma y la superficie pulmonar. El rendimiento diagnóstico es de aproximadamente el 80% para la tuberculosis, el 43% para la carcinomatosis pleural y el 25% para el mesotelioma pleural maligno [7,8].
La toracoscopia médica como procedimiento sencillo mínimamente invasivo experimentó un renacimiento con el desarrollo de pequeños sistemas ópticos y endoscopios semiflexibles. Aquí es posible realizar una biopsia controlada ópticamente de la pleura y el pulmón con una sensibilidad y especificidad diagnósticas de hasta el 98%.
Además de obtener biopsias y resecciones en cuña más amplias de los pulmones, la toracoscopia quirúrgica asistida por vídeo (VATS) es también un procedimiento terapéutico con todas las posibilidades de los procedimientos quirúrgicos torácicos como la abrasión pleural, la pleurectomía, la decorticación y las neumectomías y lob.
Distinción entre exudado y trasudado
En los derrames macroscópicamente claros, hay que distinguir entre los transudados puros y los exudados. El análisis químico del punteado y los criterios según Light (medición del contenido de proteínas y LDH en el líquido pleural y en el suero) tienen la mayor sensibilidad.
Un criterio clínicamente importante es si los derrames se producen en uno o en ambos lados; esto ayuda en el diagnóstico diferencial. Los transudados suelen ser bilaterales, aunque también pueden producirse unilateralmente en un 20% de los casos. Los derrames inflamatorios suelen producirse en el lado de la patología, con la gran excepción de las enfermedades sistémicas (como en las colagenosis o los carcinomas metastásicos).
El derrame pleural transudativo
Los derrames transudativos están causados por cambios de presión en la pleura. El aumento de la entrada de líquido en la pleura, por un lado, y la disminución de su salida, por otro, se producen con el aumento de la presión venosa en la circulación sistémica (insuficiencia cardiaca derecha), en la circulación pulmonar (insuficiencia cardiaca izquierda), en la circulación portal (cirrosis hepática) o con la disminución de la presión pleural en la atelectasia pulmonar o la embolia pulmonar. La cantidad de líquido depende del cambio de las condiciones de presión y de la filtración a través de la pleura. Las causas más importantes son la insuficiencia cardiaca izquierda y la enfermedad renal con pérdida de proteínas.
El exudado en la pleura
La base de cualquier exudado es una reacción inflamatoria pleural. La inflamación de la pleura puede deberse a infecciones o a la afectación de la pleura en diversas enfermedades sistémicas. La pleuresía infecciosa es frecuente en los casos de afectación pleural en el contexto de una neumonía. Puede ir desde una simple pleuresía concomitante a derrames paraneumónicos simples y complicados, pasando por un empiema pleural. El grado y el tipo de reacción inflamatoria pueden reconocerse por el número y el tipo de células inflamatorias en el líquido pleural.
Derrames paraneumónicos
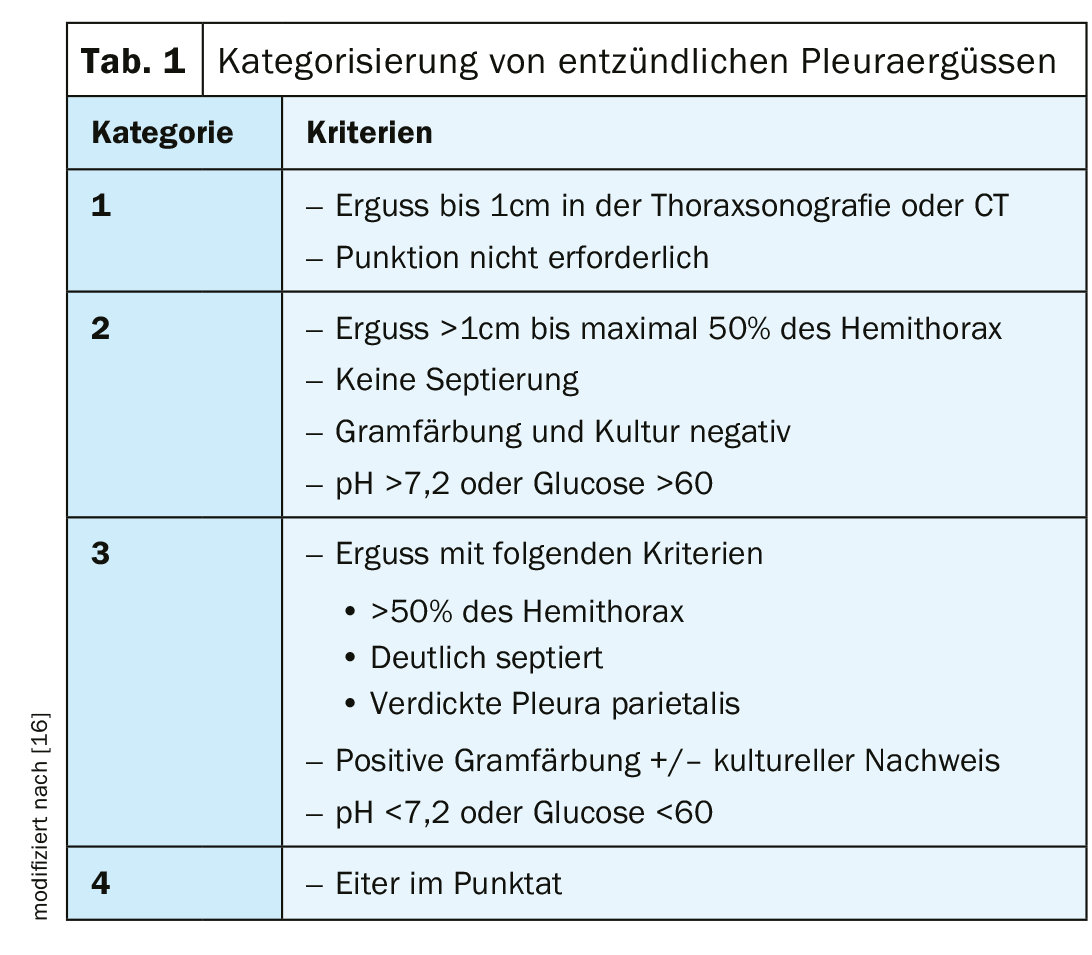
Los derrames paraneumónicos se producen en el 20-40% de los pacientes hospitalizados por neumonía. El riesgo de cursos prolongados y de mortalidad es significativamente mayor con la aparición de un derrame paraneumónico en la neumonía. La aparición de un empiema pleural sin neumonía previa es rara, pero debe tenerse en cuenta en relación con intervenciones quirúrgicas, de forma iatrogénica tras punciones o en pacientes con inmunosupresión grave. Con una terapia antibiótica sistémica suficiente y oportuna, la mayoría de los derrames infecciosos se curan. Básicamente, existe una transición suave del derrame exudativo paraneumónico al derrame complicado y al empiema pleural (tab. 1).
La primera fase de un derrame inflamatorio es el derrame exudativo paraneumónico de flujo libre; éste es estéril y muestra parámetros químicos de laboratorio normales (leucocitos, LDH, pH, glucosa). La terapia antibiótica es suficiente. Con una terapia inadecuada, un simple derrame puede complicarse hasta convertirse en un estadio fibropurulento. La inmigración de bacterias y células inflamatorias conduce a procesos inflamatorios con una mayor actividad formadora de fibrina, lo que da lugar a hilos de fibrina, septos y un mayor crecimiento bacteriano. Esto muestra un aumento de la septación y la organización del derrame en las imágenes. Los siguientes parámetros de laboratorio son patognomónicos: pH <7,2, glucosa <60, LDH >1000. La aparición de pus visible macroscópicamente se denomina empiema. Esto provoca la obstrucción mecánica del pulmón, la formación de septos purulentos, la reformación de los vasos y la organización del derrame por fibroblastos y leucocitos.
Después de la química para diferenciar entre transudados y exudados, el estudio citológico del derrame es lo siguiente de crucial importancia diagnóstica. Los granulocitos neutrófilos se encuentran en las infecciones bacterianas tempranas hasta el empiema pleural. Los derrames linfocíticos son típicos en las tuberculosis, las sarcoidosis, los linfomas y las colagenosis, así como en todas las neoplasias malignas, mientras que encontramos derrames eosinofílicos en las embolias pulmonares, las asbestosis, las aspergilosis, los mesoteliomas y las carcinosis pleurales. Los derrames “antiguos” muestran un aumento de la población de linfocitos en el punteado [4]. Cuantas más células inflamatorias haya en la pleura, más probable es que haya adherencias, formación de fibrina, formación de membranas y adherencias. En el caso de los derrames paraneumónicos, puede desarrollarse posteriormente un empiema pleural. En este caso, el cultivo bacteriológico suele ser negativo, ya que a menudo se trata de anaerobios difíciles de cultivar.
La graduación de los derrames paraneumónicos es la siguiente:
- Derrame paraneumónico no complicado: exudado, predominantemente neutrofílico
- Derrame paraneumónico complicado: aumento de la invasión bacteriana: el pH disminuye, la glucosa disminuye, la LDH aumenta. Se producen depósitos de fibrina y formación de membranas.
- Empiema = pus en el pinchazo. En este caso suele ser necesaria la intervención quirúrgica.
Las causas comunes de los exudados son los derrames malignos, que se producen con mayor frecuencia en los carcinomas bronquiales, de mama o de ovario (tab. 2).
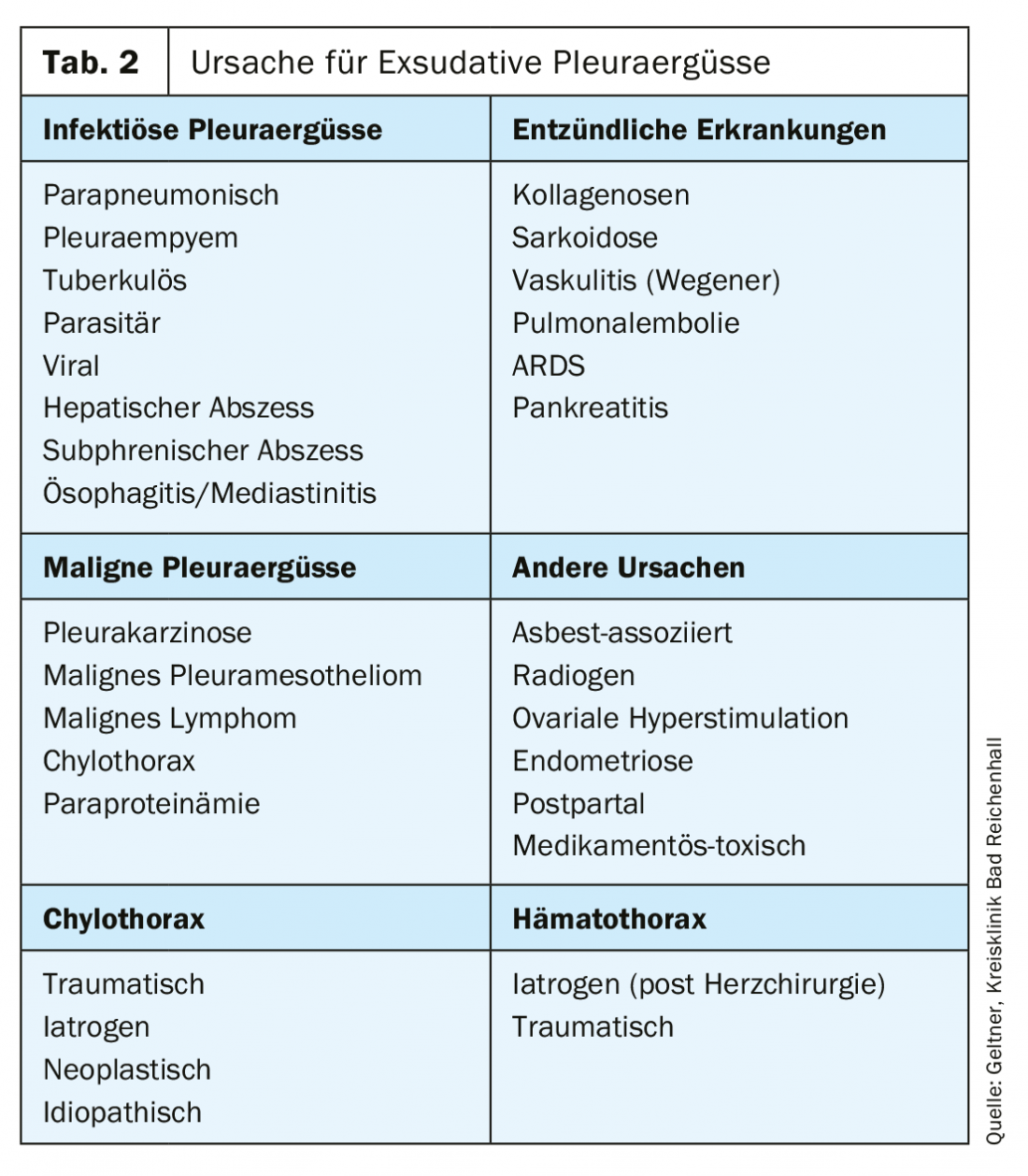
Tratamiento del derrame pleural
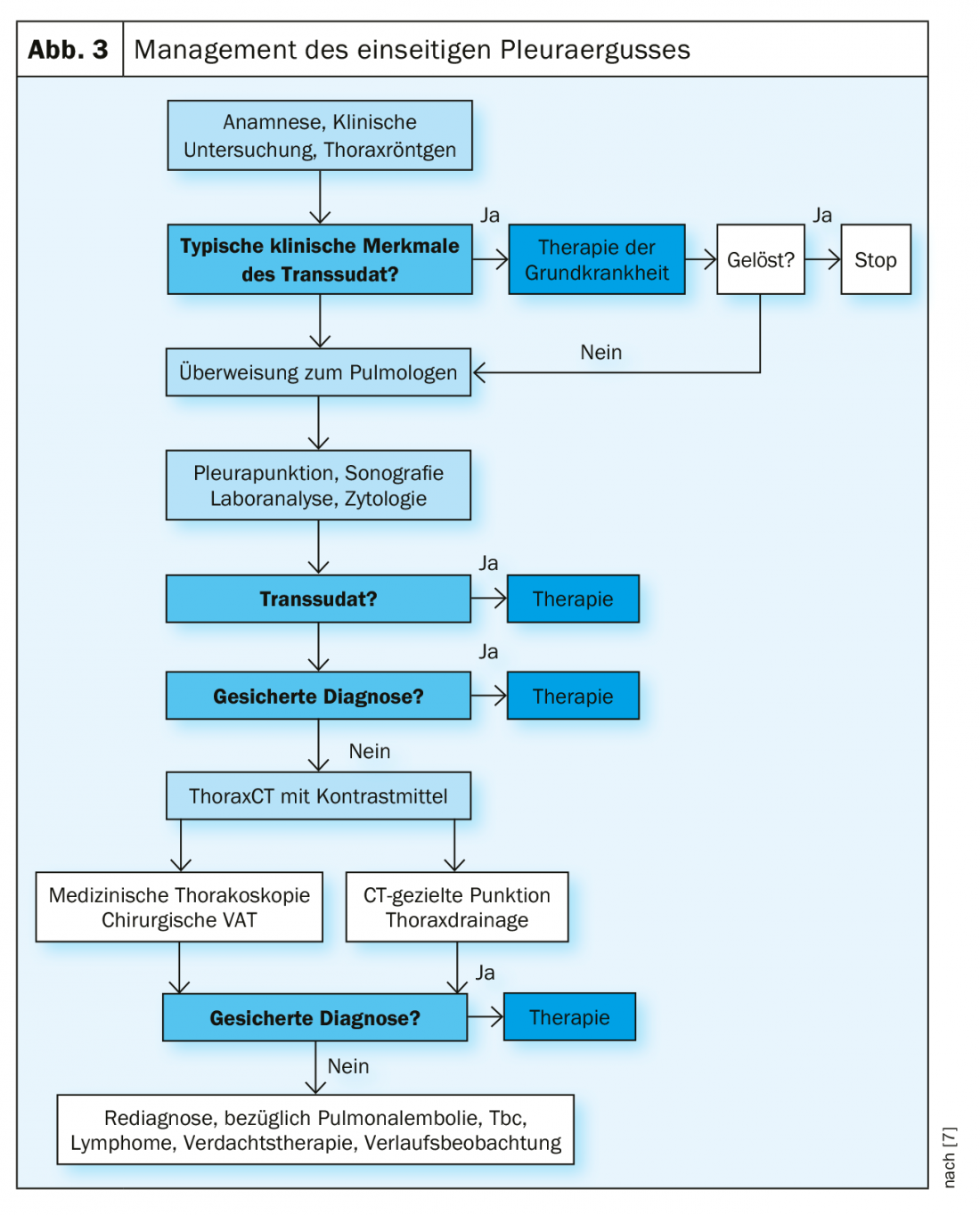
El primer paso en el tratamiento de un derrame es la exploración diagnóstica del mismo. La Sociedad Médica Británica ha desarrollado un algoritmo práctico en sus directrices (Fig. 3).
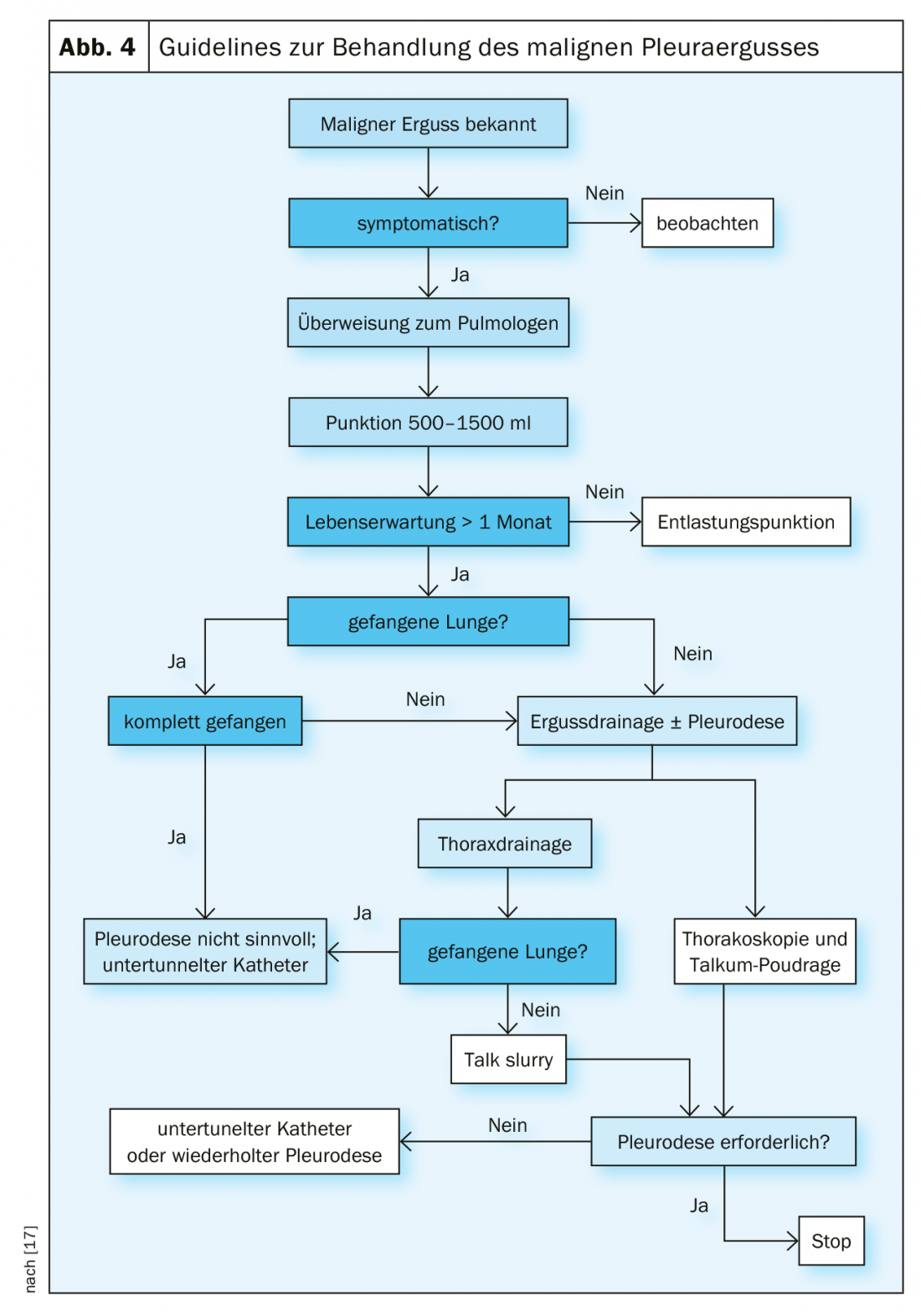
Tratamiento del derrame maligno
Los derrames malignos y la carcinomatosis pleural son una complicación frecuente de las neoplasias malignas torácicas y extratorácicas [9]. Muy a menudo son claramente sintomáticos y requieren una terapia paliativa (Fig. 4) . La terapia curativa ya no suele ser posible en esta fase [10].
Punción de descarga: Este procedimiento es el método de primera elección en pacientes sintomáticos. Las punciones repetidas no deben realizarse en pacientes con una esperanza de vida superior a un mes por el riesgo de que se produzca una expectación pleural y la formación de un pulmón “atrapado”. En este caso, se recomienda realizar una pleurodesis. Existe riesgo de edema de reexpansión pulmonar si se vierten más de 1,5 litros. En este caso, es preferible un drenaje lento o la inserción de un drenaje torácico. La punción de alivio tiene una alta tasa de recurrencia del derrame y un bajo riesgo de neumotórax o empiema [11].
Drenaje torácico: En pacientes con un estado general aceptable y una esperanza de vida superior a 1 mes, debe realizarse un drenaje torácico con pleurodesis posterior. Los agentes esclerosantes producen una inflamación estéril de la pleura y aumentan la actividad fibrinolítica. La administración de esteroides reduce el efecto de la pleurodesis. El talco es la sustancia más eficaz y, por tanto, la más recomendada para la pleurodesis. Los antiinflamatorios no esteroideos (AINE) suelen ser posibles tras la pleurodesis. El tratamiento del dolor es el mismo que con los opiáceos (pero no mejor). No se ha demostrado ningún efecto negativo sobre la tasa de pleurodesis, por lo que los AINE después de la pleurodesis son bastante útiles y también se recomiendan (TIME-1-RCT) [12]. El diámetro de los drenajes torácicos recomendados ha disminuido aún más. Debido al menor dolor, las directrices de 2010 recomendaban drenajes finos (12F). Sin embargo, estos sistemas de drenaje, que se utilizan con frecuencia para los derrames pleurales, no muestran ninguna ventaja en cuanto a la sensación de dolor y presentan peores resultados en cuanto al éxito de la pleurodesis con talco.
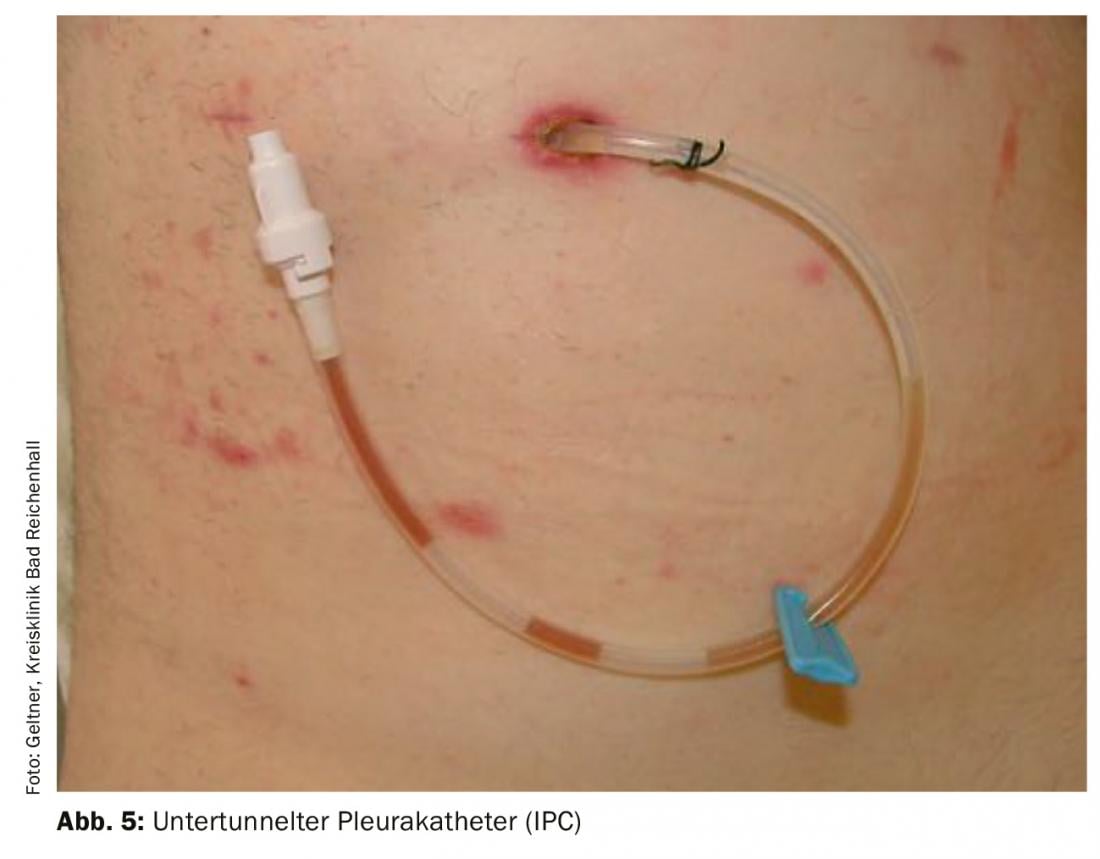
Catéteres pleurales implantables permanentes (CIP) [13] (Fig. 5): Los CIP son fáciles de implantar y muy seguros en cuanto a tasas de infección y complicaciones. Los pacientes podrán autogestionar los pinchazos de alivio utilizando sistemas sencillos de alivio por vacío. En caso necesario, la pleurodesis también puede realizarse a través de estos catéteres. La implantación suele realizarse de forma ambulatoria. La combinación de CIP sobre los que luego se aplica talco multiplicó por dos la tasa de pleurodesis aguda. La pleurodesis completa se consigue en un 45% al cabo de 5 semanas. Desde el punto de vista actual, la aplicación de talco debe llevarse a cabo tras la creación de una CIP. La retirada es así posible antes en numerosos casos [14].
Toracoscopia médica mínimamente invasiva: Este procedimiento es el método de elección para realizar la pleurodesis [15]. Bajo anestesia local con sedoanalgesia, la toracoscopia puede realizarse en la mayoría de los pacientes. No es necesaria la anestesia con intubación de doble luz. Incluso en una enfermedad muy avanzada y una mala función pulmonar o cardiaca, se puede lograr una pleurodesis suficiente mediante un poudrage de talco La tasa de éxito se sitúa entre el 80-90%.
Literatura:
- Krogel C: Inmunobiología de la inflamación pleural: implicación potencial para la patogénesis, el diagnóstico y la terapia. ERJ 1997; 10: 2411-2418
- Hott JW: Papel del VEGF en el desarrollo de derrames pleurales malignos. AJRCCM 1999; A212: 159.
- Yernault JC: Historia, síntomas y exploración clínica en las enfermedades pleurales. Monografía Eur Resp 2002; 22: 60-75.
- Traill ZC, Davies RJO, Gleeson FV: Tomografía computarizada torácica en pacientes con sospecha de derrame pleural maligno. Clin Radiol 2001; 56: 193-196.
- Giesel FL: RM dinámica con realce de contraste del mesotelioma pleural maligno: un estudio de viabilidad de la evaluación no invasiva, seguimiento terapéutico y posible predictor de un mejor resultado. Tórax 2006; 129; 1570-1576.
- Hooper C, et al: Investigación de un derrame pleural unilateral en adultos: directriz 2010 sobre enfermedades pleurales de la Sociedad Británica del Tórax. BMJ Thorax 2010; 65(Suppl 2): ii4-7.
- Loddenkemper R: Evaluación prospectiva de los métodos de biopsia en el diagnóstico del derrame pleural maligno. Comparación intrapaciente entre la citología del líquido pleural, la biopsia con aguja ciega y la toracoscopia. ARRD 1983; 127: 114.
- Astoul P: Pleurodesis para derrames pleurales malignos recurrentes: la búsqueda del Santo Grial. Eur J Cardiothorac Surg 2011; 40(2): 277-279.
- Geltner C, Errhalt P: Derrame pleural maligno: patogenia, diagnóstico y tratamiento. MEMO 2016, en línea el 19.11.2016. DOI 10.1007/s12254-015-0246-0.
- Feller-Kopman DJ, Manejo del derrame pleural maligno. Una Guía Oficial de Práctica Clínica de la ATS/STS/STR. Am J Respir Crit Care Med 2018; 198(7): 839-849.
- Sorensen PG, Svendsen TL, Enk B: Tratamiento del derrame pleural maligno con drenaje, con y sin instilación de talco. Eur J Respir Dis 1984; 65: 131-135.
- Rahman NM: Effect of Opioids vs NSAIDs and Larger vs Smaller Chest Tube Size on Pain Control and Pleurodesis Efficacy Among Patients With Malignant Pleural Effusion: The TIME1 Randomized Clinical Trial. JAMA 2015; 314(24): 2641-2653.
- Musani AI: Opciones de tratamiento para el derrame pleural maligno. Curr Opin Pulm Med 2009; 15: 380-387.
- Bhatnagar R: Administración ambulatoria de talco mediante catéter pleural permanente para el derrame maligno. NEJM 2018; 378(14): 1313-1322.
- Tschopp JM, et al: Pleurodesis by talc poudrage under simple medical thoracoscopy: an international opinion. Tórax 2009; 64(3): 273-274.
- Light RW: Derrames paraneumónicos y empiema. Proc Am Thorac Soc 2006; 3(1): 75-80.
- Mac Duff A, Arnold A, Harvey J: Manejo del neumotórax espontáneo: directriz 2010 de la Sociedad Británica del Tórax sobre la enfermedad pleural, Thorax 2010; 65: ii18-ii31.
PRÁCTICA GP 2019; 14(9): 16-20