Las células T dotadas de especificidad tumoral mediante la expresión de un receptor de antígeno quimérico (CAR) están adquiriendo cada vez más importancia. Ya se utilizan cada vez más en la terapia celular adoptiva en la lucha contra el cáncer. La principal ventaja de transferir un CAR frente a transferir un receptor de células T (TCR) normal es que un CAR puede reconocer el tumor independientemente del CMH.
Las células T dotadas de especificidad tumoral mediante la expresión de un receptor de antígeno quimérico (CAR) están adquiriendo cada vez más importancia. Ya se utilizan cada vez más en la terapia celular adoptiva en la lucha contra el cáncer. El concepto CAR fue desarrollado originalmente a finales de los años 80 por Zelig Eshhar (Instituto Weizmann de Ciencia, Rehovot, Israel) [1,2]. La mayoría de los CAR consisten en una construcción scFv derivada de un anticuerpo que se une al antígeno tumoral (fragmento variable de cadena única, que es una proteína de fusión producida artificialmente que consiste en una parte variable de una cadena ligera y pesada de una inmunoglobulina) y la parte intracelular de la cadena CD3ζ, el en do sostenido está vinculada a uno o varios dominios costimuladores [3]. Esta estructura en bloque permite la activación de células T específicas de antígeno en respuesta al reconocimiento específico de antígenos en la superficie de células malignas, iniciada por la unión de scFv, y la posterior señalización a través de la cadena CD3ζ y el dominio coestimulador [3]. La coestimulación suele producirse a través del CD28 (superfamilia de inmunoglobulinas) o a través del 4-1BB (superfamilia de receptores del TNF) [3]. Sin embargo, también existen muchos otros formatos. La principal ventaja de transferir un CAR frente a transferir un receptor de células T (TCR) normal es que un CAR puede reconocer el tumor independientemente del CMH.
Esta tecnología se ha utilizado hasta ahora para desarrollar CAR que se dirigen a diversos antígenos de la superficie celular de tumores sólidos o hematológicos. Las células CAR-T, específicas para antígenos diana como el CD19 de las células B o el antígeno de maduración de células B (BCMA) de las células plasmáticas, provocaron impresionantes regresiones clínicas en leucemias, linfomas o mielomas en varios estudios clínicos [4–6]. Resultados como éstos condujeron, entre otras cosas la aprobación de tisagenlecleucel para el tratamiento de la leucemia linfoblástica aguda de células B (LLA), axicabtagene-ciloleucel para el tratamiento del linfoma no Hodgkin agresivo de células B Brexucabtagene-Autoleucel para el tratamiento del linfoma de células del manto, Lisocabtagene-Maraleucel para el tratamiento del linfoma de células B grandes e Idecabtagene-Vicleucel y Ciltacabtagene-Autoleucel para el tratamiento del mieloma múltiple por el Administración de Alimentos y Medicamentos de EE.UU. (FDA) y la Agencia Europea de Medicamentos (EMA) [3].
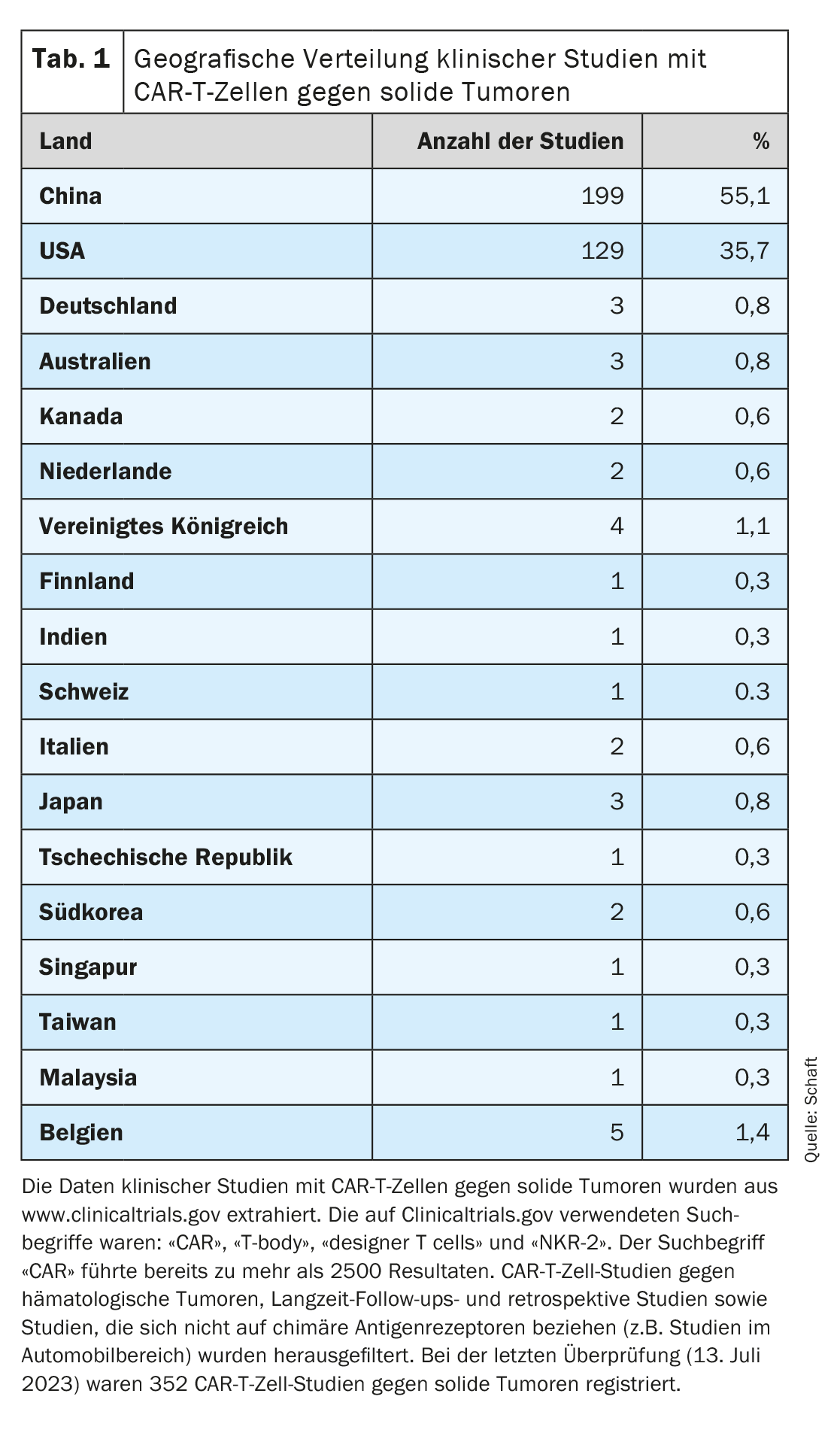
Dado que la mayoría de los ensayos clínicos se centran en la eliminación de tumores hematológicos, el desarrollo de células CAR-T contra tumores sólidos va a la zaga (visión detallada en [7–11]). Si observamos la distribución geográfica de los ensayos clínicos con células CAR-T contra tumores sólidos registrados en Clinicaltrials.gov (n=352; última evaluación el 13 de julio de 2023), queda claro que la mayoría de estos ensayos se están llevando a cabo en China (n=199; 55,1%). Estados Unidos ocupa el segundo lugar (n=129; 35,7%). Son muy pocos los estudios realizados en Europa (Alemania n=3, Suiza n=1), Australia y el resto de Asia (combinados n=33; 9,2%) (Tabla 1).
Formatos CAR
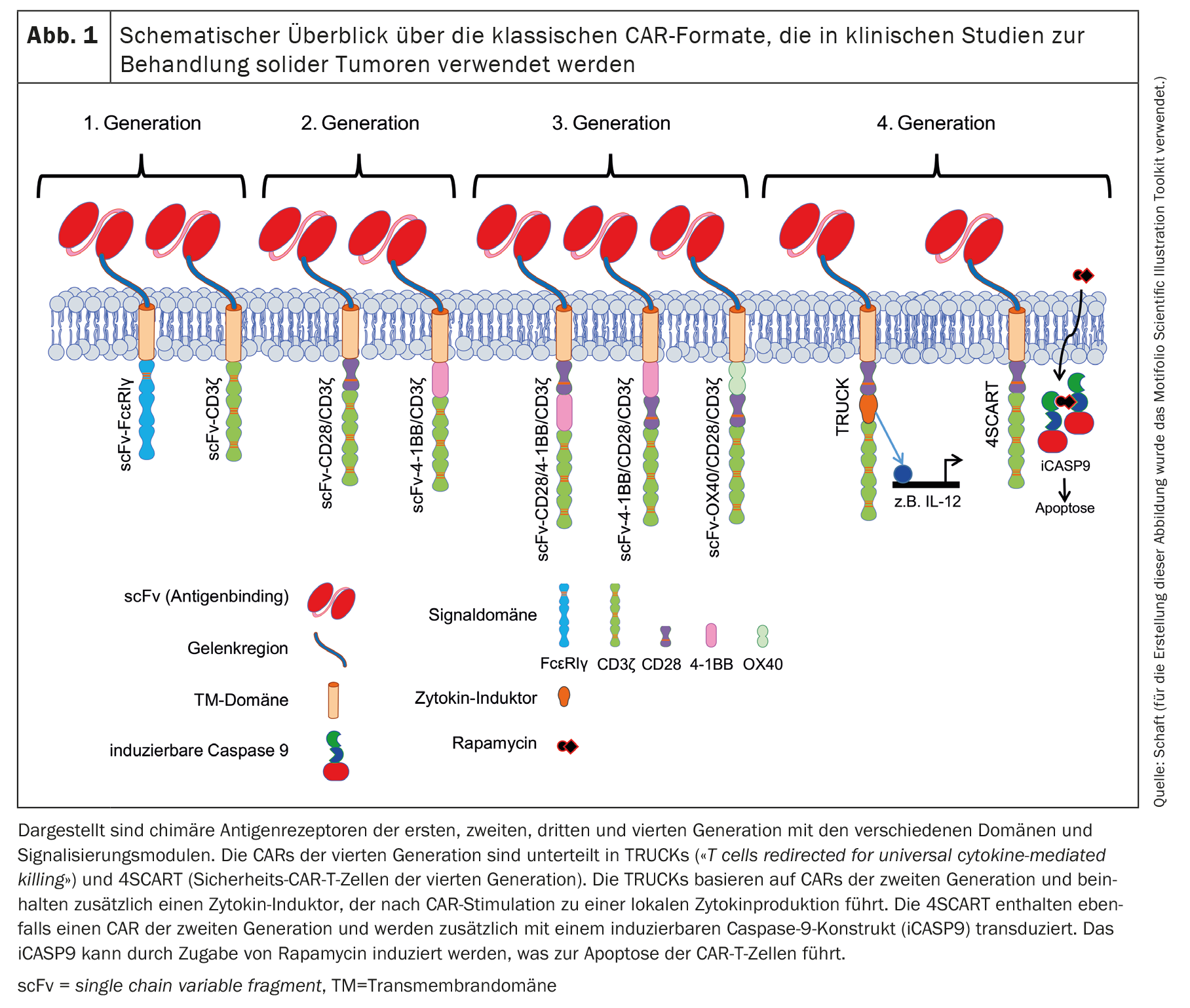
Desde la publicación del primer concepto de CAR por Zelig Eshhar en 1989 [1,2], los CAR no han dejado de desarrollarse. Esto dio lugar a varias generaciones de CAR basadas en el marco básico del concepto original de CAR. El CAR clásico siempre contiene un scFv basado en un anticuerpo que puede unirse al antígeno tumoral. En los CAR de primera generación (Fig. 1), la scFv se conecta al dominio de señalización intracelular de FcεRIγ o CD3ζ a través de un enlazador flexible y un dominio transmembrana [11,12].
La mayoría de los ensayos clínicos registrados con células CAR-T contra tumores sólidos utilizan un CAR de segunda generación [11,12], que también contiene un dominio costimulador (Fig. 1 ). La coestimulación suele realizarse mediante CD28 o 4-1BB [3]. La coestimulación con CD28 favorece fisiológicamente la producción de IL-2, -6, -10 y otras interleucinas, así como la progresión del ciclo celular, la supervivencia, la diferenciación y la función citolítica de las células T [13]. En muchos estudios en los que se utilizaron CAR con un dominio de señalización CD28, se observaron efectos antitumorales eficaces y rápidos. Sin embargo, éstos sólo fueron de corta duración y se asociaron a una supervivencia limitada in vivo en comparación con los CAR con un dominio de señalización 4-1BB, por ejemplo [14]. La señalización 4-1BB fisiológica en las células T mejora la progresión del ciclo celular y la proliferación, la secreción de citocinas, el potencial citolítico de las células T e inhibe la eliminación clonal y lamuerte celular inducida por activación (AICD) [15,16]. Los CAR que contienen 4-1BB como dominio de señalización no sólo permitieron una activación celular más robusta y una mayor persistencia in vivo, sino que también promovieron la diferenciación de las células CAR-T haciacélulas de memoria central [4,14,17–24].
Los CAR de tercera generación [11,12] contienen combinaciones de dominios costimuladores: CD28/4-1BB, 4-1BB/CD28 u OX40/CD28 (Fig. 1) [25,26]. Los CAR de cuarta generación son básicamente CAR de segunda generación con características adicionales. Las TRUCK (células T redirigidas para la destrucción universal mediada por citocinas) se modifican de tal forma que producen citocinas de forma localizada muy limitada [27]. Los efectos inducidos dependen del tipo de citocinas liberadas: La IL-12, por ejemplo, puede activar una respuesta inmunitaria innata contra el tumor [28], provoca una menor susceptibilidad a los efectos inhibidores de las células T reguladoras (Tregs) [29] y aumenta la secreción de citocinas y la proliferación de células T [30,31]. La IL-15, por su parte, aumenta la actividad antitumoral de las células CAR-T [32].
Otra variante de la cuarta generación es el 4SCART (células CAR-T de seguridad). Estas células T se transducen simultáneamente con un CAR y una caspasa 9 inducible (iCASP9) como medida de seguridad frente a acontecimientos adversos. iCASP9 puede inducirse mediante la adición de rapamicina, lo que conduce a la apoptosis de las células CAR-T.
Tecnologías de transferencia
Un requisito esencial en la producción de células T CAR es encontrar un método adecuado para transferir el CAR a las células T. Para ello se pueden utilizar varios métodos existentes. La mayoría de los ensayos clínicos utilizan un método de transferencia viral (retroviral o lentiviral) para introducir de forma estable el CAR en las células T. Durante este proceso, un gen codificador de CAR es transportado desde el virus hasta la célula T, donde se integra de forma estable en el ADN genómico. La progenie de estas células transducidas es portadora del gen CAR y puede expresar el receptor en su superficie celular. Las desventajas de la transducción viral son la integración aleatoria en el genoma de la célula huésped, que puede conducir a la destrucción o activación de algunos genes (es decir, mutagénesis insercional), así como la introducción de material/genes virales. Este método puede provocar efectos secundarios graves en los pacientes tratados con células CAR-T. Lamers et al. describieron, por ejemplo, el desarrollo de respuestas inmunitarias al transgén que codifica el receptor y al vector retroviral [33].
Algunos ensayos clínicos utilizan un sistema de administración de genes no viral o un método de transferencia que integra el gen CAR en un lugar específico (por ejemplo, el sistema de transposones Sleeping Beauty [34–37], el sistema de transposones PiggyBac [36,37], CRISPR-Cas9 [38]). La transfección de ADN o ARN son otros sistemas de transferencia [39], que, sin embargo, no conducen a la integración de la secuencia codificante del CAR en el genoma de la célula huésped. La expresión transitoria resultante del CAR tiene ciertas ventajas.
Células CAR-T contra tumores sólidos: selección de antígenos y precauciones de seguridad
Como se ha descrito anteriormente, el uso clínico de las células CAR-T en el tratamiento de tumores sólidos va a la zaga del éxito de las células CAR-T en el tratamiento de tumores hematológicos. Una de las razones es que el CD19 y el BCMA son antígenos diana que expresan específicamente los linfocitos B o las células plasmáticas y su eliminación completa es relativamente inocua. Otros antígenos, especialmente en los tumores sólidos, suelen expresarse también en el tejido sano, lo que dificulta la selección de un antígeno diana adecuado.
Selección del antígeno
Los antígenos diana ideales en tumores sólidos combinan tres propiedades esenciales:
- Expresión uniforme en la superficie de las células malignas, lo que reduce el riesgo de variantes de escape antígeno-negativas.
- Ausencia de expresión en células no malignas (es decir, expresión exclusiva en las células tumorales), evitando así el riesgo de efectos secundarios graves y potencialmente mortales derivados de la actividad on-target/off-tumour de las células CAR-T [40,41].
- Un papel crucial como impulsor oncogénico en las células cancerosas que impide la regulación a la baja de los antígenos debido a una ventaja selectiva de supervivencia de las células malignas.
- Además, la coexpresión del antígeno en células vecinas dentro del microentorno tumoral (por ejemplo, en vasos asociados al tumor, fibroblastos y macrófagos) es otra característica positiva de un antígeno diana ideal, ya que la estructura de suministro del tumor puede ser atacada por la terapia específica del antígeno.
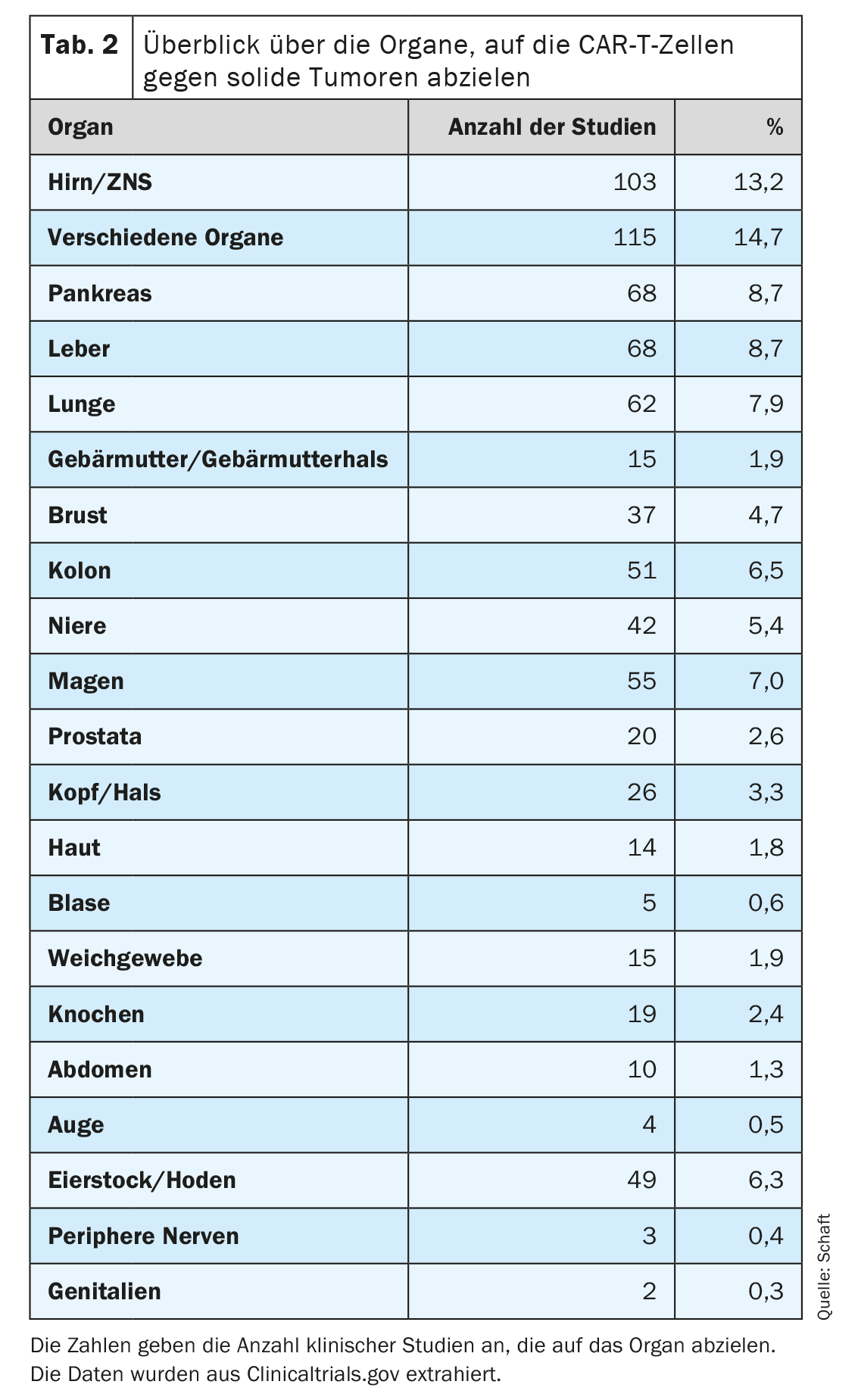
El segundo punto en particular plantea el mayor problema para el desarrollo de células CAR-T contra tumores sólidos, ya que la mayoría de los antígenos expresados en los tumores sólidos también se expresan en importantes tejidos sanos. Esto puede dar lugar a una reacción indeseable on-target/off-tumor y a los efectos secundarios asociados. No obstante, muchos tipos de tumores sólidos diferentes (81 entidades cancerosas en total) en un total de 20 órganos están siendo atacados con células CAR-T específicas para 63 antígenos diferentes (Tabla 2). En muchos estudios clínicos se están investigando sobre todo tumores del cerebro/sistema nervioso central, el hígado, el páncreas y el pulmón (n=103, 68, 68 y 62 respectivamente; Tab. 2). Esto podría deberse a la gran necesidad médica y/o a la falta de terapias alternativas eficaces para los tumores en los órganos correspondientes.
Precauciones de seguridad
Si las células CAR-T transferidas reconocen un antígeno diana en el tejido sano, pueden producirse efectos secundarios graves e indeseables. Se han desarrollado varias estrategias para desconectar las células CAR-T lo antes posible en caso de toxicidad en el paciente. La rapamicina, una molécula capaz de inducir la dimerización de los constructos, puede utilizarse, por ejemplo, para activar una caspasa 9 inducible. En el 4SCART, estas construcciones inducibles se transfieren a las células T simultáneamente con el CAR como un denominado interruptor suicida (Fig. 1). Tras la dimerización inducida por rapamicina, la caspasa 9 induce la apoptosis de las células T CAR. Esto también elimina la actividad no deseada/inesperada de las células T contra el tejido sano(efectos on-target/off-tumor) [42,43]. Otros posibles interruptores, como la estrategia timidina quinasa/ganciclovir del virus del herpes simple (VHS-tk/GCV) [44,45] ya están en uso [11].
Una medida de seguridad especial para eludir la autoinmunidad prolongada inducida por una reacción on-target/off-tumoral del CAR es la transfección del CAR mediante electroporación de ARNm [11]. Ya hemos demostrado en varias publicaciones que la transfección transitoria de células T con CARs mediante electroporación de ARNm puede ser una herramienta eficaz y segura en la inmunoterapia del cáncer [46-50]. El proceso de electroporación se basa en complejos mecanismos fisicoquímicos que conducen a la perforación de la membrana plasmática mediante la aplicación de campos eléctricos y permiten la posterior entrada del ARNm en el citosol [51]. El uso de células CAR-T transfectadas con ARN ofrece la ventaja de que la expresión del receptor está limitada en el tiempo, por lo que también se limita la posible toxicidad fuera del objetivo y dentro del objetivo/fuera del tumor. La estrategia de transferencia de CAR-ARN resulta especialmente atractiva en los ensayos clínicos de fase 0/1 que investigan antígenos tumorales novedosos para la terapia con células T CAR con un perfil de seguridad clínica desconocido.
Células CAR-T probadas clínicamente contra el melanoma uveal
Sorprendentemente, sólo cuatro estudios clínicos de células T CAR contra tumores sólidos se centran en el ojo (Tabla 2) . De ellos, dos estudios se dirigen contra el retinoblastoma y otros dos contra el melanoma uveal. El melanoma uveal es el tipo más común de cáncer ocular y hace metástasis hasta en el 50% de los pacientes. Las metástasis se producen predominantemente en el hígado y se asocian a una mala mediana de supervivencia de unos 12 meses. A pesar de los enormes avances en el tratamiento del melanoma cutáneo metastatizado con el bloqueo de los puntos de control inmunitarios (BCI), éste no es eficaz en el melanoma uveal. Sólo el captador biespecífico de células T Tebentafusp (un scFv específico de CD3 unido a un TCR soluble que reconoce un péptido gp100 presentado por HLA-A2), recientemente aprobado, puede atenuar la progresión y prolongar la supervivencia global en un subconjunto de pacientes con melanoma uveal metastásico. Los efectos positivos observados del tebentafusp son de corta duración, con una mediana de supervivencia global de 22 meses y una tasa de supervivencia a tres años del 24%. Además, sólo el 50% de los pacientes con metástasis pueden optar a esta opción de tratamiento debido a la restricción HLA-A2. Por lo tanto, también existe una gran necesidad médica de enfoques terapéuticos alternativos para esta entidad tumoral.
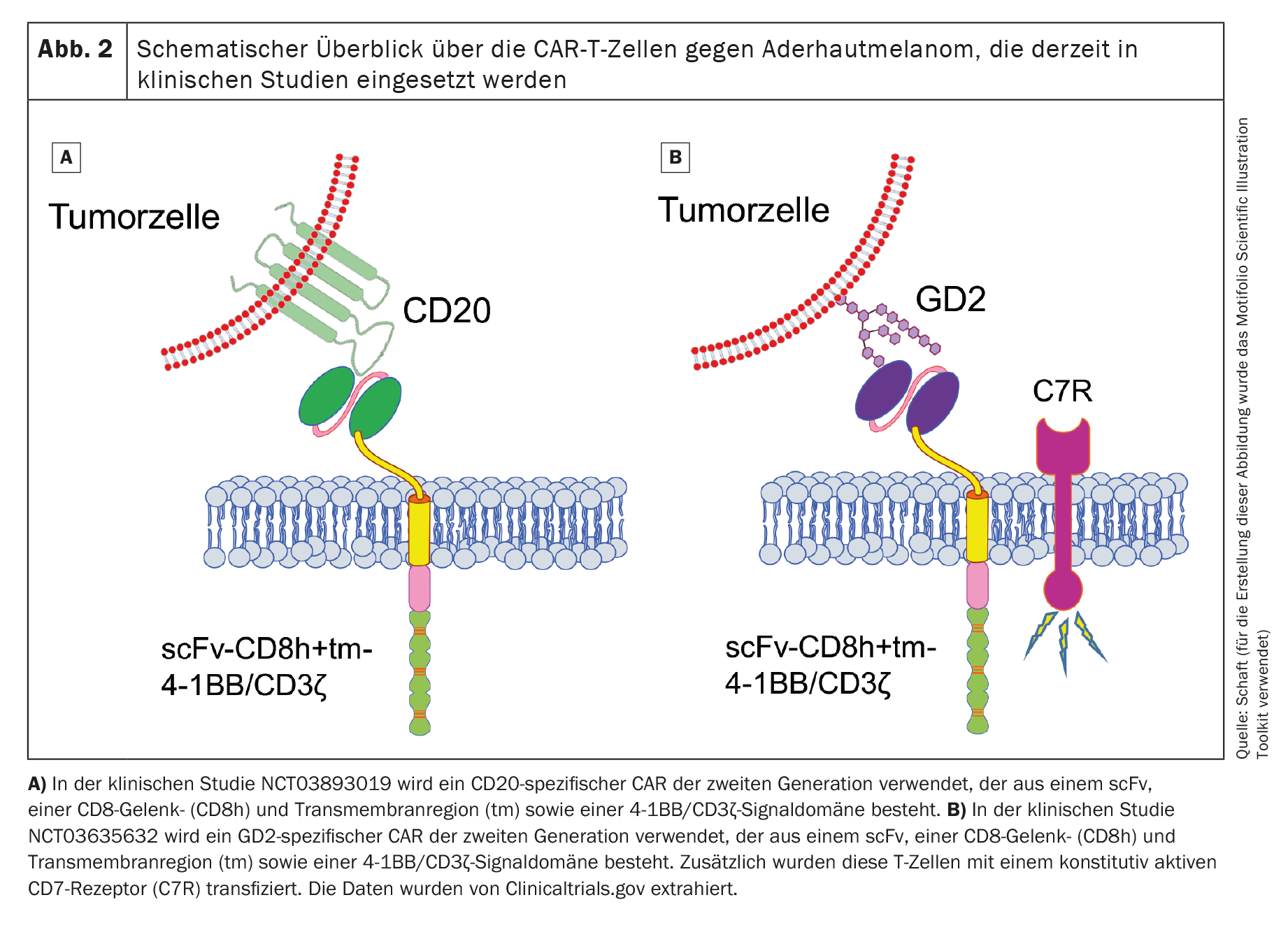
Dos ensayos clínicos con células CAR-T incluidos en la lista internacional de la Biblioteca Nacional de Medicina de EE.UU. (www.clinicaltrials.gov) están reclutando actualmente pacientes con melanoma uveal (NCT03893019 contra el cúmulo de diferenciación 20 [CD20] y NCT03635632 contra el disialogangliósido GD2 [GD2]). Ambos estudios utilizan células CAR-T dirigidas a antígenos no específicos del melanoma.
El primer ensayo clínico (fase 1; NCT03893019), que utiliza células CAR-T CD20-específicas de segunda generación (Fig. 2A), está patrocinado por Miltenyi Biomedicine GmbH (Investigador principal [PI]: Peter Borchmann; Hospital Universitario de Colonia) y está reclutando principalmente a pacientes con melanoma cutáneo. Algunos pacientes con melanoma uveal también reciben tratamiento. El CD20 es un antígeno diana que se expresa en los linfocitos B normales y que suele utilizarse como antígeno diana en el linfoma no Hodgkin de células B [52]. Sin embargo, también se expresa en un pequeño subconjunto de células de melanoma [53,54]. Sin embargo, el tratamiento dirigido de un antígeno que sólo se expresa en un pequeño subgrupo de células cancerosas podría hacer que el tumor escapara fácilmente a la terapia con células CAR-T. Por desgracia, se desconoce el estado actual de este ensayo clínico.
El segundo ensayo clínico (también de fase 1; NCT03635632) utiliza células CAR-T específicas de GD2 (Fig. 2B) y está reclutando pacientes con neuroblastoma, sarcoma, melanoma uveal, cáncer de mama u otros tipos de cáncer que expresen GD2. Este estudio, patrocinado por el Baylor College of Medicine (IP: Bilal Omer; Baylor College of Medicine), está actualmente activo, pero no se está reclutando a ningún paciente.
Además del CAR de segunda generación, los investigadores también transducen un receptor de IL-7 constitutivamente activo en las células T con el fin de prolongar la supervivencia de las células CAR-T tras la transferencia adoptiva. El GD2 se expresa, aunque a niveles muy bajos, en el cerebelo y los nervios periféricos [55], lo que hace que el tratamiento con células CAR-T específicas de GD2 sea muy arriesgado si se induce una reacción on-target/off-tumor. Tampoco se han publicado aún datos sobre este ensayo clínico.
En resumen, existe un gran potencial para los ensayos clínicos con células CAR-T contra antígenos específicos del melanoma (uvea) en los que el riesgo de una reacción on-target/off-tumoral es bajo.
La búsqueda de un mejor antígeno tumoral en el melanoma uveal
La prevención o reducción de una posible reacción on-target/off-tumoral es, como ya se ha mencionado en la sección “Células CAR-T contra tumores sólidos”, un requisito básico en la búsqueda de nuevos antígenos. Preclínicamente, la atención se centra actualmente en dos antígenos expresados en los melanomas uveales: el receptor 2 del factor de crecimiento epidérmico humano (HER2) y el proteoglicano 4 de condroitín sulfato (CSPG4).
HER2
HER2 es un miembro de la familia ErbB de receptores tirosina quinasas (EGFR [ErbB-1], HER2 [/neu] [ErbB-2], Her 3 [ErbB-3] y Her 4 [ErbB-4]). Las mutaciones en HER2 conducen a la sobreexpresión, lo que provoca una activación constitutiva y una división celular incontrolada. Esto se aplica sobre todo al cáncer de mama, pero también a otros tipos de cáncer como el de ovario o los gliomas [56–58].
Como ya se ha mencionado, el uso de células CAR-T es un arma de doble filo, ya que la eficacia de estas células también puede volverse en contra del paciente [59]. Nunca se puede descartar que un tipo de célula poco frecuente pero esencial exprese el antígeno en el tejido sano. Investigadores del Instituto Nacional del Cáncer informaron de un caso que ilustra el potencial mortal de la toxicidad on-target/off-tumoral del antígeno HER2. Poco después de la infusión de células CAR-T específicas para HER2, se observaron síntomas clínicos de síndrome de dificultad respiratoria aguda que requirieron respiración artificial en un paciente con cáncer colorrectal metastásico [60]. Por desgracia, la paciente falleció cinco días después de la aparición de la dificultad respiratoria aguda [60]. La causa de la muerte fue probablemente el resultado de la toxicidad on-target/off-tumoral causada por los bajos niveles de HER2 en las células epiteliales de los pulmones. Sorprendentemente, el CAR se basó en el anticuerpo monoclonal trastuzumab, aprobado por la FDA, que se ha utilizado ampliamente sin causar toxicidad pulmonar grave [61]. Esto subraya la necesidad de una selección muy cuidadosa del antígeno diana para la terapia con células T CAR.
CSPG4
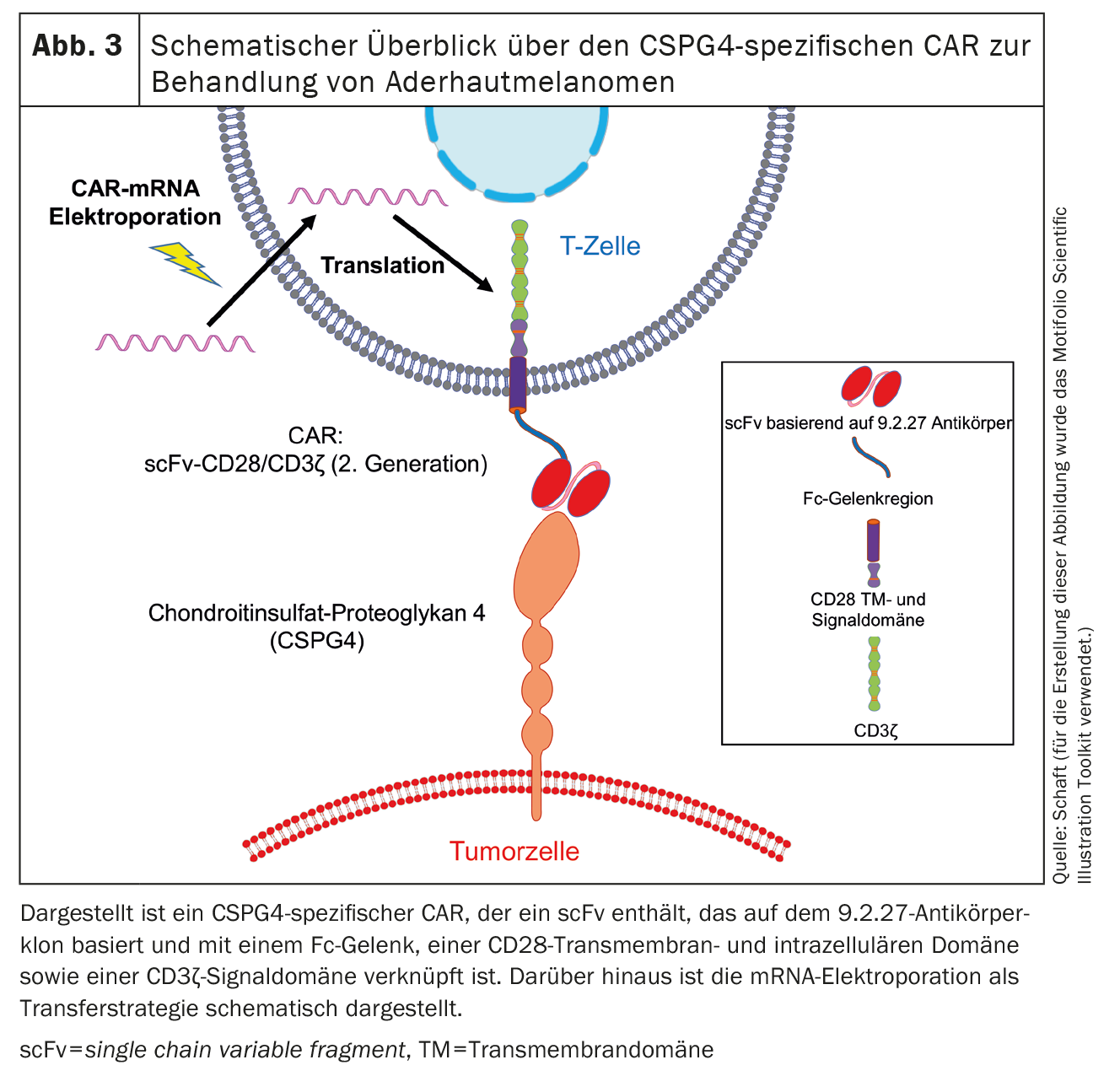
El segundo antígeno expresado en los melanomas uveales es el condroitín sulfato proteoglicano 4 (CSPG4) (Fig. 3), antes también conocido como condroitín sulfato proteoglicano asociado al melanoma (MCSP) o antígeno asociado al melanoma de alto peso molecular (HMW-MAA). La CSPG4 es una proteína transmembrana de paso único de tipo 1 y fue descubierta por Ralph Reisfeld [72]. Nosotros y otros grupos de trabajo [47-50, 62-71] trabajamos principalmente en el CSPG4. La expresión de CSPG4 se asocia con una mayor proliferación y una mayor supervivencia de las células tumorales. Esto se inicia por la activación de la vía de señalización MAPK y la presentación cruzada de los factores de crecimiento [73]. Además, la CSPG4 desempeña un papel en la motilidad celular y la infiltración tisular debido a su asociación con el citoesqueleto de actina y su unión a diversas integrinas y componentes de la matriz extracelular [74]. Además, el CSPG4 está implicado en la formación de la placenta [75], la angiogénesis [76], la formación de redes neuronales [77], el recambio de los queratinocitos y la homeostasis de las células madre epidérmicas [78].
Varias publicaciones han descrito la expresión de CSPG4 en tejidos no patológicos, como los precursores del folículo piloso y las células epidérmicas, las células endoteliales y los pericitos activados (pero no en vasos maduros) [79,80], los condrocitos del cartílago articular [81], las células musculares lisas [82] y las células de la sinapsis neuromuscular del músculo esquelético postnatal humano [83]. Sin embargo, el CSPG4 se expresa significativamente menos en el tejido sano que en las células tumorales [62,73,84].
Beard et al. demostraron que el CSPG4 podía detectarse a nivel de ARN en diversos tejidos normales, como el sistema nervioso central, el ojo, la piel, el tejido adiposo, los vasos sanguíneos, la vejiga, el tracto gastrointestinal, el útero, la próstata, el bazo y el timo [85]. Por término medio, el ARN de CSPG4 se sobreexpresa 6,6 veces en el tejido maligno (melanoma) en comparación con el tejido sano [85]. Estos resultados confirmaron trabajos anteriores de Erfurt et al. que demostraron que, aunque el ARNm de CSPG4 podía detectarse en algunas muestras de tejido normal, la expresión aumentaba significativamente en las muestras de melanoma cutáneo y melanoma uveal [86].
La tinción inmunohistoquímica y las matrices de proteínas en fase inversa mostraron que la expresión específica de CSPG4 a nivel proteico sólo podía detectarse en algunas muestras del intestino delgado [63]. No se detectó expresión de la proteína CSPG4 en los tejidos siguientes: Cerebro, nervios periféricos, piel, mesotelio, mama, corazón, riñón, glándulas suprarrenales, hígado, pulmón, ganglios linfáticos, músculos, ovarios, páncreas, esófago, próstata, bazo, estómago, útero y tiroides [62,63]. Por el contrario, la CSPG4 se expresa en casi todas las células de melanoma cutáneo [87–90]. Los melanomas coroideos [91,92] y algunos otros tumores como sarcomas, astrocitomas, gliomas, neuroblastomas [93-96], leucemias [97–101] y cáncer de mama triple negativo también expresan CSPG4 [102]. En muchas de estas neoplasias, la expresión de CSPG4 se asocia a un mal pronóstico y a un crecimiento tumoral agresivo [103].
Además, el CSPG4 se considera un antígeno diana tumoral primario [84], ya que desempeña un papel en la metástasis del melanoma [104] y se expresa en los pericitos activados durante la angiogénesis en los tumores y en la hipoxia [105–107]. Este último permite dirigirse a la vasculatura tumoral. Y lo que es más importante, el CSPG4 actúa como impulsor oncogénico en el melanoma y promueve el crecimiento y la supervivencia de las células malignas tras la activación de varias vías de señalización [73]. Por lo tanto, el tumor no puede simplemente regular a la baja CSPG4 para escapar a la terapia dirigida a CSPG4.
Por este motivo, el CSPG4 ya ha sido seleccionado como antígeno diana por varios grupos y se han introducido CAR específicos del CSPG4 en las células T a través de diversos mecanismos. CARs específicos de CSPG4 de diferentes formatos, que fueron transducidos viralmente en células T, dieron lugar a una fuerte citotoxicidad de las células T in vitro . En modelos animales, las células T transferidas adoptivamente reaccionaron ante diversos tumores que expresaban CSPG4, como el melanoma, el cáncer de mama, el mesotelioma, el glioblastoma y el osteosarcoma [47–50,62–71]. Geldres et al. transdujeron retroviralmente un CAR específico de CSPG4 de segunda generación en células T. In vitro, estas células T CAR específicas de CSPG4 fueron capaces de reconocer y lisar células de melanoma de forma antígeno-específica [65]. Además, la unión del antígeno al CAR provocó una secreción pronunciada de IL-2 e IFNγ. In vivo , la transferencia de células CAR-T específicas de CSPG4 a ratones portadores de células de melanoma provocó una ralentización significativa del crecimiento tumoral y una mejora de la supervivencia global de los ratones [65]. En la misma publicación, se describió la falta de reactividad positiva de las células CAR-T específicas de CSPG4 frente al tejido normal con ARN de CSPG4 detectable pero sin expresión de proteína CSPG4 [65]. Pudieron demostrar que las células CAR-T específicas de CSPG4 no ejercían una citotoxicidad significativa contra las líneas celulares epiteliales primarias de próstata, pulmón y riñón [65]. Por lo tanto, los análisis de expresión de Beard et al. [63,85], mitigan las preocupaciones descritas anteriormente con respecto a latoxicidad inducida por células CAR-T específicas de CSPG4en el objetivo y fuera del tumor, ya que se requiere la expresión de CSPG4 a nivel proteico para inducir una reactividad no deseada de las células CAR-T.
Hasta ahora, hemos utilizado el método de transfección de ARNm por electroporación para introducir CARs en células T. En este sentido, ya hemos probado varios CAR específicos de CSPG4 y hemos observado que las células CAR-T transfectadas con ARNm son capaces de eliminar las células tumorales de forma antígeno-específica. La cinética de expresión de los CAR transferidos por electroporación depende de la columna vertebral del CAR [47]. Se identificó un CAR que presenta tanto una alta expresión en las células T como una elevada reactividad antitumoral. Este CAR contiene un scFv basado en el clon del anticuerpo 9.2.27 unido a un espaciador Fc, un dominio transmembrana e intracelular CD28 y un dominio de señalización CD3ζ. [47](Fig. 3). Los experimentos in vivo con ratones inmunodeficientes Rag-/-/de cadena γ común-/- demostraron que las células CAR-T transfectadas específicas de CSPG4 prolongaban significativamente el tiempo medio de supervivencia de los ratones [47].
Con el fin de transferir las células CAR-T específicas de CSPG4 a la aplicación clínica, se estableció en el laboratorio la producción de células CAR-T a escala clínica mediante la transfección de ARNm de un CAR en plena conformidad con las BPF [50]. Esto demostró que es posible la producción repetida de un número suficiente de células T transfectadas con CAR específicos de CSPG4 de gran pureza. Estas células T modificadas muestran una eficiencia de transfección muy elevada, una alta expresión de CAR y una gran eficacia para eliminar las células diana del melanoma [50].
Aunque el CSPG4 es un antígeno diana tumoral primario, sobre todo en el melanoma cutáneo, también descubrimos que no se expresaba en varias líneas celulares de melanoma uveal que analizamos. Por ello, hemos establecido una plataformacombinada in silico/in vitropara identificar nuevos antígenos de la superficie celular específicos de los tumores de melanomas uveales. Utilizando esta plataforma, hemos identificado una proteína candidata como antígeno diana adecuado en el melanoma uveal para el desarrollo de nuevos CAR. Los CAR generados que pueden unirse a esta proteína candidata se están probando actualmente para comprobar su funcionalidad y especificidad.
Outlook
El uso de células CAR-T en el tratamiento de tumores sólidos encierra un gran potencial. Se necesitan más estudios preclínicos y ensayos clínicos para responder a la gran necesidad médica de tratamiento de entidades cancerosas sólidas (como el melanoma uveal).
Los futuros ensayos clínicos deberán centrarse en probar nuevos formatos de CAR. Además de probar nuevos dominios extracelulares de unión a antígenos y nuevos dominios de señalización intracelular [109], esto también incluye probar formatos que aumenten la seguridad del uso de células CAR-T [108]. Además, los nuevos vehículos celulares para la transferencia de CAR [109,110] prometen ampliar la gama de aplicaciones. Por ejemplo, la posibilidad de utilizar de forma estándar células CAR-NK [111] o células CAR-T alogénicas [112] puede reducir los costes de la terapia celular CAR y hacerla así accesible a más pacientes.
Además, deben encontrarse más antígenos específicos del tumorpara evitar las reacciones on-target/off-tumor. Los antígenos que se expresan en el estroma tumoral y que pueden ser atacados allí por las células CAR-T son muy prometedores en este ámbito [113]. La focalización de múltiples antígenos por una célula CAR-T (es decir, la expresión de diferentes CAR específicos para diferentes antígenos en una única célula) puede aumentar la especificidad tumoral y reducir el riesgo de efectos fuera de diana. Esto también se aplica al modelo cuando los módulos de señalización intracelular se dividen entre los diferentes CAR para aumentar el perfil de seguridad de las células CAR-T. Esto también hace menos probable el desarrollo de variantes de pérdida de antígeno de los tumores.
Además, las terapias combinadas de células CAR-T con diversas moléculas pequeñas o anticuerpos monoclonales para evitar los mecanismos de escape del tumor y aumentar la actividad antitumoral ya se están probando clínicamente en muchos tumores hematológicos (resumen detallado en [114,115]). Estas combinaciones también son prometedoras para el tratamiento de tumores sólidos y deberán probarse en ensayos clínicos en un futuro próximo.
N.S. realizó la investigación en clinicaltrials.gov, revisó las figuras y redactó el manuscrito. S.H. editó el manuscrito. N.S. y S.H. redactaron conjuntamente las preguntas de formación de la CME.
Literatura:
- Gross G, Gorochov G, Waks T, Eshhar Z: Generación de células T efectoras que expresan receptores quiméricos de células T con especificidad de tipo de anticuerpo. Transplant Proc 1989; 21(1 Pt 1): 127-130.
- Gross G, Waks T, Eshhar Z: Expresión de moléculas quiméricas de receptores de células T de inmunoglobulina como receptores funcionales con especificidad de tipo anticuerpo. Proc Natl Acad Sci U S A. 1989; 86(24): 10024-10028.
- June CH, Sadelain M: Terapia con receptores de antígenos quiméricos. N Engl J Med 2018; 379(1): 64-73.
- Maude SL, Laetsch TW, Buechner J, et al: Tisagenlecleucel en niños y adultos jóvenes con leucemia linfoblástica de células B. N Engl J Med 2018; 378(5): 439-448.
- Neelapu SS, Locke FL, Go WY: Terapia con células T CAR en el linfoma de células B grandes. N Engl J Med 2018; 378(11): 1065.
- Schuster SJ, Bishop MR, Tam CS, et al: Tisagenlecleucel en linfoma difuso de células B grandes recidivante o refractario en adultos. N Engl J Med 2019; 380(1): 45-56.
- Wang Z, Guo Y, Han W: Estado actual y perspectivas de las células T modificadas con receptores de antígenos quiméricos para el tratamiento del cáncer. Protein Cell 2017; 8(12): 896-925.
- Han S, Latchoumanin O, Wu G, et al: Ensayos clínicos recientes que utilizan terapias con células T receptoras de antígenos quiméricos contra tumores sólidos. Cancer Lett 2017; 390: 188-200.
- Yeku O, Li X, Brentjens RJ: Terapia con células T adoptivas para tumores sólidos. Am Soc Clin Oncol Educ Book 2017; 37: 193-204.
- Arabi F, Torabi-Rahvar M, Shariati A, et al: Objetivos antigénicos de la terapia con células T CAR. Una visión retrospectiva de los ensayos clínicos. Exp Cell Res 2018; 369(1): 1-10.
- Schaft N: The Landscape of CAR-T Cell Clinical Trials against Solid Tumours-A Comprehensive Overview. Cánceres (Basilea) 2020; 12(9).
- Holzinger A, Abken H: Células T CAR: Una instantánea sobre las crecientes opciones para diseñar una CAR. Hemasphere 2019; 3(1): e172.
- Boomer JS, Green JM: Una cola enigmática de la señalización CD28. Cold Spring Harb Perspect Biol 2010; 2(8): a002436.
- Kawalekar OU, O’Connor RS, Fraietta JA, et al: Distinct Signalling of Coreceptors Regulates Specific Metabolism Pathways and Impacts Memory Development in CAR T Cells. Inmunidad 2016; 44(2): 380-390.
- Cannons JL, Choi Y, Watts TH: Papel del factor 2 asociado al receptor del TNF y de la activación de la proteína cinasa activada por mitógenos p38 durante la respuesta inmunitaria dependiente del 4-1BB. J Immunol 2000; 165(11): 6193-6204.
- Lee HW, Nam KO, Park SJ, Kwon BS: El 4-1BB potencia la expansión de las células T CD8+ regulando la progresión del ciclo celular mediante cambios en la expresión de las ciclinas D y E y del inhibidor de la cinasa dependiente de ciclinas p27kip1. Eur J Immunol 2003; 33(8): 2133-2141.
- Zhao Z, Condomines M, van der Stegen SJC, et al: Structural Design of Engineered Costimulation Determines Tumour Rejection Kinetics and Persistence of CAR T Cells. Cancer Cell 2015; 28(4): 415-428.
- Milone MC, Fish JD, Carpenito C, et al: Los receptores quiméricos que contienen dominios de transducción de señales CD137 median una mayor supervivencia de las células T y una mayor eficacia antileucémica in vivo. Mol Ther 2009; 17(8): 1453-1464.
- Lim WA, June CH: Los principios de la ingeniería de células inmunitarias para tratar el cáncer. Cell 2017; 168(4): 724-740.
- Roselli E, Frieling JS, Thorner K, et al: Ingeniería de CAR-T: Optimización de los mecanismos de transducción de señales y efectores. BioDrugs 2019; 33(6): 647-659.
- Hombach AA, Holzinger A, Abken H.: The weal and woe of costimulation in the adoptive therapy of cancer with chimeric antigen receptor (CAR)-redirected T cells. Curr Mol Med 2013; 13(7): 1079-1088.
- Sadelain M, Brentjens R, Riviere I: Los principios básicos del diseño de receptores de antígenos quiméricos. Cancer Discov 2013; 3(4): 388-398.
- Redeker A, Arens R: Mejora de la terapia de células T adoptivas: el papel particular de la coestimulación de células T, las citocinas y la vacunación postransferencia. Front Immunol 2016; 7: 345.
- Weinkove R, George P, Dasyam N, McLellan AD: Selección de dominios costimuladores para receptores de antígenos quiméricos: consideraciones funcionales y clínicas. Clin Transl Immunology 2019; 8(5): e1049.
- Ceppi F, Rivers J, Annesley C, et al: Aféresis de linfocitos para la fabricación de células T con receptores de antígenos quiméricos en niños y adultos jóvenes con leucemia y neuroblastoma. Transfusion 2018; 58(6): 1414-1420.
- Li W, Guo L, Rathi P, et al: La reorientación de las células T hacia el glipican-3 con receptores de antígenos quiméricos 4-1BB Zeta produce una polarización Th1 y una potente actividad antitumoral. Hum Gene Ther 2017; 28(5): 437-448.
- Chmielewski M, Hombach AA, Abken H: Of CARs and TRUCKs: chimeric antigen receptor (CAR) T cells engineered with an inducible cytokine to modulate the tumour stroma. Immunol Rev 2014; 257(1): 83-90.
- Chmielewski M, Kopecky C, Hombach AA, Abken H.: La liberación de IL-12 por células T manipuladas que expresan receptores de antígenos quiméricos puede originar eficazmente una respuesta macrófaga independiente del antígeno en células tumorales que han desactivado la expresión del antígeno tumoral. Cancer Res 2011; 71(17): 5697-5706.
- Pegram HJ, Lee JC, Hayman EG, et al: Las células T dirigidas contra tumores modificadas para secretar IL-12 erradican los tumores sistémicos sin necesidad de acondicionamiento previo. Blood 2012; 119(18): 4133-4141.
- Koneru M, Purdon TJ, Spriggs D, et al: Las células T receptoras de antígenos quiméricos secretoras de IL-12 dirigidas a tumores erradican los tumores ováricos in vivo. Oncoinmunología 2015; 4(3): e994446.
- Koneru M, O’Cearbhaill R, Pendharkar S, Spriggs DR, Brentjens RJ: Un ensayo clínico de fase I de terapia de células T adoptivas utilizando receptores de antígenos quiméricos dirigidos MUC-16(ecto) secretores de IL-12 para el cáncer de ovario recurrente. J Transl Med 2015; 13: 102.
- Xu A, Bhanumathy KK, Wu J, et al: La señalización de la IL-15 promueve la supervivencia de las células T efectoras adoptivas y la formación de memoria en la linfopenia inducida por irradiación. Cell Biosci 2016; 6: 30.
- Lamers CH, Willemsen R, van Elzakker P, et al: Respuestas inmunitarias al vector transgénico y retroviral en pacientes tratados con células T de ingeniería ex vivo. Blood 2011; 117(1): 72-82.
- Magnani CF, Tettamanti S, Alberti G, et al: Células T CAR basadas en transposones en leucemias agudas: ¿Hacia dónde vamos? Células 2020; 9(6).
- Hudecek M, Ivics Z: Ingeniería celular terapéutica no viral con el sistema de transposones de la Bella Durmiente. Curr Opin Genet Dev 2018; 52: 100-108.
- Tipanee J, VandenDriessche T, Chuah MK: Transposones: Avanzando de los estudios preclínicos a los ensayos clínicos. Hum Gene Ther 2017; 28(11): 1087-1104.
- Vargas JE, Chicaybam L, Stein RT, et al: Vectores retrovirales y transposones para la terapia génica estable: avances, retos actuales y perspectivas. J Transl Med 2016; 14(1): 288.
- Ran FA, Hsu PD, Wright J, et al: Ingeniería del genoma mediante el sistema CRISPR-Cas9. Nat Protoc 2013; 8(11): 2281-2308.
- Birkholz K, Hombach A, Krug C, et al.: La transferencia de ARNm que codifica inmunorreceptores recombinantes reprograma las células T CD4+ y CD8+ para su uso en la inmunoterapia adoptiva del cáncer. Gene Ther 2009; 16(5): 596-604.
- Lamers CH, Sleijfer S, et al: Treatment of metastatic renal cell carcinoma with CAIX CAR-engineered T cells: clinical evaluation and management of on-target toxicity. Mol Ther 2013; 21(4): 904-912.
- Morgan RA, Yang JC, Kitano M, et al: Caso clínico de un acontecimiento adverso grave tras la administración de células T transducidas con un receptor de antígeno quimérico que reconoce ERBB2. Mol Ther 2010; 18(4): 843-851.
- Stavrou M, Philip B, Traynor-White C, et al: Un gen suicida basado en la caspasa 9 activada por la rapamicina. Mol Ther 2018; 26(5): 1266-1276.
- Di Stasi A, Tey SK, Dotti G, et al: La apoptosis inducible como interruptor de seguridad para la terapia celular adoptiva. N Engl J Med 2011; 365(18): 1673-1683.
- Moolten FL.: Quimiosensibilidad tumoral conferida por genes herpes timidina quinasa insertados: paradigma para una estrategia prospectiva de control del cáncer. Cancer Res 1986; 46(10): 5276-5281.
- Beltinger C, Fulda S, Kammertoens T, et al: Herpes simplex virus thymidine kinase/ganciclovir-induced apoptosis involves ligand-independent death receptor aggregation and activation of caspases. Proc Natl Acad Sci U S A 1999; 96(15): 8699-8704.
- Harrer DC, Simon B, Fujii SI, et al: Transfección de ARN de células T gamma/delta con un receptor de antígeno quimérico o un receptor de células T alfa/beta: una alternativa más segura a las células T alfa/beta modificadas genéticamente para la inmunoterapia del melanoma. BMC Cancer 2017; 17(1): 551.
- Krug C, Birkholz K, Paulus A, et al: Stability and activity of MCSP-specific chimeric antigen receptors (CARs) depend on the scFv antigen-binding domain and the protein backbone. Cancer Immunol Immunother 2015; 64(12): 1623-1635.
- Dörrie J, Babalija L, Hoyer S, et al: Los inhibidores de BRAF y MEK influyen en la función de las células T reprogramadas: consecuencias para la terapia de células T adoptivas. Int J Mol Sci 2018; 19(1).
- Harrer DC, Schuler G, Dörrie J, Schaft N: Células T CAR específicas de CSPG4 para la leucemia infantil de células B precursoras de alto riesgo. Int J Mol Sci 2019; 20(11).
- Wiesinger M, Marz J, Kummer M, et al: Clinical-Scale Production of CAR-T Cells for the Treatment of Melanoma Patients by mRNA Transfection of a CSPG4-Specific CAR under Full GMP Compliance. Cancers (Basilea) 2019; 11(8).
- Shi J, Ma Y, Zhu J, et al: A Review on Electroporation-Based Intracellular Delivery (Revisión sobre la administración intracelular basada en la electroporación). Molecules 2018; 23(11).
- Ernst M, Oeser A, Besiroglu B, et al: Terapia con células T con receptores de antígenos quiméricos (CAR) para personas con linfoma difuso de células B grandes en recaída o refractario. Cochrane Database Syst Rev 2021; 9(9): Cd013365.
- Pinc A, Somasundaram R, Wagner C, et al: Targeting CD20 in melanoma patients at high risk of disease recurrence. Mol Ther 2012; 20(5): 1056-1062.
- Schmidt P, Kopecky C, Hombach A, et al.: Eradication of melanomas by targeted elimination of a minor subset of tumor cells. Proc Natl Acad Sci U S A 2011; 108(6): 2474–2479.
- Brignole C, Marimpietri D, Pagnan G, et al: Neuroblastoma targeting by c-myb-selective antisense oligonucleotides entrapped in anti-GD2 immunoliposome: immune cell-mediated anti-tumour activities. Cancer Lett 2005; 228(1-2): 181-186.
- Mitri Z, Constantine T, O’Regan R: El receptor HER2 en el cáncer de mama: fisiopatología, uso clínico y nuevos avances en la terapia. Chemother Res Pract 2012; 2012: 743193.
- Slamon DJ, Godolphin W, Jones LA, et al: Estudios del protooncogen HER-2/neu en el cáncer de mama y ovario humano. Science 1989; 244(4905): 707-712.
- Zhang JG, Kruse CA, Driggers L, et al: Los perfiles de proteínas precursoras de antígenos tumorales de tumores cerebrales adultos y pediátricos identifican posibles dianas para la inmunoterapia. J Neurooncol 2008; 88(1): 65-76.
- Casucci M, Hawkins RE, Dotti G, Bondanza A: Superación de los obstáculos de toxicidad de las células T dirigidas genéticamente. Cancer Immunol Immunother 2015; 64(1): 123-130.
- Morgan RA, Yang JC, Kitano M, et al: Caso clínico de un acontecimiento adverso grave tras la administración de células T transducidas con un receptor de antígeno quimérico que reconoce ERBB2. Mol Ther 2010; 18(4): 843-851.
- Slamon DJ, Leyland-Jones B, Shak S, et al: Uso de quimioterapia más un anticuerpo monoclonal contra HER2 para el cáncer de mama metastásico que sobreexpresa HER2. N Engl J Med 2001; 344(11): 783-792.
- Wang Y, Geldres C, Ferrone S, Dotti G: El proteoglicano 4 de condroitín sulfato como diana para la inmunoterapia de tumores sólidos con células T basada en receptores de antígenos quiméricos. Expert Opin Ther Targets 2015; 19(10): 1339-1350.
- Beard RE, Zheng Z, Lagisetty KH, et al: Múltiples receptores de antígenos quiméricos se dirigen con éxito al proteoglicano 4 de condroitín sulfato en varias histologías diferentes de cáncer y células madre cancerosas. J Immunother Cancer 2014; 2: 25.
- Pellegatta S, Savoldo B, Di IN, et al: Expresión constitutiva e inducible por TNFalfa del proteoglicano de condroitín sulfato 4 en glioblastoma y neuroesferas: Implicaciones para la terapia con células CAR-T. Sci Transl Med 2018; 10(430).
- Geldres C, Savoldo B, Hoyos V, et al: Los linfocitos T redirigidos contra el proteoglicano de condroitín sulfato-4 controlan el crecimiento de múltiples tumores sólidos tanto in vitro como in vivo. Clin Cancer Res 2014; 20(4): 962-971.
- Abken H, Hombach A, Heuser C, Reinhold U.: Una estrategia novedosa en la eliminación de células de melanoma diseminadas: los receptores quiméricos dotan a las células T de especificidad tumoral. Resultados recientes Cancer Res 2001; 158: 249-264.
- Burns WR, Zhao Y, Frankel TL, et al: Un receptor de antígeno quimérico específico de antígeno asociado a melanoma de alto peso molecular redirige a los linfocitos hacia los melanomas humanos. Cancer Res 2010; 70(8): 3027-3033.
- Losch FO, Muller R, Mutschler B, et al: Activación de células T a través de receptores quiméricos específicos de antígenos tumorales: papel del dominio de señalización intracelular. Int J Cancer 2003; 103(3): 399-407.
- Reinhold U, Liu L, Ludtke-Handjery HC, et al: La lisis específica de células de melanoma por células T injertadas en el receptor se ve potenciada por anticuerpos monoclonales antiidiotípicos dirigidos al dominio scFv del receptor. J Invest Dermatol 1999; 112(5): 744-750.
- Schmidt P, Kopecky C, Hombach A, et al: Erradicación de melanomas mediante la eliminación selectiva de un subconjunto menor de células tumorales. Proc Natl Acad Sci U S A 2011; 108(6): 2474-2479.
- Harrer D, Simon B, Fujii SI, et al: Transfección de ARN de células T γ/δ con un receptor de antígeno quimérico o un receptor de células T α/β: una alternativa más segura a las células T α/β modificadas genéticamente para la inmunoterapia del melanoma. BMC Cancer 2017; 17: 551.
- Bumol TF, Reisfeld RA: Complejo único de glicoproteína-proteoglicano definido por anticuerpo monoclonal en células de melanoma humano. Proc Natl Acad Sci USA 1982; 79(4): 1245-1249.
- Ilieva KM, Cheung A, Mele S, et al: El proteoglicano 4 del sulfato de condroitina y su potencial como diana de inmunoterapia con anticuerpos en distintos tipos de tumores. Front Immunol 2017; 8: 1911.
- Schiffer D, Mellai M, Boldorini R, et al: La importancia del condroitín sulfato proteoglicano 4 (CSPG4) en los gliomas humanos. Int J Mol Sci 2018; 19(9).
- Van Sinderen M, Cuman C, Winship A, et al: El proteoglicano de sulfato de condroitina (CSPG4) regula la función del trofoblasto humano. Placenta 2013; 34(10): 907-912.
- Fukushi J, Makagiansar IT, Stallcup WB: El proteoglicano NG2 promueve la motilidad de las células endoteliales y la angiogénesis a través del compromiso de la galectina-3 y la integrina alfa3beta1. Mol Biol Cell 2004; 15(8): 3580-3590.
- Sakry D, Neitz A, Singh J, et al: Las células precursoras de oligodendrocitos modulan la red neuronal mediante la escisión ectodominio dependiente de la actividad de la NG2 glial. PLoS Biol 2014; 12(11): e1001993.
- Legg J, Jensen UB, Broad S, et al: Papel del proteoglicano condroitín sulfato del melanoma en el patrón de las células madre de la epidermis interfolicular humana. Development 2003; 130(24): 6049-6063.
- Ferrone S, Chen ZJ, Liu CC, et al: Mimetismo del antígeno humano de alto peso molecular asociado al melanoma mediante anticuerpos monoclonales antiidiotípicos de ratón MK2-23. Estudios experimentales y ensayos clínicos en pacientes con melanoma maligno. Pharmacol Ther 1993; 57(2-3): 259-290.
- Schlingemann RO, Rietveld FJ, de Waal RM, et al: Expresión del antígeno asociado al melanoma de alto peso molecular por los pericitos durante la angiogénesis en tumores y en heridas en cicatrización. Am J Pathol 1990; 136(6): 1393-1405.
- Midwood KS, Salter DM: Expresión del proteoglicano NG2/melanoma humano en condrocitos articulares adultos humanos. Osteoartritis Cartílago 1998; 6(5): 297-305.
- Tordsson JM, Ohlsson LG, Abrahmsen LB, et al: Anticuerpos de primate seleccionados por fagos y fusionados con superantígenos para la inmunoterapia del melanoma maligno. Cancer Immunol Immunother 2000; 48(12): 691-702.
- Petrini S, Tessa A, Carrozzo R, et al: El proteoglicano condroitín sulfato de melanoma humano/NG2 se expresa en el sarcolema de las miofibras esqueléticas humanas postnatales. Expresión anormal en las distrofias musculares merosin-negativas y de Duchenne. Mol Cell Neurosci 2003; 23(2): 219-231.
- Campoli MR, Chang CC, Kageshita T, et al: Antígeno humano de alto peso molecular asociado al melanoma (HMW-MAA): un proteoglicano de condroitín sulfato (MSCP) de la superficie celular del melanoma con importancia biológica y clínica. Crit Rev Immunol 2004; 24(4): 267-296.
- Beard RE, Abate-Daga D, Rosati SF, et al: Gene expression profiling using nanostring digital RNA counting to identify potential target antigens for melanoma immunotherapy. Clin Cancer Res 2013; 19(18): 4941-4950.
- Erfurt C, Sun Z, Haendle I, et al: Respuestas de células T CD4+ reactivas al proteoglicano de condroitín sulfato asociado al melanoma en pacientes con melanoma e individuos sanos en ausencia de autoinmunidad. J Immunol 2007; 178(12): 7703-7709.
- Natali PG, Giacomini P, Russo C, et al: Perfil antigénico de las células de melanoma humano. Análisis con anticuerpos monoclonales frente a antígenos de histocompatibilidad y frente a antígenos asociados al melanoma. J Cutan Pathol 1983; 10(4): 225-237.
- Berd D, Herlyn M, Koprowski H, Mastrangelo MJ: Determinación mediante citometría de flujo de la frecuencia y heterogeneidad de la expresión de los antígenos asociados al melanoma humano. Cancer Res 1989; 49(23): 6840-6844.
- Morgan AC Jr, Galloway DR, Reisfeld RA: Producción y caracterización de un anticuerpo monoclonal frente a una glicoproteína específica del melanoma. Hibridoma 1981; 1(1): 27-36.
- Morgan AC Jr, Woodhouse C, Bartholemew R, Schroff R: Antígenos humanos asociados al melanoma: análisis de la heterogeneidad antigénica mediante enfoques moleculares, serológicos y de citometría de flujo. Mol Immunol 1986; 23(2): 193-200.
- Li Y, Madigan MC, Lai K, et al: El melanoma uveal humano expresa inmunorreactividad NG2. Br J Ophthalmol 2003; 87(5): 629-632.
- Li Y, Wang J, Rizvi SM, Jager MJ, et al: La focalización in vitro del antígeno NG2 mediante el inmunoconjugado 213Bi-9.2.27 alfa induce citotoxicidad en células de melanoma uveal humano. Invest Ophthalmol Vis Sci 2005; 46(12): 4365-4371.
- Chekenya M, Rooprai HK, Davies D, et al: El proteoglicano condroitín sulfato NG2: papel en la progresión maligna de los tumores cerebrales humanos. Int J Dev Neurosci 1999; 17(5-6): 421-435.
- Godal A, Bruland O, Haug E, et al: Expresión inesperada del antígeno asociado al melanoma de 250 kD en células de sarcoma humano. Br J Cancer 1986; 53(6): 839-841.
- Shoshan Y, Nishiyama A, Chang A, et al: Expression of oligodendrocyte progenitor cell antigens by gliomas: implications for the histogenesis of brain tumours. Proc Natl Acad Sci U S A 1999; 96(18): 10361-10366.
- Yadavilli S, Hwang EI, Packer RJ, Nazarian J: El papel del proteoglicano NG2 en el glioma. Transl Oncol 2016; 9(1): 57-63.
- Behm FG, Smith FO, Raimondi SC, et al.: Human homologue of the rat chondroitin sulfate proteoglycan, NG2, detected by monoclonal antibody 7.1, identifies childhood acute lymphoblastic leukemias with t(4;11)(q21;q23) or t(11;19)(q23;p13) and MLL gene rearrangements. Blood 1996; 87(3): 1134–1139.
- Hilden JM, Smith FO, Frestedt JL, et al: Reordenación del gen MLL, anomalías citogenéticas 11q23 y expresión de la molécula NG2 en la leucemia mieloide aguda infantil. Blood 1997; 89(10): 3801-3805.
- Schwartz S, Rieder H, Schlager B, et al: Expresión del homólogo humano del NG2 de rata en la leucemia linfoblástica aguda del adulto: estrecha asociación con el reordenamiento MLL y un fenotipo de células B CD10(-)/CD24(-)/CD65s(+)/CD15(+). Leucemia 2003; 17(8): 1589-1595.
- Smith FO, Rauch C, Williams DE, et al: El homólogo humano del NG2 de rata, un proteoglicano de condroitín sulfato, no se expresa en la superficie celular de las células hematopoyéticas normales pero sí en los blastos de leucemia mieloide aguda de pacientes de mal pronóstico con anomalías de la banda cromosómica 11q23. Blood 1996; 87(3): 1123-1133.
- Wuchter C, Harbott J, Schoch C, et al: Detección de células de leucemia aguda con reordenamientos del gen de la leucemia de linaje mixto (MLL) mediante citometría de flujo utilizando el anticuerpo monoclonal 7.1. Leukemia 2000; 14(7): 1232-1238.
- Wang X, Osada T, Wang Y, et al: La proteína CSPG4 como nueva diana para la inmunoterapia basada en anticuerpos del cáncer de mama triple negativo. J Natl Cancer Inst 2010; 102(19): 1496-1512.
- Nicolosi PA, Dallatomasina A, Perris R: Impacto teranóstico del proteoglicano NG2/CSPG4 en el cáncer. Teranóstica 2015; 5(5): 530-544.
- de Vries JE, Keizer GD, te Velde AA, et al: Caracterización de los antígenos de superficie asociados al melanoma que intervienen en la adhesión y la motilidad de las células de melanoma humano. Int J Cancer 1986; 38(4): 465-473.
- Ozerdem U: La focalización en los pericitos disminuye la neovascularización en el melanoma uveal ortotópico en el ratón knockout del proteoglicano del antígeno nervioso/glial 2. Ophthalmic Res 2006; 38(5): 251-254.
- Ozerdem U: Dirigirse a los pericitos disminuye la neovascularización y la linfangiogénesis en el cáncer de próstata. Próstata 2006; 66(3): 294-304.
- Ampofo E, Schmitt BM, Menger MD, Laschke MW: Los mecanismos reguladores de la expresión de NG2/CSPG4. Cell Mol Biol Lett 2017; 22: 4.
- Stoiber S, Cadilha BL, Benmebarek MR, et al: Limitaciones en el diseño de receptores quiméricos de antígenos para la terapia del cáncer. Células 2019; 8(5).
- Sievers NM, Dörrie J, Schaft N: CARs: Más allá de las células T y los dominios de señalización derivados de células T. Int J Mol Sci 2020; 21(10).
- Harrer DC, Dörrie J, Schaft N: Receptores quiméricos de antígenos en diferentes tipos celulares: Nuevos vehículos se unen a la carrera. Hum Gene Ther 2018; 29(5): 547-558.
- Montagner IM, Penna A, Fracasso G, et al: Células NK-92 modificadas con CAR anti-PSMA: una terapia celular comercial para el cáncer de próstata. Células 2020; 9(6).
- Van Cutsem E, Machiels J, Van den Eynde M, et al: SO-009 – Estudios de fase 1 que evalúan la seguridad y la actividad clínica de la terapia CAR-T autóloga y alogénica basada en NKG2D en cáncer colorrectal metastásico. Anales de Oncología 2019; 30: iv124-iv125.
- Santoro SP, Kim S, Motz GT, et al: Las células T portadoras de un receptor antigénico quimérico contra el antígeno de membrana específico de la próstata median la disrupción vascular y provocan la regresión tumoral. Cancer Immunol Res 2015; 3(1): 68-84.
- Bansal R, Reshef R: Revving the CAR – Combination strategies to enhance CAR T cell effectiveness. Blood Reviews 2020: 100695.
- Harrer DC, Dorrie J, Schaft N: CARs y fármacos: formas farmacológicas de potenciar la terapia con células CAR-T. Int J Mol Sci 2023; 24(3).
DERMATOLOGIE PRAXIS 2024; 19(1): 14–24