Un asesoramiento interdisciplinar rápido cuando se diagnostica un tumor maligno es imprescindible y permite “tomar decisiones informadas” a los afectados. La protección de la fertilidad no debe empeorar el pronóstico. La omisión de información puede tener consecuencias en materia de responsabilidad. En las enfermedades benignas del espectro hematológico, reumatológico y ginecológico, es importante tener en cuenta la reducción de la reserva ovárica. Incluso con un riesgo medio o pequeño de daños en los ovarios, cabe esperar un acortamiento de la fase de vida fértil de hasta diez años. Tras una terapia gonadotóxica en la infancia, debe comprobarse la reserva de fertilidad en la mujer joven. La crioconservación de ovocitos en este momento puede permitir que el deseo de tener un hijo se cumpla en una fecha posterior.
<Según el Registro Alemán de Cáncer, cada año se diagnostica cáncer en Alemania a 1.800 niños de 1.500 años y a 30.000 adultos de entre 16 y 45 años; en Suiza, la cifra es de unos 250 niños al año. Con una tasa de supervivencia del 80% para los niños y del 50% para todos los grupos de edad, esto equivale a miles de supervivientes menores de 45 años cada año. Si añadimos las enfermedades benignas con terapia gonadotóxica, el número total de personas afectadas cuya fertilidad se ve reducida a causa de una enfermedad y la terapia correspondiente es mucho mayor. Actualmente también existen pruebas de que el embarazo tras un cáncer no empeora el pronóstico, incluso en tumores hormonodependientes como el carcinoma de mama. Por tanto, la protección de la fertilidad no es un tema exótico, sino que concierne a oncólogos, ginecólogos y médicos generalistas [1]. La atención se centra en el asesoramiento interdisciplinar oportuno junto con los médicos especialistas en reproducción para que los afectados -incluso en una situación excepcional que ponga en peligro su vida- puedan tomar una “decisión informada”. Por razones de espacio, en este documento me limito a la protección de la fertilidad en las mujeres.
Daños en la reserva ovárica
La cirugía, la quimioterapia y la radioterapia son los pilares de la terapia contra el cáncer. Los daños directos causados por el propio tumor o por medidas quirúrgicas afectan a los tumores malignos de la pelvis menor, es decir, los carcinomas de colon, ovario, útero y cuello uterino.
El efecto gonadotóxico de la quimioterapia depende de la sustancia, la dosis y la duración de la terapia, así como de la edad de la paciente y de la reserva ovárica (Tab. 1) [2]. Cabe esperar un aumento del riesgo de aborto o malformaciones en los primeros seis meses tras finalizar la quimioterapia. A diferencia de la quimioterapia, la radioterapia afecta a los ovarios y al útero [3].

El 90% de las pacientes tras la irradiación corporal total antes del trasplante de células madre presentan insuficiencia ovárica, tras la irradiación directa de la pelvis es casi el 100%. Los daños consecuentes de la radioterapia en la infancia sobre el útero son la fibrosis del miometrio y la atrofia del endometrio con un mayor riesgo de aborto y prematuridad. La transposición de los ovarios fuera del campo de irradiación no está exenta de problemas.
El método de preservación de la fertilidad que puede ofrecerse depende de el diagnóstico oncológico y el margen de tiempo hasta el inicio previsto de la terapia (tab. 2) . La técnica de vitrificación de ovocitos ha mejorado decisivamente las posibilidades de éxito. Paralelamente, la crioconservación de tejido ovárico con retransplante ha abandonado la fase experimental. Para ambas opciones, es importante recordar que los pacientes con tumores suelen tener un mayor riesgo de tromboembolismo, hemorragia o infección. Deben tomarse las precauciones adecuadas.

Criopreservación de ovocitos o cigotos
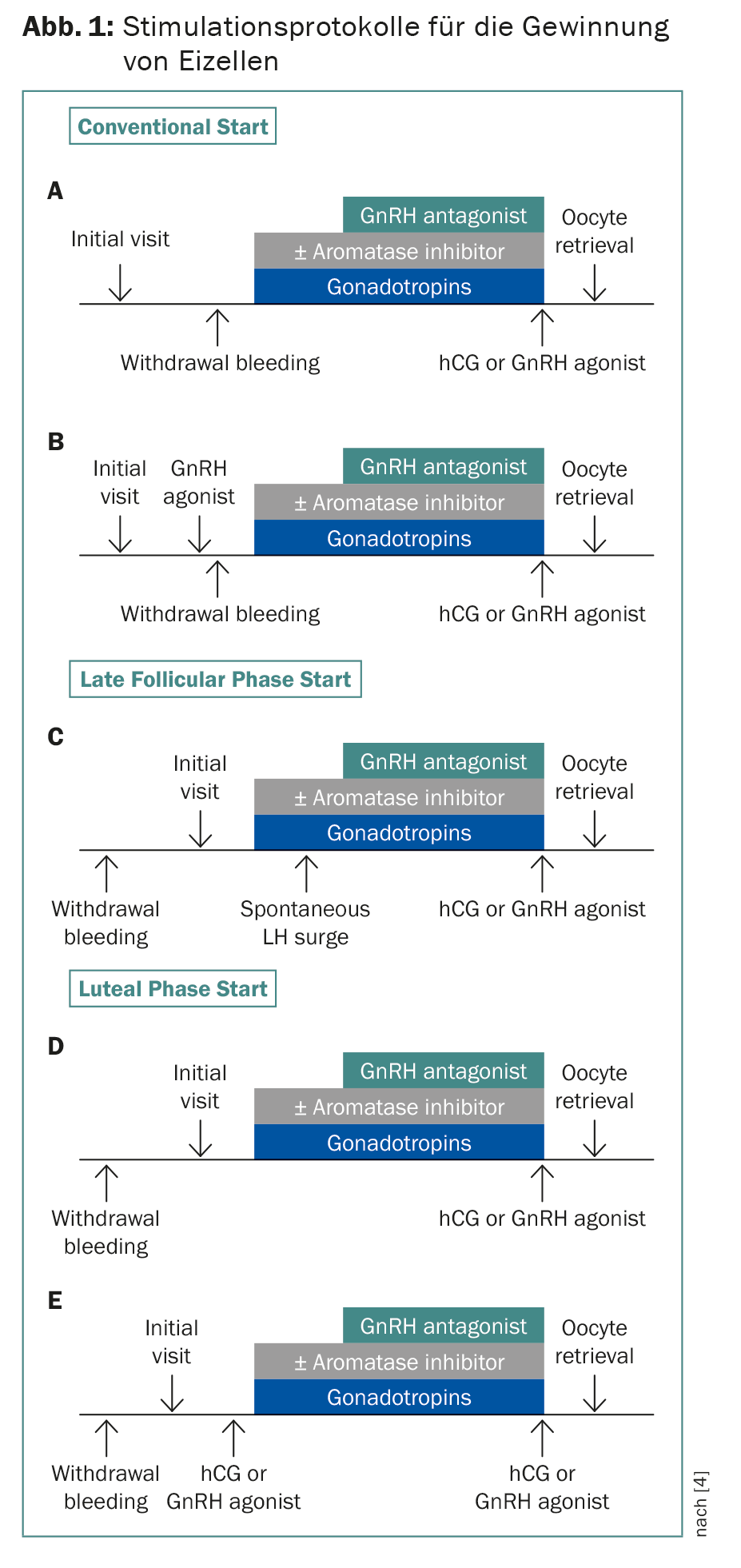
La crioconservación de cigotos y embriones está establecida desde hace años. Gracias a la técnica de vitrificación, ahora sobreviven más del 90% de los ovocitos. Dado que el tiempo suele ser esencial, se han desarrollado protocolos de estimulación que comienzan independientemente del inicio de la menstruación, con un retraso de dos a tres semanas para la quimioterapia (Fig. 1) . La doble estimulación también es posible, comenzando en las fases folicular y lútea. Esto significa que se puede obtener el doble de huevos en cuatro semanas. Esto es significativo porque en pacientes menores de 36 años se necesitan unos 12-14 ovocitos para el posterior nacimiento de un niño, y en pacientes de 37-39 años, más del doble [4]. La combinación con letrozol reduce los niveles de estrógenos, lo que es importante para los tumores hormonodependientes y para evitar el síndrome de hiperestimulación [5]. En principio, aconsejo la crioconservación de ovocitos en lugar de cigotos -incluso en una relación de pareja- para que la mujer conserve su autonomía reproductiva.
Criopreservación de tejido ovárico
Ya en 2004, Donnez publicó un artículo sobre un nacimiento tras un trasplante ortotópico de tejido ovárico [6]. Mientras tanto, el método ha abandonado la fase experimental. Por laparoscopia, se extirpa algo menos de la mitad de un ovario y se crioconserva. En un análisis retrospectivo de la red FertiPROTEKT, se registraron 21 embarazos tras 95 trasplantes en el restovar o en una bolsa peritoneal en la pelvis pequeña [7]. En 2011 nació el primer bebé suizo tras un retrasplante de tejido ovárico realizado por el equipo del Kinderwunschzentrum Baden. Para la crioconservación del tejido ovárico deben cumplirse una serie de condiciones (Tab. 3).

Análogos de la GnRh como terapia fertiprotectora adyuvante
El desarrollo de fármacos ovoprotectores es un objetivo urgente para permitir a las pacientes mantener una fertilidad natural tras la terapia citotóxica. Se están evaluando diversas sustancias, pero hasta ahora sólo se han establecido los análogos de la GnRh. La supresión de las gonadotropinas hasta niveles prepuberales y la reducción de la perfusión útero-ovárica se postulan como mecanismos protectores. Un amplio estudio prospectivo aleatorizado demostró que el riesgo de fallo ovárico prematuro puede reducirse en un 50% [8]. Se disiparon las preocupaciones de que la terapia con análogos de la GnRh pudiera reducir el efecto de la quimioterapia. Así pues, la terapia puede recomendarse generosamente, también en combinación con otros métodos.
Protección de la fertilidad antes de la menarquia
En la actualidad, más del 80% de todos los niños que desarrollan un cáncer en Suiza sobreviven. Dos de cada tres sufren efectos tardíos, incluida la esterilidad. Por supuesto, la idea de que una niña de diez años quiera tener hijos más adelante queda muy lejos en el momento del diagnóstico de cáncer; se trata de sobrevivir. Precisamente por eso es indispensable el asesoramiento interdisciplinario de los padres y -en la medida de lo posible- de los niños afectados, para que no se pierda ninguna decisión importante para “el más allá”. Eufóricamente, recientemente se ha publicado el primer retransplante con éxito tras la congelación de ovarios en la infancia [9]. La crioconservación de tejido ovárico es, por tanto, la única opción para la protección de la fertilidad en niñas y mujeres muy jóvenes, combinada con un procedimiento quirúrgico con complicaciones poco frecuentes como infecciones y hemorragias.
Sólo el 8% de las niñas con cáncer presentan un alto riesgo de fallo ovárico posterapéutico y, por tanto, se benefician de la crioconservación del tejido ovárico. Pero incluso con un riesgo bajo o medio, cabe esperar un periodo fértil acortado de hasta diez años. Esto es tanto más importante cuanto que tener hijos se aplaza cada vez más hasta el 4º decenio. La edad media de una mujer al nacer su primer hijo en Suiza es de 31 años, y la tendencia va en aumento. En consecuencia, todas las niñas supervivientes en la edad adulta joven deben recibir asesoramiento sobre su reserva ovárica. Se determina la hormona antimuller y el número de folículos antrales. Esto también es posible bajo anticoncepción oral, los valores son entonces alrededor de un 20% más bajos. Un ciclo espontáneo normal dice poco de una fase de vida fértil acortada. La criopreservación de óvulos a principios de la veintena podría dejar abierta la opción de que la joven pospusiera el deseo de tener un hijo hasta el momento deseado: después de la formación o la universidad.
Protección de la fertilidad en pacientes no oncológicos
La protección de la fertilidad se ha establecido ya en pacientes oncológicos. La situación es diferente para las enfermedades benignas que se tratan con sustancias gonadotóxicas (Tab. 4) . También es importante saber que las enfermedades autoinmunes como el lupus eritematoso per se pueden asociarse a una reducción de la reserva ovárica [10]. A diferencia de la situación aguda en la que se diagnostica una neoplasia, estas pacientes suelen disponer de tiempo suficiente para un asesoramiento diferenciado y la crioconservación de un número suficiente de ovocitos o cigotos antes de iniciar la terapia.

¿Qué nos depara el futuro?
Temas como la cirugía de preservación de órganos para el carcinoma epitelial de ovario en fase inicial, los tumores serosos limítrofes de ovario o los tumores de células madre ováricas, la terapia con progestágenos locales y sistémicos en la fase inicial del carcinoma de endometrio o incluso el trasplante de útero tras un carcinoma de cuello de útero son objeto de debate y ya se han probado en casos individuales. La maduración in vitro (MIV) de gametos inmaduros sigue siendo experimental [11]. En la actualidad, quedan muchas preguntas sin respuesta que deben ser aclaradas mediante estudios para poder ofrecer al paciente un abordaje adecuado y seguro.
Aspectos jurídicos de la protección de la fertilidad
La Ley Federal de Reproducción Médicamente Asistida permite expresamente el almacenamiento de células germinales durante un periodo ilimitado en caso de terapia gonadotóxica. En el caso de las neoplasias malignas, la mayoría de las afectadas son informadas sobre los métodos de preservación de la fertilidad; en el caso de los procesos benignos, esto es bastante raro antes de la terapia citotóxica. Ya se conocen casos de responsabilidad civil en caso de asesoramiento omitido (o no documentado) sobre la crioconservación de esperma. Por desgracia, los costes de la protección de la fertilidad no están cubiertos por el seguro médico.
La entrevista de asesoramiento
Una rápida evaluación interdisciplinar entre oncólogos y especialistas en fertilidad permite un asesoramiento diferenciado para las afectadas [12]. Esto implica cuestiones como el tipo y el estadio del tumor, la terapia prevista con un margen de tiempo antes de que comience, el riesgo de infertilidad tras la terapia oncológica, el estado general de la paciente, pero también su resistencia psicológica, su situación familiar y su entorno social. La terapia médica reproductiva nunca debe poner en peligro el pronóstico del paciente. La conversación con la paciente, posiblemente junto con su pareja o sus padres, se lleva a cabo según una lista de comprobación (tab. 5).

El examen clínico incluye la ecografía del útero y los ovarios (patología en la pelvis, tamaño uterino y ovárico y número de folículos antrales). La hormona antimulleriana se considera actualmente el parámetro pronóstico más importante en lo que respecta a la reserva ovárica.
Además de los detalles técnicos de una posible terapia, la sesión de asesoramiento también se centra en los aspectos emocionales [12]. El paciente y todo su entorno están bajo la conmoción de un diagnóstico amenazador. Términos como peligro de muerte, miedo a la muerte, pérdida, dolor, sufrimiento, pena e ira están presentes. Al hablar de la preservación de la fertilidad, del deseo de tener hijos más adelante, podemos establecer un contrapunto. Queremos dar espacio a la esperanza, la alegría y el sentido de la vida, a las reflexiones sobre la vida después del cáncer.
Literatura:
- von Wolff M, et al: Asesoramiento y tratamiento de preservación de la fertilidad por razones médicas: datos de una red multinacional de más de 5000 mujeres. Reprod Biomed Online 2015 nov; 31(5): 605-612.
- Meirow D, et al.: Toxicidad de la quimioterapia y la radiación en la reproducción femenina. Clin Obstet Gynecol 2010; 53: 727-739.
- Mahajan N: Preservación de la fertilidad en pacientes femeninas con cáncer: una visión general. J Hum Reprod Sci 2015; 8(1): 3-13.
- Cakmak H, et al: Método eficaz para la preservación urgente de la fertilidad: estimulación ovárica controlada de inicio aleatorio. Fertil Steril 2013; 100: 1673-1680.
- Rodríguez-Wallberg KA, et al: Preservación de la fertilidad y embarazo en mujeres con y sin cáncer de mama con mutación BRCA positiva. The Oncologist 2012; 17: 1409-1417.
- Donnez J, et al: Nacimiento vivo tras trasplante ortotópico de tejido ovárico crioconservado. Lancet 2004; 364: 1405-1414.
- Van der Ven, et al.: Noventa y cinco trasplantes ortotópicos de tejido ovárico tras tratamiento citotóxico en una red de fertilidad: actividad del tejido, tasas de embarazo y de parto. FertiPROTEKT 2015 (en preparación).
- Moore HC, et al: Goserelina para la protección ovárica durante la quimioterapia adyuvante del cáncer de mama. N Eng J Med 2015; 372: 923-932.
- Demeestere I, et al: Nacimiento con vida tras autoinjerto de tejido ovárico criopreservado durante la infancia. Hum Reprod 2015; 9: 2107-2109.
- Oktem O, et al: Función ovárica y resultados reproductivos de las pacientes con lupus eritematoso sistémico y estrategias para preservar su fertilidad. Obstet Gynecol Surv 2015; 70(3): 196-210.
- Tomao F, et al: Cuestiones especiales sobre la preservación de la fertilidad en las neoplasias ginecológicas. Crit Rev Oncol Hematol 2016 Jan; 97: 206-219.
- Baysal Ö, et al: La toma de decisiones en la preservación de la fertilidad femenina consiste en equilibrar la carga esperada del tratamiento de preservación de la fertilidad y el deseo de concebir. Hum Reprod 2015; 7: 1625-1634.
InFo ONCOLOGÍA Y HEMATOLOGÍA 2016; 4(1): 30-33