Alrededor de 200.000 pacientes en Suiza viven con un diagnóstico de insuficiencia cardiaca. Hasta un 10% de ellos desarrollan síntomas progresivos. ¿En qué momento se habla de insuficiencia cardiaca grave y qué se puede hacer entonces?
En 2018, la Asociación de Insuficiencia Cardiaca de la Sociedad Europea de Cardiología publicó un documento de posición sobre la insuficiencia cardiaca grave [1]. Este texto es en gran parte un resumen de las recomendaciones allí publicadas.
En Suiza, entre 150.000 y 200.000 pacientes están diagnosticados de insuficiencia cardiaca [2]. A pesar de los avances en la terapia de la insuficiencia cardiaca en los últimos años y de nuevos medicamentos como el sacubitrilo/valsartán, aproximadamente el 5-10% de los pacientes con insuficiencia cardiaca desarrollarán síntomas progresivos y sufrirán una insuficiencia cardiaca grave y progresiva [3–5]. El número de pacientes con insuficiencia cardiaca grave seguirá aumentando con la mejora de la supervivencia y el aumento de la incidencia de la insuficiencia cardiaca. Es fundamental que los proveedores de atención primaria y los cardiólogos de consulta reconozcan y diagnostiquen la insuficiencia cardíaca grave y remitan a los pacientes a un centro terciario de insuficiencia cardíaca en el momento adecuado. Sólo así podrán planificarse y aplicarse con éxito en una fase temprana otras opciones terapéuticas, como la inclusión en la lista de candidatos para un trasplante de corazón o el uso de sistemas de asistencia circulatoria mecánica (ACM).
Definición de insuficiencia cardíaca grave y determinación del pronóstico
Existen varias definiciones de insuficiencia cardiaca grave en la literatura [5–8]. Por su exhaustividad y aplicabilidad clínica, consideramos que la definición de la Asociación de Insuficiencia Cardíaca (HFA)-ESC publicada recientemente es muy útil para la práctica clínica. Deben cumplirse todos los criterios siguientes a pesar de un tratamiento óptimo de la insuficiencia cardíaca
- Síntomas graves y persistentes de insuficiencia cardiaca (clase III o IV de la NYHA)
- Disfunción cardiaca grave definida por una reducción de la FEVI <30%, insuficiencia ventricular derecha aislada o anomalías valvulares graves inoperables o anomalías congénitas o valores de BNP/NT-proBNP persistentemente elevados (alternativamente en aumento) y disfunción diastólica grave o anomalías estructurales del VI según la definición de la ESC de HFpEF y HFmrEF.
- Episodios de congestión pulmonar o congestión sistémica que requieran terapia intravenosa a altas dosis con diuréticos (o combinaciones de diuréticos), o episodios de bajo gasto que requieran inotrópicos o fármacos vasoactivos, o arritmias malignas que den lugar al menos a una presentación u hospitalización no planificada en los últimos 12 meses.
- Limitación grave del rendimiento físico, objetivada de forma óptima mediante una prueba de marcha de 6 minutos inferior a 300 metros o una espiroergometría con una captación máxima de O2 de (pVO2 <12-14 mL/kg/min) con sospecha de etiología cardiaca.
Además, la insuficiencia cardiaca avanzada se caracteriza por una disfunción orgánica sistémica (insuficiencia renal, caquexia cardiaca, insuficiencia hepática) y/o hipertensión pulmonar. En este sentido, un síndrome cardiorrenal o una pérdida de peso del 6% del peso corporal en 6 meses (definición de caquexia cardiaca) deben considerarse indicadores de insuficiencia cardiaca grave. La hipertensión pulmonar debida a causas cardiacas debe documentarse precozmente e interpretarse como un indicio de insuficiencia cardiaca avanzada. Si se detecta demasiado tarde, existe el riesgo de que su extensión sea una contraindicación para el trasplante de corazón. El deterioro asociado de la función cardiaca derecha también puede imposibilitar la terapia posterior con un dispositivo de asistencia ventricular izquierda.
Las enfermedades concomitantes se asocian muy a menudo a la insuficiencia cardiaca. En la definición de insuficiencia cardiaca grave, los criterios 1 y 4 también deben considerarse cumplidos si existe disfunción cardiaca según el criterio 2, pero gran parte de la limitación se explica por una comorbilidad (por ejemplo, una enfermedad pulmonar). Las comorbilidades como la diabetes, las enfermedades pulmonares (EPOC, apnea del sueño), la insuficiencia renal, la anemia, la carencia de hierro o las enfermedades reumáticas crónicas influyen considerablemente en el pronóstico de la insuficiencia cardiaca y deben tratarse lo mejor posible [9]. Por lo tanto, las comorbilidades deben incluirse definitivamente en la evaluación global y el pronóstico, ya que pueden, por un lado, reflejar la gravedad de la insuficiencia cardiaca y, por otro, cuestionarse como posibles contraindicaciones para las terapias de sustitución cardiaca (trasplante cardiaco, dispositivos de asistencia cardiaca). La disfunción de órganos terminales, en particular, tiene un impacto negativo en el pronóstico general. Las investigaciones adicionales para predecir una posible reversibilidad de la disfunción de los órganos finales tras el trasplante o el soporte cardiaco mecánico (por ejemplo, en la insuficiencia renal) son útiles, pero a menudo no son concluyentes.
La estratificación periódica del riesgo es esencial en la insuficiencia cardiaca grave para no perder el momento óptimo de derivación al centro de insuficiencia cardiaca e iniciar una mayor clarificación, tratamiento y seguimiento. La predicción del pronóstico y la estratificación del riesgo asociada no pueden realizarse sobre la base de un único parámetro, sino que requieren la inclusión de diferentes variables sensibles al pronóstico. Varias de estas puntuaciones multivariables han sido validadas clínicamente y se utilizan ampliamente. La puntuación de supervivencia a la insuficiencia cardiaca (HFSS) y el modelo de insuficiencia cardiaca de Seattle (SHFM) se encuentran entre las puntuaciones más utilizadas en la práctica clínica [10,11]. Otras puntuaciones son la puntuación (MECKI) (Datos de la prueba de esfuerzo metabólico combinados con la puntuación de los índices cardíaco y renal) y la puntuación MAGGIC Meta-Analysis Global Group in Chronic Herat Failure [12–15].
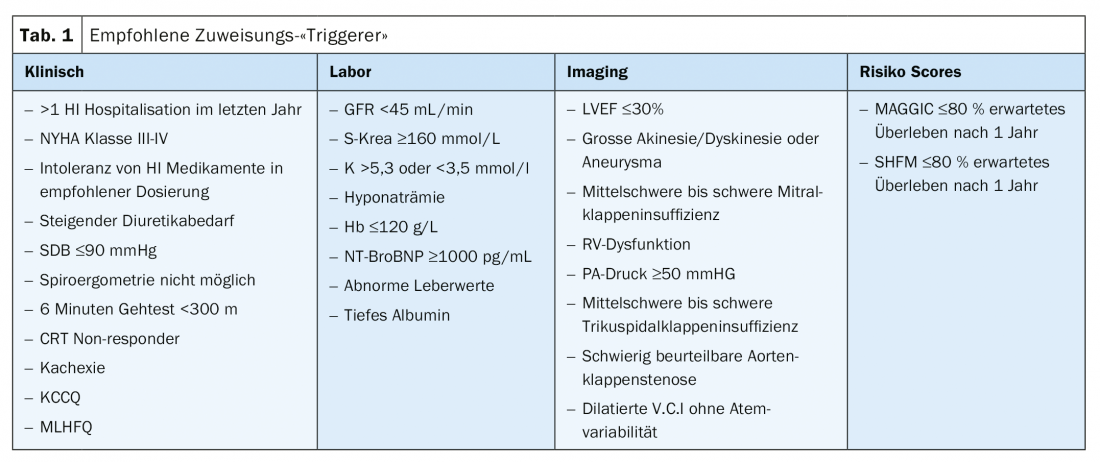
Aunque la obtención de una determinada puntuación (por ejemplo, HFSS) se asocia a una recomendación para la evaluación de la terapia de sustitución cardiaca, actualmente no existe un valor umbral por encima del cual deba realizarse la derivación a un centro de insuficiencia cardiaca. La tabla 1 enumera los factores desencadenantes clínicos, de laboratorio, de diagnóstico por imagen y de puntuación de riesgo enumerados por el HFA-ESC que deben conducir a la derivación a un centro de insuficiencia cardiaca. Con demasiada frecuencia, por desgracia, los pacientes son remitidos demasiado tarde. En general, si se cumple la definición de insuficiencia cardiaca grave, debe ponerse en contacto con un centro.
Espiroergometría y prueba de marcha de 6 minutos
La espiroergometría es una investigación clave para la estratificación del riesgo de los pacientes ambulatorios con insuficiencia cardiaca. Además de la información pronóstica, se generan datos objetivos sobre el rendimiento global, la limitación cardiopulmonar y la reserva cardiovascular.
Un consumo máximo de oxígeno (pVO2) ≤12 ml/kg/min (≤14 ml/kg/min sin tratamiento con betabloqueantes) se considera una indicación para ser incluido en la lista de trasplante cardíaco o SCM según las directrices [16]. Las mujeres que alcancen ≤50% del consumo máximo de oxígeno también podrían ser evaluadas para un trasplante de corazón si son menores de 50 años [16]. Si el equivalente respiratorio para el dióxido de carbono (V E/VCO2) es superior a 35, es un indicio de mal pronóstico.
La prueba de la marcha de 6 minutos es una prueba de ejercicio submáximo, a diferencia de la espiroergometría, que es una prueba de ejercicio máximo. Los resultados de los estudios relativos a la correlación con la supervivencia no son coherentes [17–20]. Si la espiroergometría no es posible, la prueba de la marcha de 6 minutos es una alternativa válida. Una distancia de marcha de <300 metros identifica a los pacientes con intolerancia grave al rendimiento.
Estrategias de tratamiento para pacientes con insuficiencia cardíaca grave
Sólo existen dos estrategias de tratamiento a largo plazo para la insuficiencia cardiaca grave si no se opta por un enfoque paliativo. Éstas son el trasplante de corazón o un sistema de asistencia circulatoria mecánica (SCM). Existen sistemas de asistencia circulatoria mecánica a corto plazo y fármacos vasoactivos intravenosos como soluciones puente. La terapia básica para la sobrehidratación son los diuréticos.
Tratamiento del riego excesivo
Los diuréticos de asa son la terapia básica para la hipervolemia. En la insuficiencia cardiaca grave, suele haber resistencia a los diuréticos y una insuficiencia renal creciente. El uso prolongado de diuréticos puede provocar diversos mecanismos de adaptación renal, como hipertrofia e hiperfunción en la zona de la nefrona distal, así como un aumento de la secreción de renina. Además, un aumento de los aniones urémicos y de la proteinuria puede mermar la eficacia de los diuréticos [21]. En la práctica clínica, se suele utilizar un bloqueo secuencial de las nefronas, una combinación de un diurético de asa y un diurético tiazídico (por ejemplo, Metolazone), para romper la resistencia a los diuréticos. Sin embargo, existen pocas pruebas a favor de este enfoque.
Con la llamada ultrafiltración, se puede extraer líquido de la sangre a través de una membrana semipermeable mediante una máquina de diálisis. Si no hay respuesta a los diuréticos perorales, se recomienda principalmente el cambio a la administración intravenosa. Debe iniciarse con una dosis más alta y aumentarse sucesivamente hasta conseguir una diuresis suficiente. Si no se consigue, se recomienda como siguiente paso una combinación de diuréticos con bloqueo secuencial de las nefronas, y sólo si estas medidas también fracasan debe considerarse la ultrafiltración en casos seleccionados [7,9].
Drogas vasoactivas intravenosas
Estos desempeñan un papel especialmente en la situación aguda en pacientes con evidencia de síndrome de bajo gasto e hipoperfusión. Además, está indicado en pacientes seleccionados como medida puente hasta la implantación de un SCM o la realización de un trasplante de corazón. Aunque los inotrópicos pueden mejorar los parámetros hemodinámicos, la mayoría de los estudios no muestran ninguna mejora en los resultados. Algunos estudios apuntan incluso a un empeoramiento del pronóstico [22–24]. Por lo tanto, debe evitarse el uso prolongado de inotrópicos. Sólo si no son posibles otras opciones terapéuticas, la terapia secuencial con inotrópicos puede utilizarse como medida paliativa en casos seleccionados [25,26].
Sistemas mecánicos de apoyo al ciclo: Sistemas a corto plazo
Los sistemas de asistencia circulatoria mecánica a corto plazo se utilizan en la fase aguda del shock cardiogénico. Permiten una ventana de tiempo durante la cual la función cardiaca puede recuperarse mediante una descarga máxima. Además, también se puede esperar el curso de la recuperación de otros sistemas orgánicos, como la función neurológica tras una parada cardiovascular. Sin embargo, si no se produce una mejora de la función cardiaca, los sistemas a corto plazo pueden proporcionar “un puente” hacia la implantación de un dispositivo de asistencia ventricular (DAV) a largo plazo o un trasplante de corazón, en caso de que se elija esa opción. Existen varios sistemas mecánicos de soporte de circuitos que pueden utilizarse durante un tiempo limitado. El balón de contrapulsación intraaórtico (BCIA) se implanta percutáneamente mediante un catéter. Se implanta un globo en la aorta descendente y se infla durante la diástole. Esto aumenta la presión diastólica en la raíz aórtica, lo que se traduce en una mejora de la perfusión coronaria. El desinflado del balón provoca una reducción de la poscarga y, por tanto, del consumo de oxígeno. En la actualidad, algunos centros utilizan la BCIA, sobre todo para el shock cardiogénico en la cardiopatía isquémica, aunque no se han demostrado pruebas de que mejore la mortalidad [1,27].
Una Impella es una bomba intravascular axial que también puede implantarse mediante catéter. Puede transportar hasta 5 litros de sangre por minuto del ventrículo izquierdo a la aorta ascendente, aliviando así al ventrículo izquierdo. La hemodinámica mejora y la presión de llenado disminuye; al mismo tiempo aumenta la presión de perfusión coronaria.
Aunque hasta la fecha no se han recogido datos claros sobre la mejora de la mortalidad, un pequeño estudio de registro demostró que el uso de un protocolo estandarizado con apoyo hemodinámico precoz mediante CP Impella en el shock cardiogénico puede asociarse a una mejora de los resultados y a una menor mortalidad [28].
En la oxigenación por membrana extracorpórea (OMEC), la sangre se oxigena fuera del cuerpo a través de una membrana en una máquina especial cardiopulmonar. Además de la asistencia respiratoria completa, la unidad ECMO incluye una bomba axial que permite alcanzar flujos de hasta 6 L/min. La ECMO veno-arterial periférica puede ser implantada por un cardiólogo intervencionista mediante la técnica de Seldinger y puede mantener la circulación en un corazón insuficiente y apoyar la oxigenación.
Los efectos hemodinámicos de la ECMO no son fisiológicos. Por un lado, se reduce la precarga del corazón al drenar la sangre del lado venoso. Por otro lado, la eyección de sangre oxigenada con un flujo de 4-6 L/min hacia la aorta provoca un aumento de la poscarga ventricular izquierda que, dependiendo de la disfunción cardiaca, puede conducir a un aumento del volumen ventricular izquierdo telediastólico y de la presión de llenado. Para evitar el edema pulmonar en esta situación, puede implantarse una Impella para aliviar el ventrículo izquierdo [29]. De forma similar al Impella, la ECMO puede utilizarse como “puente al trasplante” en la insuficiencia cardiaca grave terminal o como “puente a la decisión” en el shock cardiogénico.
Tratamiento a largo plazo de la insuficiencia cardíaca grave
Cuando los síntomas de la insuficiencia cardiaca ya no pueden controlarse o las funciones de los órganos finales están amenazadas, están indicadas las terapias avanzadas de la insuficiencia cardiaca. Un requisito previo es, por supuesto, que la terapia con fármacos y dispositivos se haya optimizado y agotado de acuerdo con las directrices. Además, los pacientes con indicación de revascularización deben ser revascularizados y los pacientes con cardiopatías valvulares deben recibir una sustitución valvular si está indicada.
Trasplante de corazón
Los pacientes con insuficiencia cardiaca grave refractaria sin causa tratable son candidatos potenciales a un trasplante de corazón si se han agotado las alternativas de tratamiento convencionales. El riesgo evaluado en la estratificación del riesgo debe dar lugar a una mortalidad de al menos >20% durante los 12 meses siguientes [30]. Además, debe garantizarse que un trasplante de corazón prolongue significativamente la supervivencia del paciente y mejore sustancialmente su calidad de vida. Los candidatos a un trasplante de corazón deben estar motivados y emocionalmente estables y mostrar un alto cumplimiento y adherencia a la terapia. La evaluación de las posibles comorbilidades es una parte importante del esclarecimiento preliminar para valorar el resultado de un trasplante [16,31]. Las contraindicaciones del trasplante cardiaco se enumeran en la tabla 2.
La evaluación previa al trasplante incluye una historia clínica completa, estado físico, espiroergometría, cateterismo cardiaco de izquierda a derecha, evaluación de la enfermedad arterial periférica, evaluación de la fragilidad y estado nutricional. Además, deben evaluarse las funciones de los órganos (riñón, hígado, pulmón) y se realizan pruebas de detección de enfermedades tumorales e infecciones activas. Deben calcularse las puntuaciones pronósticas y realizarse otras investigaciones en función de la presencia de comorbilidades [16]. Además, se lleva a cabo una evaluación psicosocial completa [32].

El primer trasplante de corazón se realizó en 1967 [33]. En Suiza se realizaron 50 trasplantes de corazón en 2018 [35]. La supervivencia media es de 12,5 años [34]. Las causas más comunes de mortalidad a largo plazo son el fallo del injerto, las infecciones y el fallo multiorgánico [34]. El riesgo de fallo agudo letal del injerto es mayor en los primeros 30 días tras el trasplante. Las complicaciones infecciosas con desenlaces mortales son más frecuentes en los primeros 12 meses debido a las altas dosis de inmunosupresores, incluidos los esteroides. El riesgo de una reacción de rechazo celular relevante disminuye significativamente después de dos años. En el curso a largo plazo, la mortalidad en el contexto de las enfermedades tumorales, la insuficiencia renal y la vasculopatía del trasplante adquiere mayor importancia [34].
Apoyo mecánico a largo plazo
Se utiliza una bomba cardiaca mecánica (Dispositivo de Asistencia Ventricular, DAV) para sostener el ventrículo izquierdo (DAVI), el ventrículo derecho (DAVD) o ambos ventrículos (BiVAD). Los estudios muestran una mejora de la supervivencia y la calidad de vida en pacientes con insuficiencia cardiaca grave refractaria [9]. Un DAV puede utilizarse como “puente al trasplante” mientras se espera un trasplante. Si un paciente no es candidato a un trasplante, por ejemplo debido a la edad, puede utilizarse un DAV como terapia de destino. Un aumento relevante de la resistencia vascular pulmonar o una insuficiencia renal grave son contraindicaciones para el trasplante de corazón pero no para la implantación de un DAV. Tanto la resistencia vascular pulmonar como la insuficiencia renal grave pueden mejorar con la terapia de DAV [36,37]. En estos casos, la terapia VAD se utiliza como “puente hacia la candidatura al trasplante”. Lo mismo se aplica a las enfermedades tumorales potencialmente curativas, en las que debe demostrarse un periodo libre de tumor de al menos 5 años antes de un posible trasplante de corazón. En casos poco frecuentes (por ejemplo, miocarditis fulminante), la terapia VAD puede utilizarse como “puente hacia la recuperación”.
En ausencia actual de una solución adecuada para la terapia de soporte cardiaco ventricular derecho o biventricular a largo plazo, la insuficiencia ventricular derecha grave sigue siendo una contraindicación para la implantación de un DAVI [38].
Terapia paliativa
De todos los pacientes con insuficiencia cardiaca grave, sólo unos pocos son aptos para un trasplante de corazón o una terapia de DAV. Cuando se han agotado todas las estrategias terapéuticas, los objetivos del tratamiento en la insuficiencia cardíaca grave terminal pasan de prolongar la vida a controlar los síntomas y optimizar la calidad de vida [39]. La terapia cardiológica convencional, puramente interna, suele ser insuficiente para aliviar el sufrimiento del paciente en esta situación y se recomienda un tratamiento multidisciplinar con la participación de especialistas en cuidados paliativos. El estudio PAL-HF demostró que un enfoque paliativo interdisciplinar conducía a una mejora de la calidad de vida y de los síntomas de ansiedad y depresión en comparación con la terapia estándar [40]. Por lo tanto, el acceso a los conceptos de tratamiento paliativo debería ser de bajo umbral para todos los pacientes con insuficiencia cardiaca grave. También se recomienda redactar un testamento vital detallado en una fase temprana. Si no se ha hecho, debería hacerse a más tardar antes de las terapias médicas intensivas. Los deseos individuales del paciente con respecto a las medidas para prolongar la vida, incluido el estado de actividad de un desfibrilador implantado, deben discutirse con regularidad y adaptarse a la evolución prevista de la enfermedad y documentarse en consecuencia [41]. Si es posible, la decisión de cuándo interrumpir las terapias de insuficiencia cardiaca avanzada (DAI, terapia VAD, inmunosupresión) debe dejarse en manos del paciente. Si el paciente no puede tomar esta decisión, deberán hacerlo sus familiares o cuidadores o un comité ético del hospital.
En resumen, la máxima prioridad es el reconocimiento de la insuficiencia cardiaca grave y la derivación precoz a un centro terciario de insuficiencia cardiaca. El centro de insuficiencia cardiaca debe realizar a intervalos regulares una estratificación adecuada del riesgo que incluya puntuaciones de riesgo establecidas, espiroergometría y cateterismo cardiaco derecho. Las opciones de tratamiento de la insuficiencia cardiaca grave han mejorado significativamente, sobre todo gracias a los importantes avances tecnológicos en el campo de los dispositivos de asistencia ventricular (DAV) de larga duración. Hoy en día, los sistemas de asistencia cardiaca también pueden ofrecerse a los pacientes mayores con un buen éxito terapéutico. El trasplante de corazón sigue siendo el tratamiento de referencia. Sin embargo, esto sigue siendo una rareza debido a la falta general de órganos. La conexión con un equipo de cuidados paliativos debe realizarse en una fase temprana y puede mejorar significativamente la calidad de vida de los pacientes afectados y sus familiares.
Mensajes para llevarse a casa
- Reconocer la insuficiencia cardiaca grave
- Remisión precoz a un centro terciario de insuficiencia cardiaca para iniciar otras investigaciones, tratamientos y seguimientos
- Conexión temprana con un equipo de cuidados paliativos
Literatura:
- Crespo-Leiro MG, et al: “Insuficiencia cardíaca avanzada: declaración de posición de la Asociación de Insuficiencia Cardíaca de la Sociedad Europea de Cardiología, Eur J Heart Fail, 20(11): 1505-1535, Nov. 2018, doi: 10.1002/ejhf.1236.
- Fundación Suiza del Corazón: “El reto de la insuficiencia cardíaca” [Online]. Disponible: www.swissheart.ch/de/forschung/medizinische-fortschritte/herzinsuffizienz.html
- Xanthakis V, et al: Prevalencia, correlatos neurohormonales y pronóstico de los estadios de insuficiencia cardiaca en la comunidad, JACC Heart Fail, 4(10): 808-815, jun. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Bjork JB, Alton KK, Georgiopoulou VV, et al: Definición de la insuficiencia cardíaca avanzada: una revisión sistemática de los criterios utilizados en los ensayos clínicos, J Card Fail, 22(7): 569-577, jul. 2016, doi: 10.1016/j.cardfail.2016.03.003.
- Fang JC, et al: Insuficiencia cardiaca avanzada (estadio D): declaración del Comité de Directrices de la Sociedad Americana de Insuficiencia Cardiaca, J Card Fail 21(6): 519-534, jun. 2015, doi: 10.1016/j.cardfail.2015.04.013.
- Metra M, et al: Insuficiencia cardiaca crónica avanzada: Declaración de posición del Grupo de Estudio sobre Insuficiencia Cardiaca Avanzada de la Asociación de Insuficiencia Cardiaca de la Sociedad Europea de Cardiología, Eur J Heart Fail 9(6-7): 684-694, 2007, doi: 10.1016/j.ejheart.2007.04.003.
- Yancy CW, et al: 2013 ACCF/AHA guideline for the management of heart failure: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines, Circulation 128(16), 1810-1852, oct. 2013, doi: 10.1161/CIR.0b013e31829e8807.
- Hunt SA, et al: 2009 Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation, J Am Coll Cardiol 53(15): e1-e90, abr. 2009, doi: 10.1016/j.jacc.2008.11.013.
- Ponikowski P, et al.: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Desarrollado con la contribución especial, Eur J Heart Fail 18(8): 891-975, ago. 2016, doi: 10.1002/ejhf.592.
- Aaronson KD, Schwartz JS, Chen TM, et al: Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation, Circulation, 95(12): 2660-2667, jun. 1997, doi: 10.1161/01.cir.95.12.2660.
- Levy WC, et al: El modelo de insuficiencia cardiaca de Seattle: predicción de la supervivencia en la insuficiencia cardiaca, Circulation 113(11): 1424-1433, mar. 2006, doi: 10.1161/CIRCULATIONAHA.105.584102.
- Agostoni P, et al: Datos de la prueba de esfuerzo metabólico combinados con índices cardíacos y renales, la puntuación MECKI: un enfoque multiparamétrico del pronóstico de la insuficiencia cardíaca, Int J Cardiol 167(6): 2710-2718, sep. 2013, doi: 10.1016/j.ijcard.2012.06.113.
- Agostoni P, et al: Puntuaciones pronósticas multiparamétricas en la insuficiencia cardiaca crónica con fracción de eyección reducida: una comparación a largo plazo, Eur. J Heart Fail 20(4): 700-710, abr. 2018, doi: 10.1002/ejhf.989.
- Corra U, et al: Los datos de la prueba metabólica de ejercicio combinada con la puntuación de los índices cardíaco y renal (MECKI) y el pronóstico en la insuficiencia cardíaca. Un estudio de validación, Int J Cardiol 203: 1067-1072, ene. 2016, doi: 10.1016/j.ijcard.2015.11.075.
- Pocock SJ, et al: Predicción de la supervivencia en la insuficiencia cardiaca: una puntuación de riesgo basada en 39 372 pacientes de 30 estudios, Eur Heart J 34(19): 1404-1413, mayo de 2013, doi: 10.1093/eurheartj/ehs337.
- Mehra MR, et al: The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation: A 10-year update, J. Heart Lung Transplant 35(1): 1-23, Jan. 2016, doi: 10.1016/j.healun.2015.10.023.
- Alahdab MT, Mansour IN, Napan S, Stamos TD: Six minute walk test predicts long-term all-cause mortality and heart failure rehospitalization in African-American patients hospitalized with acute decompensated heart failure, J Card Fail 15(2): 130-135, Mar. 2009, doi: 10.1016/j.cardfail.2008.10.006.
- Guazzi M, Dickstein K, Vicenzi M, Arena R: Prueba de la marcha de seis minutos y prueba de ejercicio cardiopulmonar en pacientes con insuficiencia cardiaca crónica: un análisis comparativo sobre aspectos clínicos y pronósticos, Circ Heart Fail 2(6): 549-555, Nov. 2009, doi: 10.1161/CIRCHEARTFAILURE.109.881326.
- Hulsmann M, et al: Predicción del resultado mediante la activación neurohumoral, la prueba de la marcha de seis minutos y el Cuestionario de Minnesota sobre la vida con insuficiencia cardíaca en una cohorte de pacientes ambulatorios con insuficiencia cardíaca congestiva, Eur Heart J 23(11): 886-891, jun. 2002, doi: 10.1053/euhj.2001.3115.
- Wolsk E, et al: Resting and exercise haemodynamics in relation to six-minute walk test in patients with heart failure and preserved ejection fraction, Eur J Heart Fail 20(4): 715-722, abr. 2018, doi: 10.1002/ejhf.976.
- Costanzo MR, et al: Extracorporeal ultrafiltration for fluid overload in heart failure: current status and prospects for further research, J Am Coll Cardiol 69(19): 2428-2445, mayo de 2017, doi: 10.1016/j.jacc.2017.03.528.
- Cuffe MS, et al: Milrinona intravenosa a corto plazo para la exacerbación aguda de la insuficiencia cardiaca crónica: un ensayo controlado aleatorizado, JAMA 287(12): 1541-1547, mar. 2002, doi: 10.1001/jama.287.12.1541.
- O’Connor CM, et al: La dobutamina intravenosa continua se asocia a un mayor riesgo de muerte en pacientes con insuficiencia cardiaca avanzada: conclusiones del ensayo internacional aleatorizado de supervivencia Flolan (FIRST), Am Heart J 138(1) Pt 1: 78-86, jul. 1999, doi: 10.1016/s0002-8703(99)70250-4.
- Packer M, et al: Efecto del levosimendán en la evolución clínica a corto plazo de los pacientes con insuficiencia cardiaca aguda descompensada, JACC Heart Fail 1(2): 103-111, abr. 2013, doi: 10.1016/j.jchf.2012.12.004.
- Comín-Colet J, et al: Eficacia y seguridad de la administración ambulatoria intravenosa intermitente de levosimendán en pacientes con insuficiencia cardíaca avanzada: ensayo aleatorizado multicéntrico LION-HEART, Eur J Heart Fail 20(7): 1128-1136, jul. 2018, doi: 10.1002/ejhf.1145.
- Altenberger J, et al: Eficacia y seguridad de las infusiones pulsadas de levosimendán en pacientes ambulatorios con insuficiencia cardíaca avanzada (estudio LevoRep): un ensayo multicéntrico aleatorizado, Eur J Heart Fail 16(8): 898-906, ago. 2014, doi: 10.1002/ejhf.118.
- Unverzagt S, et al: Contrapulsación con balón intraaórtico (BCIA) para el infarto de miocardio complicado con shock cardiogénico, Cochrane database Syst Rev 3: CD007398-CD007398, Mar. 2015, doi: 10.1002/14651858.CD007398.pub3.
- Costanzo MR, et al: Ultrafiltración frente a diuréticos intravenosos para pacientes hospitalizados por insuficiencia cardiaca aguda descompensada, J Am Coll Cardiol 49(6): 675-683, feb. 2007, doi: 10.1016/j.jacc.2006.07.073.
- Pappalardo F, et al: La implantación concomitante de Impella® sobre la oxigenación por membrana extracorpórea venoarterial puede mejorar la supervivencia de los pacientes con shock cardiogénico, Eur J Heart Fail 19(3): 404-412, mar. 2017, doi: 10.1002/ejhf.668.
- Ammirati E, et al: Indicaciones actuales para el trasplante cardiaco y el dispositivo de asistencia ventricular izquierda: un punto de vista práctico, Eur J Intern Med 25(5): 422-429, jun. 2014, doi: 10.1016/j.ejim.2014.02.006.
- Lund LH, et al: The Registry of the International Society for Heart and Lung Transplantation: Thirty-third Adult Heart Transplantation Report-2016; Focus Theme: Primary Diagnostic Indications for Transplant, J Heart Lung Transplant 35(10): 1158-1169, oct. 2016, doi: 10.1016/j.healun.2016.08.017.
- Lund LH, et al: El registro de la Sociedad Internacional de Trasplante de Corazón y Pulmón: trigésimo primer informe oficial sobre trasplante cardíaco en adultos-2014; tema central: retrasplante, J Heart Lung Transplant 33(10): 996-1008, oct. 2014, doi: 10.1016/j.healun.2014.08.003.
- Barnard CN: La operación. Un trasplante cardiaco humano: informe provisional de una operación realizada con éxito en el Hospital Groote Schuur, Ciudad del Cabo, S Afr Med J 41(48): 1271-1274, dic. 1967.
- Chambers DC, et al: The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation: Thirty-sixth adult lung and heart-lung transplantation Report-2019; Focus theme: donor and recipient size match, J Heart Lung Transplant 38(10): 1042-1055, oct. 2019, doi: 10.1016/j.healun.2019.08.001.
- Oficina Federal de Salud Pública, FOPH: Cifras sobre la donación y el transplante de órganos en Suiza. [Online]. Disponible: www.bag.admin.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-zu-transplantationsmedizin/zahlen-fakten-zur-spende-und-transplantation-von-organen.html#-1057919152.
- Hasin T, et al: Cambios en la función renal tras la implantación de dispositivos de asistencia ventricular izquierda de flujo continuo, J Am Coll Cardiol 59(1): 26-36, ene. 2012, doi: 10.1016/j.jacc.2011.09.038.
- Mikus E, et al: Reversibilidad de la hipertensión pulmonar fija en receptores de dispositivos de asistencia ventricular izquierda, Eur J Cardiothorac Surg 40(4): 971-977, oct. 2011, doi: 10.1016/j.ejcts.2011.01.019.
- Harjola VP, et al: Tratamiento contemporáneo de la insuficiencia ventricular derecha aguda: declaración de la Asociación de Insuficiencia Cardiaca y el Grupo de Trabajo sobre Circulación Pulmonar y Función Ventricular Derecha de la Sociedad Europea de Cardiología, Eur J Heart Fail 18(3): 226-241, mar. 2016, doi: 10.1002/ejhf.478.
- Whellan DJ, et al: Cuidados al final de la vida en pacientes con insuficiencia cardiaca, J Card Fail 20(2): 121-134, feb. 2014, doi: 10.1016/j.cardfail.2013.12.003.
- Rogers JG, et al: Palliative Care in Heart Failure: The PAL-HF Randomized, Controlled Clinical Trial, J Am Coll Cardiol, vol. 70, nº 3, pp. 331-341, jul. 2017, doi: 10.1016/j.jacc.2017.05.030.
- Bayoumi E, Sheikh F, Groninger H: Cuidados paliativos en el trasplante cardiaco: un modelo en evolución, Heart Fail Rev 22(5): 605-610, sep. 2017, doi: 10.1007/s10741-017-9613-8.
CARDIOVASC 2020; 19(1): 6-11