La insuficiencia cardiaca aguda es una situación potencialmente mortal que requiere una actuación rápida y planificada. ¿Cómo se produce la clarificación? ¿Qué medidas terapéuticas existen? Una mirada a la estabilización inicial en el hospital.
La insuficiencia cardíaca aguda (ICA) se define como la rápida aparición o empeoramiento de síntomas (a menudo disnea y ortopnea) y/o clínica
Signos de insuficiencia cardiaca (especialmente congestión). Se trata de una situación médica potencialmente mortal que requiere una evaluación y un tratamiento urgentes y, a menudo, la hospitalización [1].
Alrededor del 80% de los pacientes con IAH tienen una insuficiencia cardiaca crónica preexistente. Más del 50% padece insuficiencia cardiaca con fracción de eyección del ventrículo izquierdo preservada (ICfEp) [2]. En más de la mitad de los pacientes puede identificarse un factor desencadenante. La enfermedad arterial coronaria y la fibrilación auricular son las afecciones cardiacas subyacentes más comunes, y la diabetes es una comorbilidad muy frecuente. La mayoría de los pacientes son hiper o normotensos al ingreso. Sólo alrededor del 5-7% de todos los IAH son hipotensos (presión arterial sistólica <90 mmHg), lo que se asocia a un pronóstico desfavorable. Esto es especialmente cierto si la hipoperfusión está presente al mismo tiempo (periferia fría) [3].
Diagnóstico y evaluación pronóstica inicial
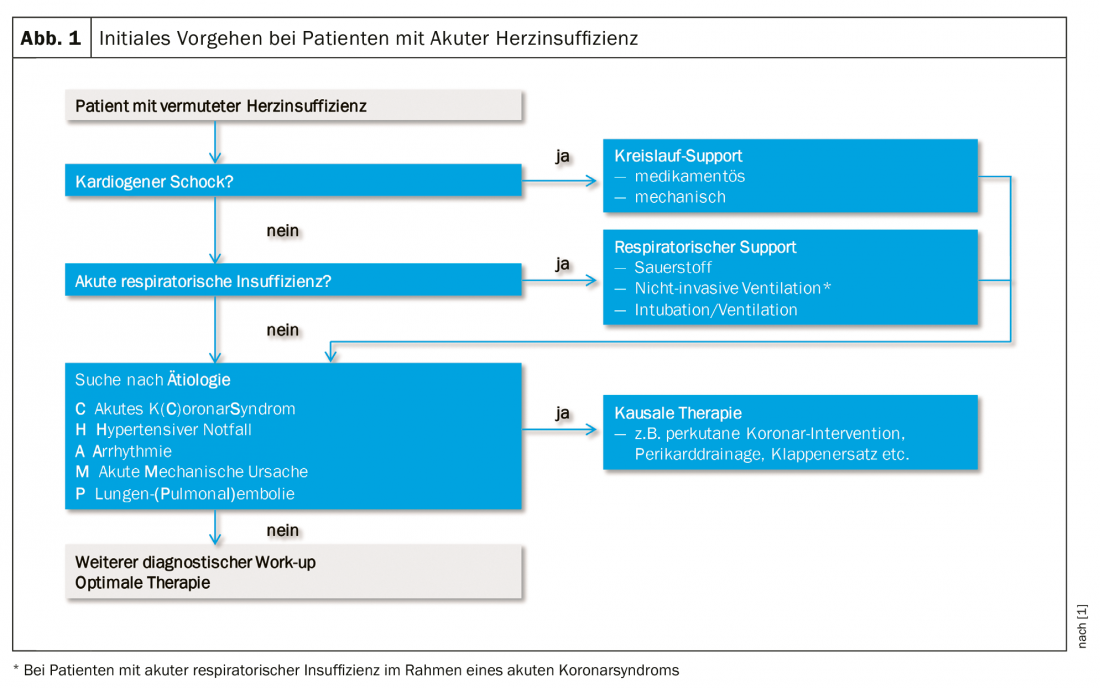
La exploración diagnóstica debe iniciarse lo antes posible (idealmente en la fase prehospitalaria, especialmente el ECG) para que pueda iniciarse precozmente la terapia causal. El beneficio del diagnóstico y la terapia precoces está bien establecido para la ICA en el contexto del síndrome coronario agudo. En la gestión de la IAH, el diagnóstico y la terapia van de la mano buscando sistemáticamente las condiciones y mecanismos que ponen en peligro la vida y tratándolos lo antes posible. (Fig. 1). Parte de la exploración inmediata es también la búsqueda de causas alternativas de la disnea aguda, principalmente neumonía, anemia grave e insuficiencia renal aguda. Además de la evaluación clínica del perfil hemodinámico, el diagnóstico inicial de sospecha de IHA incluye los siguientes componentes diagnósticos:
BNP o NT-proBNP: Puede excluirse un IAH en los valores <100 ng/l o <300 ng/l. Los valores elevados son proporcionales a la extensión del estrés miocárdico. Cuanto más elevados sean los péptidos natriuréticos, menos favorable será el pronóstico.
ECG de 12 derivaciones: Los valores normales del ECG hacen improbable una IAH. El ECG también puede dar pistas sobre el mecanismo de la insuficiencia cardiaca (infarto agudo, bradicardia, taquicardia).
Radiografía de tórax: mostrará si hay congestión venosa pulmonar, derrames pleurales, edema intersticial o alveolar o cardiomegalia. También se utiliza para buscar causas no cardiacas de disnea aguda como la neumonía o el neumotórax.
Diversos parámetros de laboratorio: Marcadores como la hemoglobina, la TSH, la CRP, la creatinina y las transaminasas pueden utilizarse para investigar los mecanismos y cofactores, así como los efectos del IAH. La troponina cardiaca también es un parámetro, pero debe considerarse como un marcador cuantitativo no específico del daño miocárdico y no siempre indicativo de infarto agudo.
Ecocardiografía: Debe realizarse en un plazo de 24 a 48 horas en todos los pacientes con IHA si la patología cardiaca es desconocida o inadecuadamente conocida. Los pacientes en shock cardiogénico, por otra parte, requieren una ecocardiografía inmediata, entre otras cosas en lo que respecta a problemas mecánicos que requieran un tratamiento agudo como la complicación mecánica del infarto y la insuficiencia valvular aguda grave.
Perfil hemodinámico como punto de partida
Si la terapia causal es posible (especialmente en el síndrome coronario agudo, la emergencia hipertensiva, la taquicardia o bradicardia, la embolia pulmonar aguda y las complicaciones mecánicas del infarto), ésta debe llevarse a cabo lo antes posible. De lo contrario, se inicia una terapia general de apoyo según el perfil clínico y hemodinámico [1,4]. Estas medidas de apoyo se establecen basándose en la experiencia clínica, pero no tienen un efecto demostrado sobre el pronóstico [5]. Todavía no existe ningún fármaco cuya administración en la fase aguda reduzca la mortalidad a corto o largo plazo. El objetivo de estas medidas es una rápida mejoría de los síntomas y la estabilización clínica para poder establecer la terapia de la insuficiencia cardiaca crónica. Las formas de tratamiento de la IHA pueden dividirse en medidas agudas, medidas durante la hospitalización y medidas antes del alta. Este artículo se centra en el diagnóstico y las medidas estabilizadoras iniciales durante la hospitalización. Dependiendo de la gravedad, el tratamiento inicial tiene lugar en la sala de urgencias/sala normal o en la sala de urgencias/unidad de cuidados intensivos, si es necesario con monitorización invasiva.
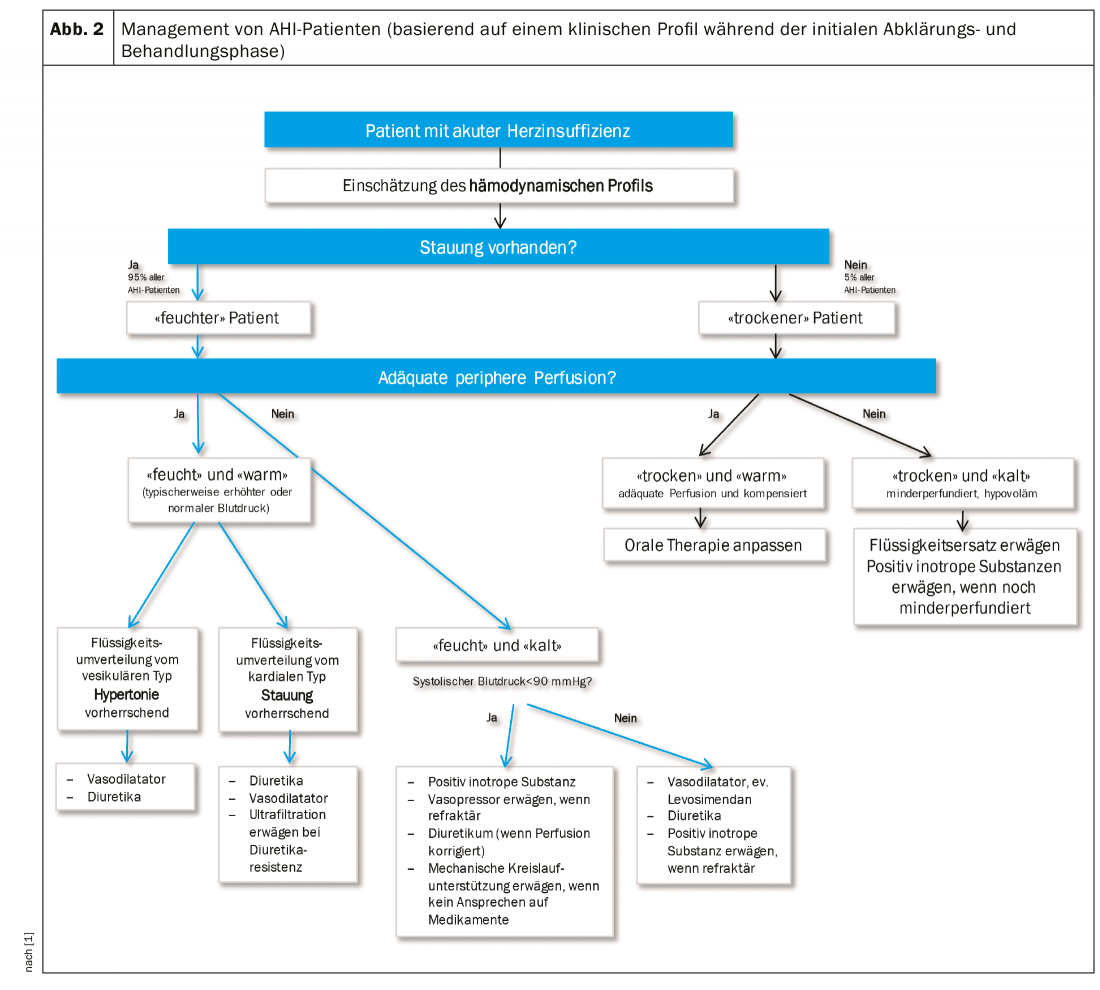
En función del estado de hidratación (“húmedo” o “seco”) y de la perfusión tisular (“caliente” o “frío”, a menudo sinónimo de normotónico frente a hipotónico), pueden distinguirse cuatro perfiles hemodinámicos, que proporcionan la dirección aproximada de la terapia (Fig.2).
Medidas generales
La administración de oxígeno debe limitarse a los pacientes con hipoxemia (SpO2 <90%). La ventilación no invasiva (CPAP/BiPAP) debe considerarse en casos de disnea pronunciada o hipoxemia (frecuencia respiratoria >25/min, SpO2 <90%) e iniciarse lo antes posible para evitar la intubación. Si se requiere intubación o electrocardioversión, la sedación con propofol debe utilizarse con precaución (riesgo de hipotensión, cardiodepresión). La sedación con midazolam es menos problemática, ya que cabe esperar menos efectos secundarios cardíacos.
Tratamiento farmacológico
En caso de empeoramiento agudo de una insuficiencia cardiaca crónica preexistente, debe continuarse en general el tratamiento farmacológico preexistente con inhibidores de la ECA, antagonistas de los receptores de angiotensina o sacubitrilo-valsartán, betabloqueantes y antagonistas de los receptores de mineralocorticoides. En caso de hipotensión (presión arterial sistólica<85 mmHg), deberá reducirse la dosis o interrumpirse temporalmente el tratamiento oral de la insuficiencia cardiaca. El siguiente resumen del tratamiento farmacológico de la insuficiencia cardíaca pretende ser un esquema que se adapte a la situación individual del paciente con insuficiencia cardíaca.
Nitratos/vasodilatadores: Todos los vasodilatadores tienen un doble efecto de reducción del tono venoso (precarga del corazón) y arterial (reducción de la poscarga). Los vasodilatadores están contraindicados con una tensión arterial sistólica <90 mmHg. También está indicado un uso muy prudente en casos de estenosis significativa de las válvulas mitral y aórtica. La administración continuada de nitratos puede provocar el desarrollo de tolerancia.
La administración peroral de nitroglicerina se realiza inicialmente en dos golpes de nitroglicerina à 0,4 mg o una cápsula à 0,8 mg. Se permiten repeticiones después de 5-10 minutos, mientras se controla la tensión arterial. En el curso, es posible un cambio a la aplicación transdérmica (5-10 mg).
Los vasodilatadores intravenosos (nitroglicerina, dinitrato de isosorbida, nitroprusiato o nesiritida) son muy eficaces para reducir la disnea bajo monitorización en unidades de cuidados intermedios o intensivos, aunque no existen pruebas científicas hasta la fecha [6].
Diuréticos: En las directrices actuales, el diurético es el fármaco principal para el tratamiento de la IAH [7]. Sin embargo, esto sólo se aplica a los pacientes con sobrecarga de volumen, principalmente el paciente “húmedo-caliente” y el “húmedo-frío”, si la presión arterial sistólica es >90 mmHg. Si se trata principalmente de un descarrilamiento hipertensivo que ha provocado una descompensación cardiaca izquierda, debe suspenderse el diurético en favor del nitrato si es posible.
El enfoque inicial para tratar la sobrecarga de volumen es una combinación de diuréticos y vasodilatadores si la presión arterial lo permite (>90 mmHg). Se requiere una estrecha vigilancia del estado de hidratación mediante controles clínicos (por ejemplo, llenado de la vena yugular, congestión pulmonar, edema periférico, peso corporal) y de laboratorio (potasio sérico y creatinina) [6]. El recuadro resume las líneas de dirección de la dosis.

Inotrópicos/vasopresores: Los fármacos con vasoconstricción periférica pronunciada como la norepinefrina o la dopamina en dosis más altas (>5 µg) pueden considerarse para su uso a corto plazo en la situación aguda si la perfusión tisular es insuficiente a pesar de un estado de llenado adecuado para abastecer a los órganos vitales. Sin embargo, esto tiene el precio de un aumento de la poscarga y un mayor riesgo de arritmia. Como alternativa, el levosimendán puede utilizarse para valores de presión arterial sistólica >85 mmHg. Encontrará más detalles sobre la dosificación en la directriz europea sobre el IAH [1].
Betabloqueante/Digoxina: En caso de empeoramiento agudo de una insuficiencia cardiaca crónica preexistente con tratamiento betabloqueante establecido, no debe suspenderse completamente el betabloqueante siempre que sea posible, sino reducir temporalmente la dosis. Para el tratamiento de la insuficiencia cardiaca aguda, el nuevo uso de un betabloqueante sólo está indicado en casos excepcionales, por ejemplo en caso de obstrucción dinámica intraventricular. La administración de un betabloqueante para controlar la frecuencia cardiaca (especialmente por vía intravenosa) sin conocer la función del VI puede provocar un shock cardiogénico. Sin embargo, en la fibrilación auricular taquicárdica y la función sistólica del VI preservada según determine la ecocardiografía, puede administrarse el betabloqueante para controlar la frecuencia. La digoxina también es una opción para el control de la frecuencia en la fibrilación auricular, incluso con una FEVI deteriorada.
Profilaxis de la tromboembolia, anticoagulación, inhibición de la agregación plaquetaria: La profilaxis de la tromboembolia, principalmente con una heparina de bajo peso molecular, está claramente recomendada para la reducción del riesgo de trombosis/embolia pulmonar. Para la fibrilación/flúter auricular y el síndrome coronario agudo, se aplican las directrices existentes para la anticoagulación y la terapia antitrombótica.
Antiarrítmicos/cardioversión: Además de la cardioversión eléctrica, pueden utilizarse fármacos antiarrítmicos como la amiodarona, la digoxina y (si se sabe que la función del VI está preservada) los betabloqueantes en los casos de IHA predominantemente relacionada con la taquicardia. Si la FA taquicárdica se tolera mal hemodinámicamente, puede necesitar una conversión inmediata (electroconversión). Alternativamente, con vistas a una electroconversión exitosa con un efecto duradero de uno a tres días, puede realizarse una saturación con amiodaronas. Los antiarrítmicos de clase IB/C están contraindicados en la disfunción del VI [8,11].
Opiáceos, ansiolíticos y sedantes: Puede considerarse el uso prudente de opiáceos en pacientes ansiosos con agitación grave y disnea. Sin embargo, la posible hipopnea debe detectarse precozmente mediante una monitorización adecuada. El uso prudente de benzodiacepinas (diazepam, lorazepam) es una alternativa a los opiáceos en pacientes agitados.
Otras opciones terapéuticas
Procedimientos de sustitución renal: La participación temprana de los nefrólogos es importante en pacientes con empeoramiento de la función renal en el IAH. El uso interdisciplinario de la terapia de sustitución renal se limita a los pacientes con ICA “cálidos y húmedos” que no responden o responden inadecuadamente a la terapia diurética. Las directrices europeas actuales mencionan los siguientes criterios: Oliguria sin respuesta adecuada a las dosis más altas de diuréticos, potasio sérico >6,5 mmol/l, urea sérica >25 mmol/l, creatinina sérica >300 µmol/l y pH <7,2 [1].
Opciones de terapia mecánica: El enfoque depende de la situación clínica y de la causa postulada del IAH. En caso de isquemia grave con shock cardiogénico, el vaso responsable de la isquemia aguda se trata principalmente mediante una intervención coronaria percutánea. Resultados recientes muestran que el tratamiento inmediato de todos los vasos coronarios no mejora el resultado [9]. El uso de dispositivos de asistencia circulatoria (balón de contrapulsación intraaórtico, dispositivos de asistencia ventricular) debe discutirse y determinarse en el equipo cardiológico con la participación de los médicos de urgencias y de cuidados intensivos.
La indicación convencional del balón de contrapulsación intraaórtico (BCIA) es previa a la corrección quirúrgica de problemas mecánicos agudos específicos (en la regurgitación mitral aguda grave, posiblemente en la rotura septal ventricular) y en el IAMCEST con enfermedad grave de 3 vasos en vista de una cirugía cardiaca urgente. Para otras causas de shock cardiogénico, no hay buenas pruebas científicas del beneficio del BCIA. Los dispositivos de asistencia ventricular y otras formas de soporte mecánico se utilizan como puente a la decisión o, en pacientes seleccionados, a más largo plazo [1]. Para determinar el momento adecuado de la cirugía cardiaca en caso de endocarditis, debe recabarse precozmente la opinión interdisciplinar de todo el equipo cardiaco o de endocarditis. La inserción aguda de VA-ECMO en pacientes en shock cardiogénico, esp. después de la reanimación con un “tiempo sin flujo” relativamente corto, también debe discutirse precozmente y de forma interdisciplinar con la participación de los médicos de urgencias y de cuidados intensivos.
Punción pleural y ascítica: La punción pleural puede provocar una rápida disminución de la disnea. La punción de la ascitis puede, a través de una disminución de la presión intraabdominal, contribuir a una mejora de la presión transrenal e indirectamente a una mejora de la función renal [10].
Mensajes para llevarse a casa
- La insuficiencia cardiaca aguda es la primera manifestación de la enfermedad cardiaca en aproximadamente el 20% de los casos. Suele ser la expresión de un empeoramiento agudo de la insuficiencia cardiaca crónica.
- Se trata de una situación potencialmente mortal que requiere una actuación rápida y estructurada.
- Las medidas terapéuticas se basan en el perfil hemodinámico, evaluando la perfusión (“caliente” frente a “fría”) por un lado y la congestión (“húmeda” frente a “seca”) por otro.
- En pacientes con disnea aguda y sospecha de insuficiencia cardiaca aguda, la medición de los péptidos natriuréticos ayuda en el diagnóstico diferencial. También proporciona información pronóstica (recomendación de clase IA).
Literatura:
- Ponikowski P, Voors AA, Anker S, et al: 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016; 37: 2129-2200.
- Maeder MT, Buser M, Rickli H, et al: Insuficiencia cardiaca con función ventricular izquierda preservada (HFpEF). Therapeutische Umschau 2018; 75: 161-169.
- Ambrosy AP, Fornarow GC, Butler J, et al: La carga sanitaria y económica global de las hospitalizaciones por insuficiencia cardiaca: lecciones aprendidas de los registros de insuficiencia cardiaca hospitalaria. J Am Coll Cardiol 2014; 63: 1123-1133.
- Nohria A, Tsang SW, Fang JC, et al: La evaluación clínica identifica perfiles hemodinámicos que predicen los resultados en pacientes ingresados con insuficiencia cardiaca. J Am Coll Cardiol 2003; 41: 1797-1804.
- Cheema B, Ambrosy AP, Kaplan RM, et al: Lecciones aprendidas en la insuficiencia cardiaca aguda. Eur J Heart Failure 2018; 20: 630-641.
- Wakai A, McCabe A, Kidney R, et al: Nitratos para los síndromes de insuficiencia cardiaca aguda. Cochrane Database Syst Rev 2013; 8: CD005151.
- Felker GM, Lee KL, Bull DA, et al: Estrategias diuréticas en pacientes con insuficiencia cardiaca aguda descompensada. N Engl J Med 2011; 364: 797-805.
- Directrices del ERC para la reanimación 2015. Resucitación 2015; 95: 1-80.
- Thiele H, Akin I, Sandri M, et al: Resultados a un año tras estrategias de ICP en shock cardiogénico. N Engl J Med 2018; doi: 10.1056/NEJMoa1808788 (publicación electrónica antes de impresión).
- Mullens W, Abrahams Z, Francis GS, et al: La reducción inmediata de la presión intraabdominal tras la extracción mecánica de fluidos de gran volumen mejora la insuficiencia renal en la insuficiencia cardiaca descompensada refractaria. J Card Fail 2008; 14: 508-514.
PRÁCTICA GP 2019; 14(8): 9-13